что влияет на днк человека
Что влияет на днк человека
Если эта ошибка остается неисправленной, синтез белка и репликация ДНК усложняется во много раз — это и есть мутагенез. Солнечный свет нужен для выработки витамина D. Однако образование пиримидиновых димеров является одной из основных причин меланомы. Помимо этого, ультрафиолетовое излучение вредно для глаз. Вывод: длительное пребывание на солнце вредно. Солнечные ожоги опасны. Пренебрегать кремами с UV-фильтрами и находиться под прямыми солнечными лучами — легкомысленно, а ходить в солярий запрещено категорически. Прочее взаимодействие с солнцем (пробежка по пляжу на рассвете, например) нужно и полезно.
Враг №2: активные формы кислорода Самый распространенный мутаген. Хитрость заключается в том, что эти активные формы генерируются в ходе самых обычных химических реакций, которые протекают в человеческом теле. Тут может возникнуть недоумение, ведь кислород — это газ, который содержится в атмосфере нашей планеты, с ним ассоциируется дыхание полной грудью, свежесть и еще какие-то приятные ощущения из рекламы стиральных порошков.
Разгадка кроется в названии. Кислород окисляет вещества, которые встречает на своем пути. Вспомните перекись водорода, которую выливают на разбитую коленку — примерно то же самое происходит в клеточных масштабах при выделении активных форм кислорода. Активные формы кислорода разрушают мембраны, из которых построены живые клетки, выдергивают отдельные основания из цепи ДНК и вносят разрывы. Страшно не только то, что они делают, но и то, как изощренно это происходит. Поскольку выделение АФК осуществляется постоянно, при поломке нейтрализующего их механизма клетки постоянно подвергаются бомбардировке мутагенами и гибнут в муках.
Важно учитывать собственную генетическую предрасположенность к усвоению витаминов, так как антиоксиданты при чрезмерном потреблении вредны: они могут препятствовать усвоению других микроэлементов.
Доказано: полезные пищевые привычки помогут избежать этого врага. Будьте аккуратны и не ешьте просроченные продукты. Старайтесь тщательно мыть продукты и готовить еду непосредственно перед употреблением. Впрочем, люди с непереносимостью глютена, лактозы или кофеина в отношении афлатоксина чувствуют себя немного спокойнее: больше половины продуктов из группы риска уже исключены из их меню. Такая особенность пищевого поведения, как привычка переедать, может быть вдвойне вредна в данной ситуации.
Враг №4: бензол. Бензол — химическое соединение, без которого невозможно представить современную жизнь. Это токсин и канцероген, который входит в состав нефти и бензина, а также широко применяется в производстве лекарств, пластмасс, резины и красителей. Если поместить человека в замкнутое пространство и постепенно закачивать туда бензол, то сначала он почувствует эйфорию. Затем появятся сонливость, тошнота, головная боль, мышечные подергивания. Если оставить испытуемого в этой камере на длительное время, то он умрет, если же его выпустить, то можно будет наблюдать целый комплекс расстройств, вызванных отравлением бензолом. Однако нам интересно не это. Бензол часто встречается в некачественной косметической продукции и пластмассовых изделиях, то есть не исключено систематическое отравление бензолом в небольших количествах, что может провоцировать возникновение различных видов гемато-онкологических заболеваний.
Доказано: витамины группы В — Ниацин, фолат и кобаламин — необходимы для репарации ДНК. Дефицит этих витаминов в первую очередь заметен при отравлении бензолом. Зачастую люди получают витамины этой группы с мясом животных. Подробнее узнать о том, на какие процессы влияют витамины группы В и как диагностировать их недостаток, можно по ссылке.
Берегите себя. Враги в лице мутагенов могут быть повсюду. Когда речь заходит о здоровом образе жизни, тем, кто пытается изменить все своими силами, приходится балансировать между массой советов и здравым смыслом. Граница зыбкая и устоять на ней больше шансов у того,, кто знает себя и не наносит себе вред.
А не замахнуться ли нам на. изменение генома?
А не замахнуться ли нам на. изменение генома?
Ученые научились редактировать молекулу ДНК в интересующем месте
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Человек стремится покорить природу, и ключ для этого — ДНК. Но чтобы подобраться к молекуле ДНК и повлиять на нее, необходимо использовать точнейшие молекулярные инструменты — белки или РНК. В этой статье рассказывается о новейшем инструменте для внесения мутаций в геном in vivo — сиквенс-cпецифичных нуклеазах.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
История изучения ДНК непроста, как и любое значительное исследование. Открыта она была еще в 1868 году Иоганном Фридрихом Мишером, который выделил некое вещество, содержащее азот и фосфор, из остатков клеток в гное [1]. После того, как Мишер обнаружил, что оно обладает кислотными свойствами, вещество назвали нуклеиновой кислотой. Однако долгое время функция ДНК была неясной: ее считали всего лишь способом запасания фосфора в организме. Данная теория считалась правильной почти до середины XX века; в качестве косвенного доказательства ученые ссылались на однообразное, по их мнению, строение молекулы ДНК (состоящей исключительно из четырех различных видов нуклеотидов: дезоксиаденозина — А, дезоксигуанозина — G, дезокситимидина — Т, дезоксицитидина — С).
Функцию ДНК, естественно, открыли раньше, чем ее вторичную структуру, которая оставалась неизвестной вплоть до 1953 года. Соответственно, из-за этого не могли установить, как проходят такие процессы как передача наследственной информации, как белки распознают определенные последовательности в ДНК и т.п.
В 1949–1951 годах Эрвин Чаргафф сформулировал свои знаменитые правила, которые говорят о строгом соотношении количества азотистых оснований внутри каждой молекулы ДНК [4] (в частности, что количество аденина равняется количеству тимина, а количество цитозина — количеству гуанина); затем Морисом Уилкинсом и Розалиндой Франклин были получены рентгеноструктурные данные, несущие структурную информацию о ДНК. На основании этих двух фактов Френсис Крик и Джеймс Уотсон предложили структуру двойной спирали ДНК [5], которая была доказана позднее в опытах Мэтью Мезельсона и Франклина Сталя [6].
Как только была открыта вторичная структура ДНК, стало легче предсказывать, а затем доказывать экспериментами механизмы различных процессов, происходящих с ДНК. Репликация (удвоение молекулы ДНК), транскрипция (перенос генетической информации с ДНК на РНК), различная регуляция экспрессии генов стали главными проблемами, интересующими молекулярных биологов.
Очевидно, что для осуществления этих процессов необходимы определенные белки, которые, в свою очередь, взаимодействуют как друг с другом, так и с ДНК. И если некоторые стадии протекают неспецифично (например, у эукариот репликация ДНК может начаться во множестве участков ДНК [7]), то, например, регуляция экспрессии генов происходит с помощью взаимодействия белков с довольно консервативными, т.е. строгими последовательностями ДНК.
Эндонуклеазы рестрикции: «Режем ДНК в нужном вам месте!»
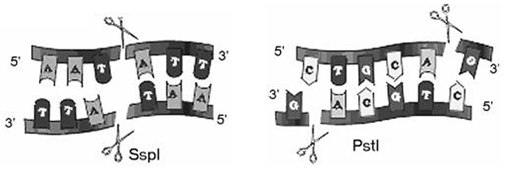
Одними из первых открытых белков, специфически связывающих ДНК, являются эндонуклеазы рестрикции. Это ферменты, которые разрезают ДНК по специфическим нуклеотидным последовательностям, называемым сайтами рестрикции (рис. 1) [8].
Рисунок 1. Рестрикция с образованием а) «тупых» концов; б) «липких» концов
Сам термин «рестрикция» появился благодаря исследованиям фага λ и феномена контролируемой рестрикции и модификации бактериальных вирусов клетками-хозяевами. Этот процесс был впервые обнаружен в результате работ Сальвадора Лурии [9] и Джузеппе Бертани [10] в 1950-х годах. Ученые обнаружили, что если фаг λ хорошо растет в одном штамме Escherichia coli, то в другом штамме его рост падает на несколько порядков, т.е. клетка-хозяин может снижать его биологическую активность. Оказалось, что запрет роста — «рестрикция» — вызывается ферментативным расщеплением ДНК фага. Соответственно, и фермент, отвечающий за этот процесс, назвали ферментом рестрикции.
Сами ферменты были обнаружены в лабораториях Вернера Арбера и Мэттью Мезельсона [11]; причем эндонуклеазы, которые исследовались в их работах, принадлежали, как определили позже, к I классу эндонуклеаз рестрикции. Они разрезают ДНК в случайном месте снаружи от места распознавания, причем как минимум на расстоянии 1000 нуклеотидов.
В 1970-х годах Гамильтон Смит, Томас Келли и Кент Велкокс выделили и охарактеризовали первую эндонуклеазу рестрикции II класса. Этот тип ферментов рестрикции более удобен для лабораторного использования, поскольку расщепляет ДНК внутри своего сайта распознавания, который, как правило, представляет собой палиндром из 4–8 нуклеотидов. Кроме того, эндонуклеазы этого класса не нуждаются в энергетической молекуле АТФ для активности, — только в ионах магния в качестве кофактора.
В 1990-х и ранних 2000-х годах были открыты другие представители данного семейства, которые не соответствовали всем критериям этого класса ферментов [12]. На данный момент уже открыты эндонуклеазы типов IIB, IIE, IIF, IIG, IIM, IIS, IIT. Возможно, в будущем этот список еще значительно расширится.
Существует также III класс эндонуклеаз рестрикции. Они были также открыты как компоненты прокариотической защитной системы против чужеродной ДНК. Эндонуклеазы III типа распознают две отдельных последовательности ДНК длиной 5–6 нуклеотидов и разрезают её примерно через 20–30 пар после сайта распознавания. Для их работы необходимы молекулы АТФ.
Эндонуклеазы рестрикции используют для обработки ДНК в различных лабораторных экспериментах. Обычно их применяют для вставки генов в процессах генного клонирования и экспериментах по исследованию белков.
Кроме того, эндонуклеазы могут быть использованы для выявления различий в аллелях гена [13]. Это возможно только в случае, если мутация произойдет в сайте узнавания, содержащемся внутри аллеля. Таким образом, отпадает нужда в дорогостоящем секвенировании гена; в частности, до изобретения секвенирования обработка эндонуклеазами рестрикции использовалась для картирования геномов.
Одно из новейших применений нуклеаз — внесение с помощью них различных изменений в геном клетки, таких как мутации уже имеющихся генов, вставка новых генов или вырезание исходных. Это очень перспективное направление генной инженерии с широчайшими возможностями практического применения! О нем будет рассказано в следующем разделе.
Эндонуклеазы — это эффекторы, т.е. белки действия. Если они окажутся у цели, то точно ее разрежут. Но природные белки распознают лишь небольшое число последовательностей ДНК, что накладывает огромные ограничения на использование этого уникального инструмента. Ах, если бы можно было доставить эндонуклеазу к любой желаемой последовательности ДНК.
Революция в области ДНК-связывающих белков: «Доставим ваш белок по любому адресу ДНК, используя TAL-эффекторы или CRISPR/Cas9-систему»
Одной из наиболее заманчивых идей для ученых является возможность напрямую точечно влиять на работу клетки. Для этого необходимо прицельно воздействовать на ДНК именно в области интересующего гена. Воздействие может быть разного характера: включение/выключение гена, внесение мутации и др. Для этого потребовалось уметь синтезировать белки, узнающие конкретную последовательность ДНК («следопыты»), к которым можно было бы пришить белки «действия».
Недавно открытые белки TAL-эффекторы и система Cas9 произвели настоящую революцию в нацеливании различных эффекторов на специфическую последовательность ДНК!
TAL-эффекторы: «Используем паразитов во благо»
TAL-эффекторы (Transcription Activator Like Effectors) — белки, синтезируемые многочисленным видами бактерий рода Xanthomonas — паразитами растений. Они были открыты в 2009 году практически одновременно несколькими группами ученых. TAL-эффекторы активируют считывание нужных паразитам генов в растениях-хозяевах (крайне специфично связываясь с хозяйской ДНК), что облегчает бактериальную колонизацию этого растения и выживание бактерий внутри него [14].
TAL-эффектор можно мысленно поделить на три части (рис. 2); наибольший интерес представляет средняя, крайне консервативная центральная область белка, состоящая из повторяющихся блоков размером 34 аминокислоты. В 2009 же году была показана простая и однозначная связь между повторами и узнаваемыми нуклеотидами. Блоки отличаются друг от друга лишь аминокислотами № 12 и № 13, которые и определяют вид нуклеотида, распознаваемый данным мономером. На каждый из четырех нуклеотидов ДНК приходится определенное сочетание этих аминокислот TAL-эффектора [15]; т.е. можно представить себе этот белок как паровозик, состоящий из одинаковых вагонов, центральное окошко которых покрашено в один из четырех цветов.
Рисунок 2. Строение TAL-эффектора на примере avrBs3
Простота «TALE-кода» открывает многочисленные возможности для биологического применения этих белков. Недавние исследования показали, что можно специально подобрать «вагоны» для искусственного «паровозика» и синтезировать ранее не существовавшие в природе белки для узнавания конкретных последовательностей ДНК в различных типах клеток — как растений, так и млекопитающих. Многие группы ученых уже используют искусственные TAL-эффекторы, узнающие новые последовательности ДНК, например, в томатах, Arabidopsis thaliana [16] и клетках человека [17].
Синтезированные TAL-эффекторы также сшивают с каталитическим доменом нуклеазы (см. раздел «Эндонуклеазы рестрикции») для создания TAL-эффекторных нуклеаз. Эти нуклеазы могут быть полезны для генной инженерии и генной терапии [18].
TAL-нуклеазы используют для создания двуцепочечных разрывов в строго определенном месте ДНК. Известно, что нарушенные таким образом гены клетка может чинить двумя путями: либо просто соединением концов (что может привести к случайным мутациям), либо заново синтезируя поврежденную цепь по комплементарной ей цепи ДНК (т.н. гомологичная рекомбинация).
Во втором случае вырезается значительный по длине участок ДНК, а вместо него по комплементарной (на краях разрыва) матрице синтезируется вставка, закрывающая брешь [19]. Если в клетку поместить ДНК специально мутированного гена, то он будет использован в качестве донорной матрицы, и в геном встроится желаемая мутация. Можно таким методом даже вырезать отдельные гены — или вставлять новые! Таким образом, благодаря разработанной технике сборки ДНК-узнающих повторов, TAL-эффекторы в составе гибридных белков предоставляют возможность направить желаемый эффектор к любой специфической последовательности ДНК — и добиться самых разных воздействий на ДНК: от регуляции транскрипции до внесений мутаций.
CRISPR/Cas9 система: «Неожиданное альтернативное применение защитного комплекса бактерий»
В нашем организме, после того, как мы переболели какой-то болезнью, остаются клетки памяти иммунной системы, которые при повторном попадании в организм вредителей активизируются и помогают ускоренно справиться с ними.
Бактерии справляются со своими патогенами с помощью аналогичной «системы памяти»: CRISPR/Cas-системы обеспечивают иммунитет бактерий и архей против вирусов и плазмид. Этот защитный комплекс состоит из:
Этот комплекс был открыт в 2012 году при совместной работе ученых из США, Швейцарии, Австрии и Швеции [20], [21].
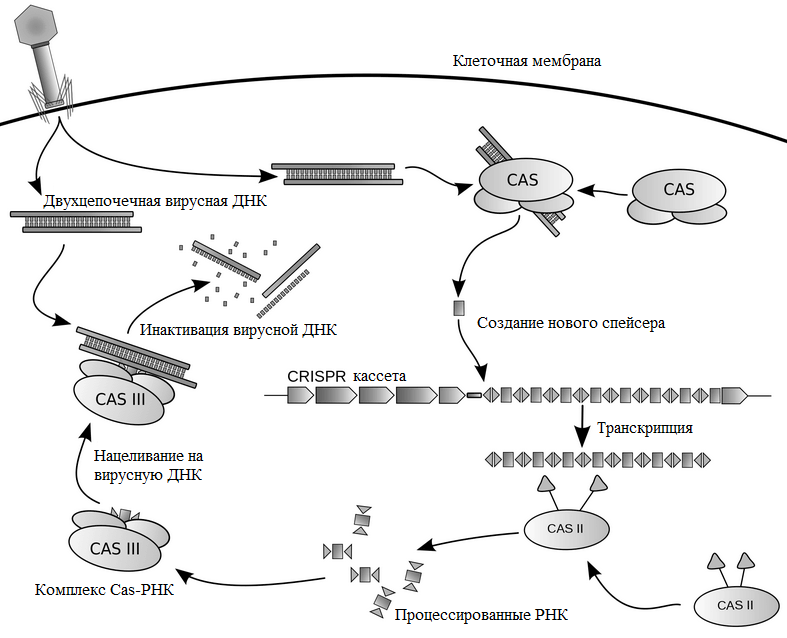
Иммунитет, обусловленный CRISPR/Cas, возникает за три стадии (рис. 3). В первой фазе бактерии или археи, у которых в геноме есть «блокнотик для записи» — CRISPR-кассета, — отвечают на появление вируса включением в конец кассеты коротких фрагментов чужеродной ДНК. На следующей стадии происходит транскрипция — считывание этой свежевключенной последовательности (образование описанных выше двух РНК) и обработка их нуклеазами. Теперь эти РНК могут специфично связаться с вирусной ДНК, и это взаимодействие через цепь событий приводит к ее расщеплению и «смерти» вредителя.
Рисунок 3. Схема работы комплекса Cas—РНК и CRISPR-кассеты
Грубо говоря, ситуация напоминает сказку про репку: первая РНК связывается с «репкой» — чужеродной ДНК — и «зовёт» вторую, вторая — специальный белок Cas9, который уже осуществляет двухцепочечный разрыв цепи чужой ДНК [22].
Несмотря на то, что в природе две РНК системы Cas9 разделены, учёные показали, что химерная РНК, представляющая собой сшитые в одну цепь вышеуказанные РНК, так же способна направлять Cas9 к ДНК-мишени. Более того, при соблюдении ряда условий можно менять последовательность первой внутри химерной РНК так, чтобы нацеливать Cas9 на желаемые гены.
Эта система даже проще TAL-эффекторов, поскольку для распознавания одного дезоксирибонуклеотида ДНК не нужен громоздкий «вагон» белка: один рибонуклеотид РНК легко и точно узнаёт комплементарный ему дезоксирибонуклеотид ДНК мишени! Экономия как в размере инструмента, так и в легкости его синтеза.
К настоящему времени показано, что эта система работает не только в археях и бактериях, но и в организмах рыб (Danio rerio), а также в клетках млекопитающих [23]. Уже установлено, что, как и в случае TAL-эффекторных нуклеаз, обработка ДНК Cas9-системой приводит к эффективному (10–30% случаев) возникновению мутаций.
Человек стремится покорить природу, и ключ для этого — ДНК. Но чтобы подобраться к ДНК и повлиять на нее, необходимо спуститься на молекулярный уровень и использовать белки или РНК. Сейчас развитие данных направлений идет стремительно, каждый месяц случаются значительные прорывы в этой области. Кто знает, какие чудеса ожидают нас через год? Возможно, будет найдена новая система, максимально упрощающая исходно сложный и кропотливый процесс вмешательства человека в работу природы.
Губительным для ДНК является весь ближний ИК-диапазон излучения
Рис. 1. Разные варианты пространственной организации плазмидной ДНК позволяют обнаружить разрыв нитей. Цельная суперскрученная молекула ДНК (слева) при разрыве одной нити превращается в расслабленную (в центре), а при двойном разрыве — в линейную (справа). Рисунок из статьи A. Travers, G. Muskhelishvili, 2005. DNA supercoiling — a global transcriptional regulator for enterobacterial growth?
Эксперименты с облучением плазмидной ДНК инфракрасным светом с длиной волны 2,2 микрона показали, что разрывы нитей ДНК происходят не реже, а чаще, чем в ближнем ИК-диапазоне. Молекулярный механизм такого процесса связан вовсе не с электронами, появляющимися при поглощении света, а с гидроксил-радикалами OH, которые при большой пиковой мощности излучения становятся вращательно-возбужденными и эффективно разрезают одну или обе нити молекулы ДНК.
Воздействие радиации на ДНК
Все, наверное, наслышаны, что радиация — то есть потоки фотонов, электронов и прочих частиц — опасна для всего живого. Более того, этот сугубо научный факт уже давно стал основой, на которой вырастают многочисленные и зачастую неоправданные страхи перед любыми словосочетаниями со словами «радиация» или «атомный». Между тем, до сих пор плохо понято, как именно радиация влияет на живые клетки, за счет каких конкретных молекулярных механизмов определенная доза ионизирующего излучения разрушает биологические молекулы (прежде всего, ДНК) и убивает живые клетки. В недавнем выпуске журнала Physical Review Letters появилась статья, сообщающая о новых и несколько неожиданных аспектах того, как инфракрасное излучение большой мощности разрушает молекулы ДНК. Не исключено, что эта работа потребует пересмотра критериев того, какие мощности на каких длинах волн в ИК-диапазоне должны считаться безопасными для здоровья.
Вообще, разрушение ДНК под действием облучения может происходить по разным причинам. Самая банальная — это тепловое воздействие, и именно оно первым делом приходит на ум, когда говорят про инфракрасное излучение. Большой поток излучения, попадающего в живую ткань, приводит к локальному энерговыделению, повышению температуры, из-за чего молекула ДНК расплетается или разрушается.
Но радиация может разрушать ДНК и тогда, когда поток излучения не настолько велик, чтобы существенно нагревать среду. В этом случае каждый отдельный электрон или фотон, поглотившийся в биологической жидкости в непосредственной близости от ДНК, порождает каскад молекулярных процессов, которые в конце концов приводят к разрыву одной или, реже, обеих нитей ДНК. Новая статья касается как раз этого, нетеплового, разрушения ДНК.
С точки зрения молекулярной физики, разрыв нити ДНК — это просто разрыв некоторых химических связей. Двойной разрыв — это два таких события на обеих нитях, произошедшие очень близко друг к другу. Если однократный разрыв еще можно починить, достроив молекулу по второй (комплементарной) нити, то двойной разрыв просто разрезает ДНК на части. В принципе, организовать такой разрыв несложно — надо лишь передать молекуле ДНК большую энергию, причем передать ее надо напрямую. Эта энергия вытащит из молекулы несколько электронов, химические связи в ней нарушатся, и нити смогут разорваться. Такие процессы начинаются выше порога ионизации ДНК, который составляет несколько десятков электронвольт. Для ионизирующего излучения высокой энергии это и есть основной механизм воздействия. Частица с энергией в мегаэлектронвольты за счет ионизации вещества производит на своем пути несколько тысяч электронов на каждый МэВ потерянной энергии, и каждый из этих электронов имеет шанс разорвать нить ДНК. Однако для частиц меньшей энергии такой разрыв за счет «грубой силы» уже не работает. Например, энергия одного оптического фотона составляет всего 2 эВ, что существенно меньше порога ионизации; энергия инфракрасных фотонов и того меньше. Кроме того, под действием излучения энергия гораздо чаще выделяется не непосредственно в молекуле ДНК, а в жидкости рядом с ней. Поэтому возникает вопрос о том, может ли эта (и без того небольшая!) энергия передаться ДНК, приводит ли она к разрыву нитей, и если да, то как именно это происходит.
Детальное изучение всех этих процессов началось не так давно, в 1990–2000-е годы. Выяснилось, что да, разрыв нитей может вполне эффективно идти и ниже порога ионизации ДНК, а сам механизм, с помощью которого низкоэнергетическая частица порождает такие разрывы, очень сложен и включает в себя разнообразные короткоживущие промежуточные состояния. Например, в 2000 году исследователи с удивлением обнаружили, что электроны с довольно небольшой энергией 8 эВ приводят к разрывам ДНК в несколько раз чаще, чем электроны с энергией в 13 эВ. Получается, действие электронов вовсе не сводится к простой передаче энергии для разрыва химических связей. Вместо этого электроны, образуя промежуточные отрицательно заряженные ионы, резонансно запускают некоторые молекулярные процессы, которые уже затем разрывают связи, а сами ионы быстро исчезают. Но даже если не принимать во внимание саму молекулу ДНК, а просто попытаться разобраться, что вообще происходит в воде на атомарном уровне, когда там возникает электрон с энергией несколько эВ (прилетевший извне или выбитый фотонами), то и здесь картина явлений оказывается очень богатой. Благодаря экспериментальным методам, появившимся в арсенале физиков не так давно, исследователи обнаружили, что один-единственный электрон приводит к целому каскаду сверхбыстрых молекулярных процессов, разворачивающихся на временном масштабе порядка пикосекунды.
В общем, молекулярные механизмы биологического эффекта радиации оказались чрезвычайно сложными; современное состояние дел для низкоэнергетических электронов описано в обзоре 2011 года.
Роль гидроксил-радикалов

Рис. 2. Электрофорезное определение пространственной конфигурации плазмидной ДНК. Три разных формы движутся с разной скоростью под действием электрического поля. По относительной яркости полосок можно определить процент ДНК каждой формы. На фотографии справа показано, что до облучения (−) почти вся ДНК находится в сверхспиральном состоянии, а после облучения (+) переходит в другие формы. Изображение из обсуждаемой статьи
Чтобы это описание не казалось чистым теоретизированием, полезно пояснить, на примере той работы 2011 года и новой статьи, как экспериментаторы вообще выясняют, какой процент молекул ДНК испытывает разрывы и что в этом виновато — электроны или OH-радикалы.
Для этого экспериментаторы используют плазмиды бактериальных ДНК — небольшие свернутые в кольцо кусочки молекулы ДНК, которые в своем обычном состоянии находятся в форме «суперскрученной» спирали (так называемая сверхспирализация ДНК). Способность к сверхспирализации — важная характеристика ДНК, помогающая компактному ее хранению и выполнению своих функций. Разрыв одной нити позволяет сверхспирали распутаться — она переходит в «расслабленную» форму; двойной разрыв превращает ее в линейную молекулу (рис. 1). Все эти три формы эффективно разделяются с помощью стандартной методики гелевого электрофореза (рис. 2), поскольку они «ползут» под действием электрического поля с разной скоростью. Поэтому, сравнив полосочки до облучения и после облучения, можно по их яркости узнать, какой процент сверхспирализованных плазмид приобретает расслабленную или линейную форму.
Для выяснения того, какой из молекулярных механизмов разрывает ДНК, экспериментаторы добавляют в раствор специальные вещества, которые быстро поглощают свободные электроны или свободные OH-радикалы, нейтрализуя их действие. Измеряя процент разрывов ДНК в зависимости от концентрации электрон-нейтрализующих или радикал-нейтрализующих агентов, можно сделать выводы относительно их роли в разрушении ДНК. Например, если электроны играют важную роль в разрушении ДНК, то при их нейтрализации количество разрывов сильно уменьшится. Если они не играют роли — оно не изменится.
Рис. 3. Конфигурации плазмидной ДНК pBR322 до облучения (−) и после облучения (+). Слева: облучение на длине волны 1,35 мкм, справа: на длине волны 2,2 мкм. Черным, красным и синим цветами показаны исходная (сверхспиральная), расслабленная и линейная конфигурации, соответственно. Изображение из обсуждаемой статьи
Обычно считается правдоподобным, что чем более длинноволновое излучение мы используем, тем слабее — при фиксированной мощности — должны быть вызванные им эффекты, поскольку энергия отдельных фотонов становится меньше. Результаты новых экспериментов полностью противоречат этому предположению. Выяснилось, что излучение на длинах волн 1,35 мкм и 2,2 мкм разрушают ДНК сильнее, чем в предыдущих экспериментах с ближним ИК-светом. После трех минут облучения практически вся сверхспиральная ДНК в образце получила разрывы по крайней мере в одной нити (рис. 3). Более того, на 2,2 мкм существенная доля всех ДНК получает двойной разрыв и становится линейной (именно этот факт и подчеркивается на рис. 2 и 3).
Такая закономерность кажется, на первый взгляд, парадоксальной: энергия фотонов меньше, а биологический эффект от них сильнее. Однако авторы утверждают, что нашли молекулярный механизм этого эффекта. Поскольку гидроксил-радикалы появляются при столкновении возбужденных молекул воды, они сами по себе могут быть возбужденными. Вычисления, проведенные авторами, показали, что фотоны с длиной волны 2,2 мкм очень эффективно раскручивают OH-радикалы (эти радикалы переходят во вращательно-возбужденные состояния). Такие вращающиеся молекулы сильнее воздействуют на остов молекулы ДНК и более эффективно разрезают нити. Два близких столкновения ДНК с вращающимися OH-радикалами становятся более вероятными и приводят к полному разрыву ДНК.
Авторы завершают свою статью замечанием, что согласно современным медицинским критериям излучение с длиной волны больше 1,3 мкм считается безопасным, в том числе и для глаза. Однако они сейчас продемонстрировали, что такое излучение при достаточной пиковой мощности в лазерном импульсе может вызывать эффективное разрушение молекул ДНК, более сильное, чем излучение в ближнем ИК-диапазоне. Это, по мнению авторов, уже достаточная причина для того, чтобы обеспокоиться тем, насколько адекватны нынешние критерии безопасности. Конечно, в бытовых устройствах, использующих ИК-светодиоды (например, пульты дистанционного управления), такой пиковой мощности нет даже близко, поэтому паниковать смысла нет. Но, все же, в свете новых данных будет полезно тщательнее разобраться с тем, где именно проходит граница безопасности для здоровья в ближнем и среднем ИК-диапазоне.