Ацетат что это химия
Формула ацетатов
Определение и формула ацетатов
Уксусная кислота представляет собой одноосновную кислоту, которая подвергается диссоциации в водном растворе согласно следующему уравнению:
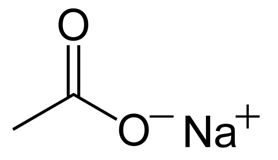
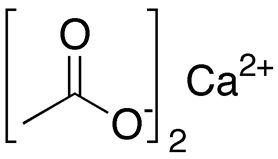
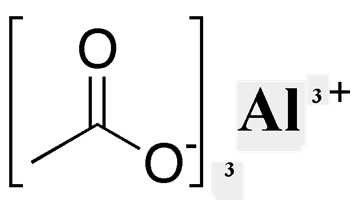
тем самым образуя соли – ацетаты (CH3COO)Na – ацетат натрия, (CH3COO)2Ca – ацетат кальция, (CH3COO)3Al–ацетат алюминия и т.д.).
В обычных условиях ацетаты представляют собой твердые вещества кристаллической природы, хорошо растворимые в воде.
Химическая формула ацетатов
Химические формулы ацетатов рассмотрим на примере CH3COONa – ацетата натрия, (CH3COO)2Ca – ацетата кальция, (CH3COO)3Al –ацетата алюминия. Химическая формула показывает качественный и количественный состав молекулы (сколько и каких атомов входит в конкретное соединение) По химической формуле можно вычислить молекулярную массу хлоридов (Ar(Na) = 23а.е.м., Ar(C) = 12 а.е.м., Ar(Ca) = 40 а.е.м., Ar(Al) = 27а.е.м., Ar(O) = 16 а.е.м., Ar(H) = 1 а.е.м.):
Mr(CH3COONa) = Ar(Na) + 2×Ar(C)+ 3×Ar(H)+ 2×Ar(O);
Mr(CH3COONa) = 23 + 2×12 + 3×1 + 2×16 = 23 + 24 + 3 + 32 = 82.
Mr((CH3COO)2Ca) = 40 + 4×12 + 6×1 + 4×16 = 40 + 48 + 6 + 64 = 158.
Mr(CH3COO)3Al) = 27 + 6×12+ 9×1 + 6×16= 27 + 72 + 9 + 96 = 204.
Графическая (структурная) формула ацетатов
Структурная (графическая) формула является более наглядной. Рассмотрим структурные формулы ацетатов на примере все тех же CH3COONa – ацетата натрия, (CH3COO)2Ca – ацетата кальция, (CH3COO)3Al –ацетата алюминия.
Рис. 1. Структурная формула ацетата натрия.
Рис. 2. Структурная формула ацетата кальция.
Рис. 3. Структурная формула ацетата алюминия.
Ионная формула
Ацетаты представляют собой средние соли способные диссоциировать на ионы в водном растворе:
Примеры решения задач
| Задание | Массовая доля фосфора в одном из его оксидов равна 56,4%. Плотность паров оксида по воздуху равна 7,59. Установите молекулярную формулу оксида. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Вычислим массовую долю кислорода в соединении:
ω (O) = 100% — ω(P) = 100% — 56,4% = 43,6%.
Обозначим количество моль элементов, входящих в состав соединения за «х» (фосфор), «у» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
x:y= 1,82 : 2,725= 1 : 1,5 = 2 : 3.
Значит простейшая формула соединения фосфора с кислородом будет иметь вид P2O3 и молярную массу 94 г/моль [M(P2O3) = 2×Ar(P) + 3×Ar(O) = 2×31+ 3×16 = 62 + 32 = 94 г/моль].
Значение молярной массы органического вещества можно определить при помощи его плотности по воздуху:
Msubstance = 29 × 7,59 = 220 г/моль.
Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс:
Значит индексы атомов фосфора и кислорода должны быть в 2 раза выше, т.е. формула вещества будет иметь вид P4O6.
| Задание | Определите молекулярную формулу соединения, содержащего 49,4% калия, 20,2% серы, 30,4% кислорода, если относительная молекулярная масса этого соединения в 3,95 раза больше относительной атомной массы кальция. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Обозначим количество моль элементов, входящих в состав соединения за «х» (калий), «у» (сера) и «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
x:y:z = ω(K)/Ar(K) : ω(S)/Ar(S) : ω(O)/Ar(O);
x:y:z= 49,4/39 : 20,2/32 : 30,4/16;
x:y:z= 1,3 : 0,63:1,9 = 2 : 1: 3.
Значит простейшая формула соединения калия, серы и кислорода будет иметь вид K2SO3 и молярную массу 158 г/моль[M(K2SO3) = 2×Ar(K) + Ar(S) + 3×Ar(O) = 2×39 + 32 + 3×16 = 78 + 32 + 48 = 158 г/моль].
Найдем истинную молярную массу этого соединения:
Msubstance = Ar(Ca) × 3,95 = 40 × 3,95 = 158 г/моль.
Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс:
Значит формула соединения калия, серы и кислорода имеет вид K2SO3.
Ацетат натрия
| Ацетат натрия | |
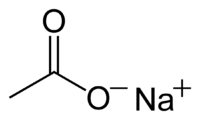 | |
| Общие | |
|---|---|
| Систематическое наименование | sodium acetate (ИЮПАК) sodium ethanoate (систематическое) ацетат натрия натрия этаноат |
| Химическая формула | CH3COONa |
| Эмпирическая формула | C2H3O2Na |
| Физические свойства | |
| Состояние (ст. усл.) | белый гигроскопичный порошок |
| Молярная масса | 82.03 грамм/моль (безводная форма) 136.08 грамм/моль (тригидрат) г/моль |
| Плотность | 1,45 г/см³ |
| Термические свойства | |
| Температура разложения | 324 °C |
| Удельная теплота плавления | 264—289 к Дж/кг |
| Химические свойства | |
| Растворимость в воде | 76 г/100 мл |
Ацетат натрия CH3COONa, — натриевая соль уксусной кислоты, производится и широко применяется в промышленных масштабах.
Содержание
Область применения
Ацетат натрия используется в текстильном производстве для нейтрализации отработанной серной кислоты в сточных водах и как фоторезист при использовании анилиновых красителей. Также используется при дублении солями хрома (для протравливания), и замедляет процесс вулканизации хлоропрена при производстве синтетических резин.
Ацетат натрия известен как пищевая добавка E262 и применяется как консервант.
В растворе ацетат натрия (будучи солью слабой кислоты) и уксусная кислота могут применяться как буфер, для сохранения относительно постоянного pH. Это особенно полезно в биохимии в pH-зависимых реакциях.
На этом свойстве основан довольно красивый опыт — «горячий лёд»
Способы получения
Ацетат натрия недорог и его легче приобрести в хим. магазинах, чем синтезировать в лабораторных условиях. В лабораторных условиях получается при взаимодействии уксусной кислоты, например, с карбонатом натрия, гидрокарбонатом натрия или гидроксидом натрия.
Это — хорошо известная реакция «гашения» пищевой соды и винного уксуса, происходящая в тесте. 84 грамма гидрокарбоната натрия реагируют с 750 граммами 8 % винного уксуса (или же с 86 граммами 70 % уксусной эссенции) с образованием 82 грамм ацетата натрия в растворе. Выпариванием воды можно получить чистый кристаллический ацетат натрия или его концентрированный раствор.
Характерные реакции
Ацетат натрия может быть использован для образования эфира с алкил галогенидами такими как бромэтан:
При сильном нагревании (более 324 °C) ацетат натрия разлагается на карбонат натрия и ацетон:
Одновременно может проходить разложение до оксида натрия, ацетона и диоксида углерода:
Галерея
Химический обогреватель, содержащий перенасыщенный раствор ацетата натрия, выделяющего тепло при фазовом переходе в кристаллическую форму тригидрата ацетата натрия.
Ацетат
Смотреть что такое «Ацетат» в других словарях:
АЦЕТАТ — АЦЕТАТ, прежнее название ЭТАНОАТА … Научно-технический энциклопедический словарь
ацетат — [от лат. acetum уксус] – хим. соль (или эфир) уксусной кислоты Большой словарь иностранных слов. Издательство «ИДДК», 2007 … Словарь иностранных слов русского языка
ацетат — сущ., кол во синонимов: 1 • триацетат (1) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
ацетат — Волокно из ацетатцеллюлозы, в котором ацетилированы не менее 74%, но менее 92% гидроксильных групп. Вторичная ацетатцеллюлоза: —|—C6H7O2 (OX)3—|—n, где Х=Н или CH3CO и степень этерификации не менее 2,22, но меньше 2,76.… … Справочник технического переводчика
ацетат — Серкә кислотасы тозы. АЦЕТАТ ЕФӘК – Ясалма сүстән тукылган ефәк. АЦЕТАТ СҮСЕ – Целлюлозаны химик эшкәртү юлы белән алына торган ясалма сүс … Татар теленең аңлатмалы сүзлеге
ацетат — acetatas statusas T sritis chemija apibrėžtis Acto rūgšties druska arba esteris. formulė CH₃COO(M,R) atitikmenys: angl. acetate rus. ацетат ryšiai: sinonimas – etanoatas … Chemijos terminų aiškinamasis žodynas
Ацетат — I м. Соль и эфир уксусной кислоты (в химии). II м. 1. Разновидность синтетического волокна. 2. Ткань из такого волокна. 3. разг. Изделия из такой ткани. Толковый словарь Ефремовой. Т. Ф. Ефремова. 2000 … Современный толковый словарь русского языка Ефремовой
ацетат — ацетат, ацетаты, ацетата, ацетатов, ацетату, ацетатам, ацетат, ацетаты, ацетатом, ацетатами, ацетате, ацетатах (Источник: «Полная акцентуированная парадигма по А. А. Зализняку») … Формы слов
ацетат — ацет ат, а … Русский орфографический словарь
ru.knowledgr.com
Большая часть приблизительно 5 миллиардов кМ уксусной кислоты, производимой ежегодно в промышленности, используется в производстве ацетатов, которые обычно принимают форму полимеров. В природе ацетат является наиболее распространенным строительным блоком для биосинтеза. Например, жирные кислоты получают путем соединения двух атомов углерода из ацетата с растущей жирной кислотой.
Номенклатура и общая формула
В части соли формула ацетата иона записывается как,, или. Химики часто представляют ацетат как OAc − или, реже, AcO −. Таким образом, HOAc является символом для уксусной кислоты, NaOAc для ацетата натрия, и EtOAc для этилацетата (так как Ac является общим символом для ацетильной группы CH3CO). Его не следует путать с символом актиния, первым элементом серии актинидов; контекст наводит на диспозицию. Например, формула для ацетата натрия может быть сокращена как «NaOAc», а не «NaC2H3O2». Следует также соблюдать осторожность во избежание путаницы с надуксусной кислотой при использовании аббревиатуры OAc; для ясности и во избежание ошибок при переводе в литературе следует HOAc с упоминанием обоих соединений.
Солёные
CH3COOH CH3COO − + H +
Многие ацетатные солевые соли являются ионными, о чем свидетельствует их склонность хорошо растворяться в воде. Обычно встречающийся в доме ацетат является ацетатом натрия, белым твердым веществом, которое может быть получено путем комбинирования уксуса и бикарбоната натрия («бикарбонат соды");:
CH3COOH + NaHCO3 CH3COO − Na++ H2O + CO2
Переходные металлы могут быть скомпилированы с помощью ацетата. Примеры ацетатных компов включают ацетат хрома (II) и основной цинк-ацетат.
Сложные эфиры
Сложные эфиры ацетата имеют общую формулу CH3CO2R, где R представляет собой органическую группу. Сложные эфиры являются доминирующими формами ацетата на рынке. В отличие от солей ацетата, сложные эфиры ацетата часто являются ds, lipophilic, а иногда volatile. они популярны, потому что они имеют безобидные, часто сладкие запахи, они являются недорогие, и они, как правило, низкой токсичности.
Почти половина продукции уксусной кислоты потребляется при производстве винилацетата, предшествующего поливиниловому спирту, который является компонентом многих красок. На самом деле, «ацетат» является жаргоном для ацетата целлюлозы, который используется в производстве фибр или различных продуктов, например, ацетатных дисков, используемых в аудиофиксации производства.
Ацетат в биологии
Ацетат является распространенным анионом в биологической области. Он в основном определяется организмами в форме ацетилкоенцима А.
Ферментирование ацетила CoA до ацетата
Пируват превращается в ацетил-коэнцим А (ацетил-КоА) ферментпируватдгидрогеназой. Этот ацетил-CoA затем превращают в ацетат в E. coli, продуцируя АТФ путем фосфорилирования на уровне субстрата. Образование ацетата требует двух энзимов: фосфатацетилтрансферазы и ацетаткиназы.
ацетил-CoA + фосфат ацетилфосфат + CoA
ацетилфосфат + АДФ ацетат + АТФ
Ферментирование ацетата
Уксусная кислота также может подвергаться реакции дисмутации с получением метана и диоксида углерода:
CH3COO − + H + CH4 + CO2 ΔG ° = − 36 кДж/моль
Эта реакция диспергирования катализируется метаногеновыми археями в их ферментативных метабсмах. Один элекрон переносится из карбонильной функции (e − donor) карбоксиловой группы в метильную группу (e − акцептор) уксусной кислоты с получением соответственно CO2 и метанового газа.
Натрия Ацетат
Химическое название
Натриевая соль уксусной кислоты, натрия этаноат.
Химические свойства
Белый гигроскопичный мелкий порошок, растворимый в воде. Разлагается при 324 градусах Цельсия. Молекулярная масса = 82 грамма на моль для безводной формы, 136,1 грамм на моль – для тригидрата. Формула Натрия Ацетата: CH3COONa; рацемическая формула: C2H3O2Na; формула тригидрата: C2H3O2Na х 3H2O.
Химические свойства
Вещество можно получить с помощью реакции уксусной кислоты с карбонатом или гидрокарбонатом натрия, с NaOH. В домашних условиях — это реакция винного уксуса с пищевой содой, к 1 грамму соды добавляют 9 грамм уксуса.
Реакция электролиза Ацетата Натрия. Во время превращения происходит диссоциация CH3COONa до CH3COO- и Na+. У анода выделяется этан и углекислый газ. Далее углекислый газ вступает в реакцию с гидроксидом бария или натрия (NaOH), во втором случаев пробирке останется чистый этан.
Достаточно популярна в химии реакция гидролиза Ацетата Натрия. Для наглядности, образованную слабой к-ой и сильным основанием соль, смешивают с индикатором-фенолфталеином. Смесь нагревают, при этом соль частично плавится и в расплаве появляются гидроксид-ионы. Затем пробирку охлаждают, соль кристаллизуется, и смесь утрачивает фиолетовую окраску. Соединение также реагирует с алкилгалогенидами, бромэтаном с образованием сложных эфиров.
Качественная реакция на Ацетат Натрия проводится в два этапа. Сначала определяют наличие в соединении ионов Na, а затем – кислотного ацетат-остатка. Натрий будет гореть ярко желтым пламенем, если небольшое количество раствора (или сухого вещ-ва) внести в пламя спиртовой горелки. Качественную реакцию на ацетат ион можно провести с помощью любой растворимой соли трехвалентного железа. Раствор станет красно-коричневого цвета, а при нагревании выпадет темно-коричневый осадок Fe(OH)3.
Химическое соединение используют при производстве текстиля; в качестве фоторезиста после применения анилиновых красителей; при вулканизации и в кожевенном производстве. Вещество получило широкое применение в виде пищевой добавки E262, используется в качестве консерванта; его применяют для сохранения стабильного рН в биохимии. Соединение используют при производстве химических обогревателей и грелок, («горячий лёд»). В медицине также используют тригидрат Натрия Ацетата.
Фармакологическое действие
Восстанавливает водно-солевой баланс.
Фармакодинамика и фармакокинетика
Натрия Ацетат применяют в комбинации с другими хим. соединениями. Вещество используют для дезинтоксикации и регидратации. Средство обладает способностью восстанавливать водный и электролитный баланс во время обезвоживания. Стимулирует диурез и предотвращает развитие метаболического ацидоза. Обладает дезинтоксикационным, регидратирующим и плазмозамещающим действием.
Показания к применению
Применяется при регидратации, интоксикации, гиперкалиемии, обезвоживании у пациентов с пищевыми инфекциями, холерой, острой дизентерией и так далее.
Противопоказания
Побочные действия
Редко при применении растворов для внутривенного введения с данным лекарственным средством возникает отечность, тахикардия, озноб.
Инструкция по применению (Способ и дозировка)
Натрия Ацетат в составе различных препаратов для внутривенного введения применяется в условиях стационара, под контролем лабораторных показателей. Растворы вводят струйно или капельно. Дозировка зависит от состояния пациента и тяжести состояния. Как правило, если пациент находится в тяжелом состоянии, то сначала вводят лекарство струйно, затем переходят на инфузии.
Передозировка
Нет сведений о передозировке средством.
Взаимодействие
Вещество часто применяют в комбинации с другими электролитами.
Ацетат Натрия можно сочетать с натрия хлоридом и натрием фумаровокислым, при этом необходимо визуально следить за совместимостью растворов.
Условия продажи
Может потребоваться рецепт.
Особые указания
Лечение препаратом проводят под контролем уровня электролитов крови и гематокрита.