Аэртал или ксефокам что сильнее
Боли в спине
Подбор лекарственных средств для лечения болей в спине
Доктор Перец ® — 100 % натуральное тепло для облегчения мышечных и суставных болей 1
Перцовый пластырь № 1 в России по объемам продаж 2
100 % натуральные экстракты красного перца и красавки 2
Основа, позволяющая коже дышать 3
1 Согласно ТУ Доктор Перец ®. Данное утверждение относится только к активным компонентам пластыря, оказывающим тепловой воздействие.
2 Лидер рынка перцовых пластырей по объему продаж в стоимостном и количественном выражении за период июль 2020‑июль 2021 на основе данных ООО «Айкьювиа Солюшнс»
3 Согласно ТУ Доктор Перец ®
Список лекарств от боли в спине
Форма выпуска
таблетки, покрытые пленочной оболочкой, порошок для приготовления суспензии для приема внутрь
«Дексалгин», «Дексалгин 25»
таблетки, покрытые оболочкой, раствор для внутривенного и внутримышечного введения
«Биоран», «Дикловит», «Флотак», «Раптен рапид», «Раптен Дуо», «Диклофенак ретард Оболенское», «Диклофенак-УБФ», «Табук-Ди», «Наклофен», «Наклофен СР», «Диклофенак-АКОС», «Диклофенак-ФПО», «Диклофенак-Эском»
таблетки пролонгированного действия, покрытые оболочкой, капсулы с модифицированным высвобождением, суппозитории ректальные, раствор для внутримышечного введения
таблетки, покрытые оболочкой
«Ибупрофен», «Бруфен СР», «Солпафлекс», «Ибупром Макс»,
таблетки, покрытые оболочкой, таблетки шипучие, таблетки для рассасывания,
капсулы пролонгированного действия, гранулы для приготовления раствора для приема внутрь, суспензия,
суппозитории ректальные (для детей), суспензия для приема внутрь (для детей)
раствор для внутривенного введения
Ибупрофен + кодеина фосфата гемигидрат
таблетки, покрытые оболочкой
таблетки, покрытые оболочкой
таблетки диспергируемые (для детей)
Ибупрофен + питофенон + фенпивериния бромид
таблетки, покрытые оболочкой
капсулы, таблетки, суппозитории ректальные, для внутримышечного введения
гранулы для приготовления раствора для приема внутрь
таблетки, раствор для внутривенного и внутримышечного введения
«Ксефокам», «Ксефокам рапид»
таблетки, покрытые оболочкой, лиофилизат для приготовления раствора для внутривенного и внутримышечного введения
«Матарен», «Мелоксикам», «Мовасин», «Мовикс», «Мовалис»,
таблетки, раствор для внутримышечного введения + суспензия для приема внутрь (Мовалис), суппозитории ректальные
таблетки, гранулы для приготовления суспензии для приема внутрь, суспензия для приема внутрь
раствор для внутримышечного введения
Миорелаксанты
Мильгамма композитум, Полиневрин®
«Мидокалм-Рихтер», «Толперизон с лидокаином-Ферейн»
раствор для внутривенного и внутримышечного введения
«Сирдалуд», «Тизанил», «Тизанидин-Тева», «Тизалуд»
капсулы с модифицированным высвобождением
таблетки, покрытые пленочной оболочкой, раствор для внутримышечного введения
NB! Ибупрофен в таблетках может быть как рецептурного, так и безрецептурного назначения, в отличие от других НПВП, у которых безрецептурными являются только наружные формы!
Форма выпуска
крем для наружного применения
Глюкозамин (глюкозамина сульфат, глюкозамина сульфата натрия хлорид)
таблетки, таблетки покрытые пленочной оболочкой, раствор для внутримышечного введения, порошок для приготовления раствора для приема внутрь
Хондроксид ® Максимум, «Фармаскин ТГК»
крем для наружного применения
Глюкозамин + ибупрофен + хондроитина сульфат
Глюкозамин + хондроитина сульфат
капсулы, таблетки покрытые пленочной оболочкой
гель для наружного применения
мазь для наружного применения
Глюкозамин + хондроитина сульфат + витамин Е
аэрозоль для наружного применения
крем для наружного применения
мазь для наружного применения
спрей для наружного применения дозированный
«Диклофенак», «Диклонат П», «Наклофен»,
гель для наружного применения
трансдермальная терапевтическая система, пластырь трансдермальный
гель для наружного применения
крем для наружного применения
гель для наружного применения
крем для наружного применения
аэрозоль для наружного применения
раствор для местного применения
гель для наружного применения
гель для наружного применения
трансдермальная терапевтическая система
Хондроксид ® Форте (мелоксикам+хондроитина сульфат&)
крем для наружного применения
мазь для наружного применения
гель для наружного применения
мазь для наружного применения
«Ваньтун Артиплас», «Перцовый пластырь Доктор перец с обезболивающим действием», «Перцовый пластырь» (белладонны листьев экстракт + перца стручкового плодов экстракт)
Витамины группы B
Дополнением к базовой анальгетической терапии может служить применение как «разогревающих», так и локальных «охлаждающих» средств, в частности трансдермальных систем на основе местных анестетиков (лидокаина и т. п.), блокирующих распространение болевых импульсов.
Разумный выбор НПВП при сочетанной патологии: заболеваниях суставов и гипертонической болезни
Нестероидные противовоспалительные препараты (НПВП) являются одной из основных групп лекарственных средств, применяемых при лечении ревматоидного артрита (РА). Противовоспалительный и анальгетический эффект данной группы препаратов связан с подавлением а
Нестероидные противовоспалительные препараты (НПВП) являются одной из основных групп лекарственных средств, применяемых при лечении ревматоидного артрита (РА). Противовоспалительный и анальгетический эффект данной группы препаратов связан с подавлением активности циклооксигеназы-2 (ЦОГ-2) в очаге воспаления — ключевого фермента синтеза простагландинов провоспалительной активности, а подавление изоформы ЦОГ-1 приводит к нарушению физиологических реакций: в частности, к нарушению синтеза простагландинов класса Е в слизистой оболочке желудка и развитию НПВП-гастропатии.
Большинство «стандартных» НПВП способно подавлять активность обеих изоформ ЦОГ, поэтому их применение часто ограничено из-за развития побочных эффектов, в первую очередь — со стороны желудочно-кишечного тракта (ЖКТ). Субъективные симптомы со стороны ЖКТ встречаются примерно у трети больных, а в 5% случаев представляют серьезную угрозу жизни пациентов. Именно поэтому в последние годы особо пристальное внимание привлекает проблема безопасного применения НПВП. Полагают, что препараты более селективные в отношении ЦОГ-2 реже вызывают развитие НПВП-гастропатии. Изучение механизмов действия НПВП послужило толчком к созданию новых препаратов, обладающих всеми положительными свойствами стандартных НПВП, но менее токсичных, — это специфические ингибиторы ЦОГ-2 [3, 4, 13].
В последние годы особую актуальность приобрела проблема взаимодействия НПВП и гипотензивных препаратов, а также связи между применением НПВП и развитием гипертонической болезни (ГБ). Неселективные НПВП могут привести к повышению АД (преимущественно диастолического) не только у больных артериальной гипертензией (АГ), но и у лиц с нормальным АД за счет ингибиции системного и локального, внутрипочечного синтеза простагландинов. Известно, что постоянный прием НПВП вызывает у пациентов увеличение АД в среднем на 5,0 мм рт. ст. Характерным свойством НПВП является также взаимодействие с гипотензивными препаратами, в основе гипотензивного действия которых лежат преимущественно простагландин-зависимые механизмы. Назначение НПВП пациентам, получающим по поводу АГ β-адреноблокаторы, ингибиторы АПФ и диуретики, приводит к снижению гипотензивного эффекта [8, 9].
Нимесулид был разработан еще в 1985 г. и является одним из первых НПВП, при изучении которого продемонстрирована более высокая селективность в отношении ЦОГ-2 и накоплен большой клинический опыт. В многочисленных исследованиях in vitro и in vivo было показано, что нимесулид примерно в 5–20 раз более селективно ингибирует ЦОГ-2, чем ЦОГ-1. Большой интерес представляет и тот факт, что нимесулид обладает широким спектром ЦОГ-независимых эффектов, которые могут определять его противовоспалительную, анальгетическую и хондропротективную активность [1, 2, 5, 7, 11, 12].
Нимесулид хорошо переносится больными и редко вызывает развитие серьезных побочных эффектов, требующих отмены препарата. По результатам ряда исследований, частота побочных эффектов, развивающихся на фоне приема нимесулида, достоверно не отличается от плацебо или ниже, чем при приеме других НПВП. Например, по данным мета-анализа, у больных, получавших нимесулид, общая частота побочных реакций со стороны ЖКТ была значительно ниже (8,7%), чем при назначении других НПВП (16,8%). Низкую частоту поражения ЖКТ на фоне лечения нимесулидом связывают не только с ЦОГ-2-селективностью препарата, но и с антигистаминным действием, приводящим к снижению секреции соляной кислоты в желудке [6, 10, 13].
Таким образом, нимесулид относится к селективным ингибиторам ЦОГ-2, сравним по эффективности с «классическими» НПВП, но отличается более благоприятным профилем токсичности. Фармакоэкономический анализ свидетельствует о преимуществах нимесулида по сравнению с диклофенаком, в первую очередь в связи с более низкой частотой поражения ЖКТ.
Целью нашего исследования явилось изучение эффективности и переносимости найза (нимесулида) у больных РА в сравнении с ортофеном (диклофенаком).
Материалы и методы
Оба НПВП назначались случайным способом 40 больным с момента первого установления диагноза РА, согласно критериям Американской коллегии ревматологов. Найз применялся в виде таблеток по 100 мг дважды в день, ортофен — в виде таблеток по 25 мг в суточной дозе 150 мг. Одновременно всем больным проводилась базисная терапия, преимущественно метотрексатом или сульфасалазином. Эффективность и переносимость НПВП оценивались через 3 нед. от начала лечения, т. е. в те сроки, когда эффект базисных препаратов еще не имел клинической значимости.
В I группе из 20 пациентов, получавших найз, было 14 женщин и 6 мужчин, средний возраст пациентов составил 55,1 года, длительность суставного синдрома к моменту установления диагноза — от 3 до 14 мес., в среднем — 7,25 мес. Во II группе из 20 больных, получавших ортофен, было 18 женщин и 2 мужчин, средний возраст больных — 42,75 года, длительность суставного синдрома — от 2 до 14 мес., в среднем — 5,65 мес. Клиническая характеристика обеих групп представлена в таблице 1.
Результаты лечения оценивались по динамике показателей суставного синдрома (суставной индекс Ричи (СИ), счет болезненных суставов (СБС), счет припухших суставов (СПС), продолжительность утренней скованности (мин), выраженность боли по визуально-аналоговой шкале (ВАШ)) и на основании общей оценки эффективности лечения, по мнению врача и больного. Кроме того, у всех больных оценивалась динамика АД на фоне лечения НПВП.
Результаты
В I группе на фоне лечения найзом в суточной дозе 200 мг за 3 нед. лечения достигнута достоверная динамика показателей суставного синдрома. При этом эффективность терапии оценена 17 пациентами (85%) как хорошая и 3 (15%) — как удовлетворительная. По мнению врача, в 16 случаях (80%) наблюдалась хорошая эффективность препарата, в 4 случаях (20%) — удовлетворительная (рис. 1). Переносимость найза у 85% была хорошей, только у 2 больных (10%) отмечались изжога и гастралгии, у 1 больного (5%) — чувство тяжести в эпигастральной области. Однако при фиброгастроскопии у этих пациентов не выявлено эрозивного повреждения слизистой оболочки желудка. В группе больных, принимавших найз, не потребовалось отмены препарата ни у одного больного.
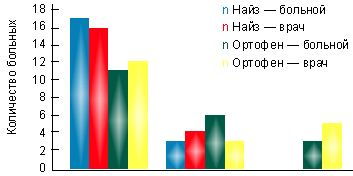 |
| Рисунок. Оценка эффективности препаратов на основании мнения больного и врача |
Во II группе на фоне терапии ортофеном в суточной дозе 150 мг через 3 нед. также отмечена существенная динамика показателей суставного синдрома. Однако оценка эффективности терапии показала, что только 11 пациентов (55%) оценили эффективность препарата как хорошую, 6 (30%) — как удовлетворительную и трое больных (15%) признали ее неудовлетворительной. По мнению лечащего врача, достаточная эффективность ортофена, соответствующая градации «хорошая», отмечалась в 12 случаях (60%), удовлетворительная — в 3 (15%) и неудовлетворительная — в 5 (25%) случаях (рис.).
Переносимость препарата ортофен была хуже, чем у найза: у 9 пациентов (45%) отмечались симптоматические побочные эффекты, причем у 3 больных (15%) потребовалась отмена препарата через 2 нед. от начала лечения в связи с выявленным при ФГДС эрозивным поражением слизистой оболочки антрального отдела желудка. В целом из побочных эффектов чаще отмечались изжога — у 7 (35%) пациентов, гастралгии — у 8 (40%), тошнота — у 4 (20%) и диарея — у 2 (10%) больных.
Особый интерес представляет влияние исследуемых НПВП на уровень АД, так как из 40 больных у 15 имелась сопутствующая ГБ, по поводу которой проводилась гипотензивная терапия. Динамика уровня АД в обеих группах на фоне лечения найзом и ортофеном представлена в таблице 2. Следует отметить, что терапия найзом не требовала усиления проводимой гипотензивной терапии (β-блокаторами, ингибиторами АПФ, диуретиками) и не вызывала повышения АД у ранее нормотензивных пациентов. В то же время лечение ортофеном потребовало коррекции доз гипотензивных препаратов у 4 (66,7%) из 6 больных ГБ и вызвало повышение АД у 5 (25%) женщин в постменопаузе с исходно высоконормальным АД. Данный эффект неселективного НПВП — ортофена — следует считать предсказуемым, особенно с учетом характера проводимой гипотензивной терапии. Все больные ГБ получали в разных комбинациях β-адреноблокаторы, ингибиторы АПФ и диуретики; при этом ни одному пациенту не был назначен дигидропиридиновый антагонист Са — амлодипин, который является препаратом выбора для лечения АГ в условиях терапии НПВП.
Таким образом, результаты открытого клинического исследования показали, что препарат найз у больных РА проявляет выраженную противовоспалительную активность, превосходящую диклофенак. При этом найз характеризуется хорошей переносимостью, малым числом симптоматических побочных эффектов и превосходит с этой точки зрения наиболее широко применяемый в клинической практике ортофен. Дополнительным преимуществом препарата найз можно считать менее выраженное влияние на уровень АД. При назначении найза не требовалось увеличения дозы гипотензивных препаратов. С учетом высокой распространенности эссенциальной гипертензии в популяции, взаимодействие НПВП с наиболее часто используемыми гипотензивными средствами представляется актуальной проблемой. Ревматические заболевания, требующие постоянной терапии НПВП, часто сочетаются с АГ. При этом у большинства больных ГБ коррекция АД может достигаться только благодаря комбинированной антигипертензивной терапии, а монотерапия дигидропиридиновыми антагонистами Са признается недостаточно эффективной. Следовательно, в большинстве случаев при лечении воспалительных ревматических заболеваний у лиц, страдающих ГБ, невозможно полностью нивелировать отрицательное взаимодействие «стандартных» НПВП с основными кардиологическими препаратами — β-адреноблокаторами, ингибиторами АПФ и диуретиками. В такой ситуации представляется рациональным выбор для проведения противовоспалительной терапии специфических ингибиторов ЦОГ-2, представителем которых является найз.
Литература
И. М. Марусенко, кандидат медицинских наук
Н. Н. Везикова, кандидат медицинских наук, доцент
В. К. Игнатьев, доктор медицинских наук, профессор
Петрозаводский университет, кафедра госпитальной терапии
Противовоспалительные средства системного действия
Обезболивающие нестероидные противовоспалительные средства – являются самыми частыми в использование клинического лечения.
Ими пользуются при повышенной температуре, подхвате вирусов, воспалениях, болях. Они способны полностью извлечь неприятные симптомы из вашего организма. Простагландиды – гормоны, которые отвечают за воспалительные процессы в наших тканях. Именно их нестероидные средства могут полностью подавить.
Такие препараты, как и все, может назначать только лечащий врач. Как правило, их выписывают при заболеваниях опорно-двигательного аппарата, посттравматическом болевом синдроме, болях после операции, почечно-печеночных болезнях, болях в голове.
Мы не рекомендуем заниматься самолечением, а советуем обращаться в профильным врачам. Ведь только специалисты могут искоренить и удалить проблему, а не отравлять ваш организм ненужными препаратами.
При спортивных травмах, во время тренировок, когда нужна срочная и неотложная помощь, спортсмен задастся вопросом: «Нимисил или кетанол, что лучше?». И тут стоит изучить вопрос внимательнее. Поскольку нимисил способствует более длительному и лечебному эффекту, а кетанол оказывает быстрое действие на локальную боль. Исходя из характера боли – выбор останется за спортивным врачом и спортсменом.
Какие бы обезболивающие нестероидные противовоспалительные средства вы не выбирали, выбор должен пасть на те, которые выпишет ВРАЧ. Только анализы крови/ мочи, симптоматика, внутренние ощущения дадут возможность подобрать правильный препарат. Главным его действием должно стать не просто временное удаление боли, а полное избавление от заболеваний. А профильные специалисты создадут все условия, чтобы избавить вас от неприятных симптомов и не дать упасть иммунной системе.
Станьте членом КЛАНА и каждый вторник вы будете получать свежий номер «Аргументы Недели», со скидкой более чем 70%, вместе с эксклюзивными материалами, не вошедшими в полосы газеты. Получите премиум доступ к библиотеке интереснейших и популярных книг, а также архиву более чем 700 вышедших номеров БЕСПЛАТНО. В дополнение у вас появится возможность целый год пользоваться бесплатными юридическими консультациями наших экспертов.
Нестероидные противовоспалительные препараты (НПВП) широко применяются в терапии состояний, сопровождающихся воспалением и болевым синдромом. Хотя в настоящее время известно уже около ста НПВП различных классов, поиск новых препаратов этой группы продолжается. Это связано с потребностью в препаратах, имеющих как оптимальное соотношение обезболивающего и противовоспалительного действия, так и высокую степень безопасности. Такие широко используемые в настоящее время анальгетики, как метамизол (анальгин), входящий в состав некоторых комбинированных препаратов (баралгин, максиган и т.д.), а также более современный кеторолак, имеют неблагоприятный профиль побочных эффектов и низкие противовоспалительные свойства, в то время как у большинства других НПВП анальгетические свойства недостаточны [14, 15]. В этом плане большой интерес врачей всех специальностей вызвало появление на фармацевтическом рынке препарата лорноксикам, выпускаемого компанией «Никомед-Амершам» под торговой маркой Ксефокам.
В проведенных исследованиях выявлено быстрое, линейно зависимое от дозы и почти полное всасывание лорноксикама после его перорального и внутримышечного введения [24, 27]. Его пероральный прием в дозах от 4 до 16 мг биологически эквивалентен внутривенному введению этих же доз. Свечи, содержащие 4-8 мг лорноксикама, обеспечивают лишь 65-74-процентную биодоступность препарата по сравнению с внутривенным введением.
Пероральный прием лорноксикама после стандартного завтрака сопровождался некоторым замедлением всасывания и уменьшением количества всасываемого препарата на 20-30% по сравнению с приемом утром натощак. Однако такое влияние пищи на всасывание не считается клинически значимым, что позволяет принимать лорноксикам без связи с приемом пищи [5].
Благодаря короткому периоду полувыведения из плазмы, лорноксикам обладает меньшей выраженностью побочных эффектов, так как в период между введениями доз возможно восстановление защитных физиологических уровней простагландинов, необходимых для защиты слизистой желудка и поддержания нормального кровотока в почках [23]. При этом сохранение активности препарата внутри суставов и в других воспаленных тканях в течение более длительного времени (10-12 часов) позволяет принимать лорноксикам 2 раза в день [5, 16].
После многократного введения лорноксикама его кумуляция в плазме не отмечается, что снижает риск побочных эффектов по сравнению с препаратами, имеющими длительный период полувыведения [48].
Фармакокинетика лорноксикама примерно одинакова у пожилых людей и людей молодого или зрелого возраста, поэтому какой-либо коррекции дозы лорноксикама у пожилых не требуется [48].
Клинические исследования лорноксикама были проведены при разнообразных заболеваниях, сопровождающихся болями и воспалением.
Значительное число работ посвящено различным видам послеоперационной боли (ламинэктомия, дискэктомия, операции на передней крестообразной связке, гистерэктомия, эпизиотомия, экстракция ретинированного зуба мудрости).
Во время и после операции из поврежденных тканей высвобождаются медиаторы боли и простагландины, а НПВП специфически уменьшают локальную, спинальную и центральную сенсибилизацию по отношению к возникающим болевым импульсам. Применение НПВП позволяет значительно снизить дозу опиоидов, а иногда даже полностью отказаться от них. Важен и противовоспалительный эффект НПВП, они значительно улучшают течение репаративных процессов, уменьшают отек, снижают риск расхождения швов [4].
После операции на передней крестообразной связке лорноксикам в дозе 8 мг два раза в день (первоначальная доза 16 мг) давал достоверно (р = 0,014) более полный анальгетический эффект по сравнению с трамадолом в дозе 100 мг два раза в день внутримышечно [18]. После гинекологических операций (гистерэктомии) обезболивающий эффект от 8 мг лорноксикама внутривенно был выше, чем от 50 мг трамадола. Эффективность 4 мг лорноксикама была несколько ниже этой дозы трамадола, но превышала эффект плацебо [28].
Таким образом, при послеоперационных болях анальгетический эффект лорноксикама, вводимого парентерально в дозе не менее 8 мг, не уступает средним дозам опиоидов при значительно лучшем профиле безопасности. Однако при сопоставлении лорноксикама с опиоидами необходимо иметь в виду два момента. Несмотря на наличие определенного центрального механизма действия, лорноксикам не обладает каким-либо заметным седативным действием, что во многих ситуациях является преимуществом. Однако при выраженным болях, особенно в ночное время, когда седативный эффект желателен, в дополнение к лорноксикаму необходимо вводить соответствующие препараты. Если дозу лорноксикама в 16 мг можно рассматривать как «потолковую» (верхний предел действия), то препараты морфия практически не имеют потолка обезболивающего действия. Поэтому в тех ситуациях, когда применение лорноксикама в качестве монотерапии не дает достаточного эффекта, целесообразна его комбинация с опиоидами. При этом лорноксикам дает «опиоидсберегающий эффект» за счет уменьшения им дозы опиоидов, что позволяет снизить риск таких побочных эффектов последних, как тошнота, рвота, подавление дыхания, уменьшение моторики кишечника, гемодинамические нарушения.
Применение лорноксикама для лечения онкологических болей особенно обосновано в рамках «Трехступенчатой схемы обезболивания ВОЗ», которая относит НПВП к ненаркотическим адъювантным анальгетикам и рекомендует их использование как для монотерапии, так и для усиления действия опиоидов [1]. У онкологических больных лорноксикам может быть использован самостоятельно, если боль вызвана метастазами в кости скелета, когда наряду с болевыми импульсами имеются элементы перифокального воспаления, сопутствующего метастатическому очагу. В рандомизированном двойном слепом исследовании, включавшем 29 пациентов, испытывавших боли из-за костных метастазов, обезболивающий эффект, по оценкам как врачей, так и самих больных, был выше при приеме 8 мг лорноксикама три раза в день, чем при приеме 500 мг напроксена 2 раза в день [50].
По данным статистики, поясничными болями страдает более половины населения всей планеты. В терапии данного состояния ведущее место занимают НПВП, причем важно наличие как противовоспалительного, так и выраженного анальгетического эффекта. В этом плане лорноксикам вызывает особый интерес.
Таким образом, лорноксикам можно рассматривать как препарат выбора при терапии болей в спине, особенно учитывая сочетание анальгетических и противовоспалительных свойств.
НПВП являются традиционным компонентом профилактики и купирования приступов мигрени. Прием 4 мг лорноксикама три раза в день значительно уменьшал частоту мигрени (р Ксефокам при других болевых синдромах
Лорноксикам, вводимый в дозе 4 мг два раза в день в течение 7 дней пациентам с костно-суставными болями, связанными с переломами, тендосиновитом или другими поражениями, устранял боли в покое, при движении и ночью [32].
Ревматоидный артрит и остеоартрит
Сравнение лорноксикама с плацебо и традиционно используемыми в клинике НПВП при ревматоидном артрите было осуществлено более чем в 10 двойных слепых рандомизированных исследованиях, выполненных как в России, так и за рубежом и включавших в общей сложности более 2000 больных [5, 7, 9, 16]. Оценивали индекс суставов Ричи, количество суставов, вовлеченных в основное заболевание, продолжительность утренней скованности, облегчение боли и функциональной способности, а также общие оценки пациента и врача. Было показано, что прием даже 2 мг лорноксикама два раза в день был эффективнее, чем плацебо [45]. При этом была отмечена связь между дозой и эффектом: прием 4 мг лорноксикама три раза в день или 8 мг два раза в день был более эффективным, чем прием 2-4 мг два раза в день [5]. В то же время дополнительного усиления эффективности по сравнению с приемом 8 мг два раза в день не обнаружено.
Сравнение с пироксикамом на протяжении курса терапии в 12 недель показало, что применение лорноксикама в дозе 4 мг два раза в день практически эквивалентно приему 20 мг пироксикама [34]. При сравнении лорноксикама и диклофенака в течение 12 недель наибольшее улучшение индекса суставов Ричи отмечено у больных, принимавших лорноксикам 4 мг три раза в день (улучшение на 25%) или 8 мг два раза в день (на 24%); у больных, принимавших 50 мг диклофенака три раза в день, индекс Ричи улучшался только на 20% [35]. При продолжении данного исследования в течение 9 месяцев действие лорноксикама сохранялось или усиливалось.
Была показана эффективность лорноксикама в дозе 4 мг три раза в день в течение 4 недель при анкилозирующем спондилите [36]. Есть наблюдения о применении лорноксикама в терапии больных псориатическим артритом [11].
Многочисленные исследования эффективности лорноксикама у больных с остеоартритом (коленного и тазобедренного суставов) подтвердили, что доза лорноксикама 8 мг два раза в день значительно превосходит плацебо [5]. При приеме лорноксикама в течение 4 недель значительно снижалась боль в покое, боль, связанная с нагрузкой весом при активном движении, улучшалась функция суставов, снижалось дополнительное потребление анальгетиков [46]. В открытом многоцентровом исследовании была показана отдаленная эффективность лорноксикама при приеме 8 мг два раза в день в течение 12 месяцев пациентами пожилого возраста (средний возраст 71 год). Через 1 месяц и 12 месяцев индекс Lesquesna улучшился по сравнению с исходным на 20% и 45% соответственно, баллы болезненности на 25% и 55% соответственно. Врачи оценили улучшение минимум как «хорошее» у 58% пациентов с остеоартритом спустя 1 месяц и у 69% пациентов спустя 12 месяцев [37].
В России исследования эффективности лорноксикама при ревматоидном артрите и остеоартрите проводились в Институте ревматологии РАМН. 40 пациентов получали лорноксикам в суточной дозе 16 мг в течение 4 недель. Клиническая эффективность по совокупности показателей была расценена исследователями как значительное улучшение и улучшение у 82% больных [7]. Высокая эффективность применения лорноксикама при ревматоидном артрите и деформирующем остеоартрозе подтверждена исследованиями Санкт-Петербургской государственной медицинской академии и Новосибирского городского диспансера клинической иммунологии [6, 9].
Другие возможные области применения лорноксикама (ксефокама)
Лорноксикам может применяться и в других ситуациях, в которых показано применение НПВП. Есть сообщения о возможности применения лорноксикама в комплексной терапии больных хроническим вирусным гепатитом для повышения эффективности и безопасности интерферонотерапии [13].
Это предположение было подтверждено результатами клинических исследований. В исследованиях первой фазы этот препарат не оказывал влияния на жизненно важные параметры или данные лабораторных тестов. Побочные эффекты со стороны ЖКТ, характерные для большинства НПВП, встречались менее часто и в меньшей степени, чем при использовании индометацина или напроксена [38, 39]. Каких-либо воздействий на функцию почек не обнаружено. Отмечены небольшие изменения показателей свертываемости крови (незначительное увеличение времени гемостаза и времени коагуляции, а также небольшое уменьшение тромболитической активности), однако эти изменения были в пределах нормальных показателей [5].
Большинство побочных эффектов возникают в течение первого месяца лечения лорноксикамом. Каких-либо характерных изменений лабораторных параметров при приеме лорноксикама отмечено не было [5].
Сообщения о случаях смерти, связанных с применением лорноксикама, отсутствуют [5].
При проведении сравнительных исследований показано, что частота побочных эффектов такого безопасного препарата, как диклофенак, занимает промежуточное место между аналогичными показателями при приеме 4 мг лорноксикама три раза в день и 8 мг лорноксикама два раза в день [47]. Частота побочных эффектов при приеме лорноксикама была ниже, чем при приеме напроксена, пироксикама, индометацина [7, 12, 47]. При анализе частоты тяжелых побочных реакций со стороны ЖКТ при пероральном приеме различных НПВП данный показатель был наиболее низким у лорноксикама (0,9%), затем следовал мелоксикам (1,7%), диклофенак и лироксикам (по 4,9%), напроксен (7,8%) [19].
При исследованиях на животных не выявлено тератогенности, канцерогенности лорноксикама [5]. Токсическая доза (LD50), выявленная экспериментально на животных, была очень высока и составляла при пероральном введении не менее 10 мг/кг [40].
Заключение
Таким образом, лорноксикам является мощным обезболивающим и противовоспалительным препаратом с документально подтвержденной эффективностью при лечении разнообразных состояний, сопровождающихся болями и воспалением.
Биодоступность пероральных форм практически аналогична парентеральным и составляет 90-100%. Лорноксикам хорошо накапливается в очагах воспаления и в синовиальной жидкости. Есть данные о возможном предотвращении лорноксикамом деструкции хрящевой ткани.
Лорноксикам хорошо переносится, степень его безопасности аналогична диклофенаку и превышает таковую у индометацина, пироксикама, напроксена. В отличие от такого анальгетика, как кеторолак, возможно длительное применение лорноксикама.
Таким образом, лорноксикам (ксефокам) как новый представитель группы НПВП представляет собой существенное дополнение к имеющимся фармакологическим средствам для лечения состояний, сопровождающихся болями и воспалением, и может широко использоваться в практике врачей различных специальностей (включая неврологов, нейрохирургов, психиатров).
