что вводить при остановке сердца
Что вводить при остановке сердца
— При отсутствии центрального венозного доступа установите катетер с большим диаметром (например, Venflon с серой маркировкой) в крупную периферическую вену. После введения лекарственных средств промойте венозный катетер 20 мл изотонического раствора.
— Если осуществить катетеризацию вены не удалось, атропин и адреналин можно вводить в эндотрахеальную трубку; в этом случае используйте удвоенную дозу (относительно дозы для внутривенного введения) в разведении изотоническим раствором до объема 10 мл.
Применение лекарственных средств при остановке сердца
• Адреналин (1 мг внутривенно) следует вводить перед выполнением дефибрилляции (обычно каждые 3 мин) для повышения эффективности первоначальных реанимационных мероприятий. Адреналин не должен применяться, если остановка кровообращения вызвана приемом растворителей, кокаина или симпатомиметических препаратов.
• Атропин (3 мг внутривенно) вводите в тех случаях, когда остановка сердца наступила вследствие брадисистолии.
На ЭКГ нет признаков ФЖ или ЖТ?
— Прежде чем сделать заключение, что сердечный ритм не является ни фибрилляцией желудочков, ни желудочковой тахикардией, следует проверить контакты и положение электродов.
— Исключите устранимые причины остановки сердечной деятельности, связанные с брадисистолией или электромеханической диссоциацией.
— При брадисистолии внутривенно введите 3 мг атропина.
— У пациентов с выраженной брадисистолией (ЧСС 36 °С.
— Адреналин вызывает расширение зрачков, поэтому мидриаз не следует использовать в качестве признака необратимых неврологических повреждений во время или сразу после проведения реанимационных мероприятий.
Сердечно-легочная реанимация на догоспитальном этапе
Каковы наиболее частые причины внезапной смерти? Что можно сделать в случаях остановки дыхания и кровообращения на догоспитальном этапе? Почему внутрисердечный путь введения лекарственных средств — «путь отчаяния»? Сердечно-легочная реанимация — э
Каковы наиболее частые причины внезапной смерти?
Что можно сделать в случаях остановки дыхания и кровообращения на догоспитальном этапе?
Почему внутрисердечный путь введения лекарственных средств — «путь отчаяния»?
Сердечно-легочная реанимация — это комплекс мероприятий, направленных на оживление организма в случае остановки кровообращения и/или дыхания. Своевременное (в течение первых минут) начало реанимационных мероприятий может предотвратить необратимое повреждение мозга и, возможно, наступление биологической смерти.
Большинство случаев внезапной смерти имеют кардиальную причину.
Основными признаками остановки кровообращения являются потеря сознания, остановка дыхания и отсутствие пульса (следует оценивать наличие пульса на сонных артериях).
Сердечно-легочная реанимация (СРЛ) состоит из двух основных частей.
Алгоритм действий при проведении ОРМ представлен на рис. 1.
Способы введения лекарственных препаратов при СЛР
Внутривенный. При налаженном периферическом венозном доступе возможно введение лекарственных препаратов в периферическую вену, но после каждого болюсного введения необходимо поднимать руку больного для ускорения доставки препарата к сердцу, сопровождая болюс введением некоторого количества жидкости (для его проталкивания). С целью обеспечения доступа в центральную вену предпочтительно катетеризировать подключичную или внутреннюю яремную вену. Введение лекарственных препаратов в бедренную вену сопряжено с их замедленной доставкой к сердцу и уменьшением концентрации.
Эндотрахеальный. Если интубация трахеи произведена раньше, чем обеспечен венозный доступ, то атропин, адреналин, лидокаин можно вводить зондом в трахею. При этом препарат разводят на 10 мл физиологического раствора, и его доза должна быть в 2–2,5 раза больше, чем при внутривенном введении. Конец зонда должен находиться ниже конца интубационной трубки; после введения препарата необходимо выполнить последовательно 2—3 вдоха (прекратив при этом непрямой массаж сердца) для распределения лекарства по бронхиальному дереву.
Внутрисердечный. «Путь отчаяния» применяется лишь в том случае, если невозможен другой способ введения. Следует по возможности воздерживаться от внутрисердечных инъекций, так как при использовании этого способа в 40% случаев повреждаются крупные коронарные артерии.
Тактика реанимации при фибрилляции желудочков и гемодинамически неэффективной желудочковой тахикардии
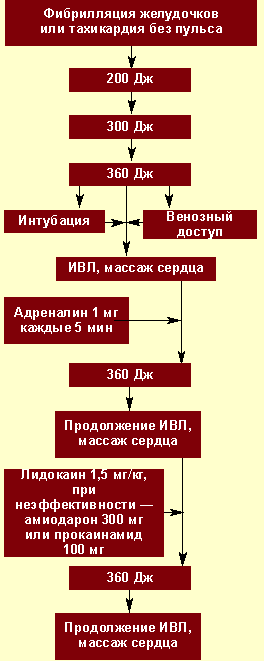
Начинать реанимацию необходимо с ОРМ и электрической дефибрилляции (ЭДФ). Дефибрилляцию начинают с разряда мощностью 200 Дж. При сохранении фибрилляции снова используют разряд, но более высокой мощности — 200—300 Дж, затем — 360 Дж. Начинать реанимационные мероприятия сразу с разряда максимальной мощности не следует, чтобы избежать повреждающего действия на миокард.
При неэффективности вышеперечисленных мероприятий возобновляют ОРМ, производят интубацию трахеи, налаживают венозный доступ, вводят адреналин в дозе 1 мг каждые 3—5 минут; можно вводить возрастающие дозы адреналина 1—3—5 мг каждые 3—5 минут или промежуточные дозы 2—5 мг каждые 3—5 минут. Адреналин можно заменить вазопрессином, который вводится в дозировке 40 мг в вену однократно.
При продолжении фибрилляции желудочков используют антиаритмические препараты, которые позволяют снизить порог дефибрилляции:
После введения лекарства 30—60 секунд проводят ОРМ, а затем повторно проводят ЭДФ (за это время антиаритмик достигает цели). Рекомендуется чередовать введение лекарств с ДФ по такой схеме: антиаритмик — ЭДФ (360 кДж) — адреналин — ЭДФ (360 кДж) —антиритмик — ЭДФ (360 кДж) — адреналин и т. д. Можно использовать не один, а три разряда максимальной мощности. Количество ЭДФ не ограничено.
Алгоритм действий при фибрилляции желудочков представлен на рис. 2.
Широко практиковавшееся ранее введение бикарбоната натрия (как средства борьбы с ацидозом) в настоящее время применяется значительно реже из-за ограниченных показаний:
Бикарбонат натрия вводится в дозе 1 мэкв/кг в вену (в среднем 140–180 мл 4%-ого раствора).
Тактика при электромеханической диссоциации
Электромеханическая диссоциация (ЭМД) — это отсутствие пульса и дыхания у больного с сохраненной электрической активностью сердца (на мониторе ритм виден, а пульса нет).
К сожалению, прогноз при этом виде нарушения деятельности сердца плохой, если не устраняется причина, вызвавшая остановку кровообращения (ацидоз, гиповолемия, гипоксия, гипотермия, тампонада сердца, напряженный пневмоторакс).
Лечение ЭМД включает ОРМ, внутривенное введение адреналина — 1 мг каждые 3—5 минут и атропина 1 мг каждые 3—5 минут, электрокардиостимуляцию, на 15-й минуте реанимации введение бикарбоната натрия. Необходимо попытаться устранить причину ЭМД.
Тактика при асистолии
Тактика устранения этой причины остановки кровообращения практически не отличается от схемы лечения ЭМД. Необходимо обратить внимание на то, что ЭКГ в одном отведении при мелковолновой фибрилляции желудочков может имитировать экстрасистолию, поэтому асистолия должна быть подтверждена в нескольких отведениях ЭКГ. Электрическая дефибрилляция в этом случае не только не показана, но даже вредна, так как она усиливает ваготонию. Лечение включает ОРМ, в вену вводится адреналин — 1 мг каждые 3—5 минут, атропин — 1 мг каждые 3—5 минут, проводится электрокардиостимуляция, на 15-й минуте реанимации показано введение бикарбоната натрия. Необходимо попытаться устранить причину асистолии. Алгоритм действий при асистолии представлен на рис. 3.
Заключение
В случае успешно проведенных реанимационных мероприятий необходимо:
А. Л. Верткин, доктор медицинских наук, профессор
О. Б. Талибов, кандидат медицинских наук
О. Н. Ткачева
МГМСУ, ННПОСМП, Москва
Сердечно-легочная реанимация у взрослых
В основе мероприятий, проводимых у пациентов с остановкой кровообращения и дыхания, лежит концепция «цепочки выживания». Она состоит из действий, выполняемых на месте происшествия, при транспортировке, в операционной и отделении реанимации, а также при п
В основе мероприятий, проводимых у пациентов с остановкой кровообращения и дыхания, лежит концепция «цепочки выживания». Она состоит из действий, выполняемых на месте происшествия, при транспортировке, в операционной и отделении реанимации, а также при последующей реабилитации. Самым уязвимым и при этом очень важным звеном является первичный реанимационный комплекс, проводимый на месте происшествия, поскольку через 3–5 мин после остановки кровообращения и дыхания при обычной температуре тела развиваются необратимые изменения головного мозга пострадавшего.
Возможны как первичная остановка дыхания, так и первичная остановка кровообращения. Выявление первичной остановки дыхания (инородные тела дыхательных путей, электротравма, утопление, поражение центральной нервной системы (ЦНС) и др.) маловероятно на догоспитальном этапе, так как к моменту прибытия бригады скорой помощи успевает развиться фибрилляция желудочков или асистолия.
Причиной первичной остановки кровообращения могут быть острый инфаркт миокарда, аритмия различного характера, электролитный дисбаланс, тромбоэмболия легочной артерии, разрыв и расслоение аневризмы аорты и т. д.
Различают три варианта прекращения сердечной деятельности: асистолия, фибрилляция и электромеханическая диссоциация. Асистолия может быть первичной или вторично развиться после фибрилляции желудочков. В первом случае шансов на успех реанимации больше, во втором, при истощении резервов миокарда, — меньше. Иногда изолинию на электрокардиограмме (ЭКГ) воспринимают как асистолию, но она может наблюдаться и при неисправности электрокардиографа, случайном отсоединении электродов, низкоамплитудной ЭКГ и т. п. Электромеханическая диссоциация характеризуется наличием электропродукции сердца, но отсутствием сокращения миокарда.
При фибрилляции возникают разрозненные, беспорядочные, неэффективные сокращения миокарда. И здесь имеют значение применение прекордиального удара и рано выполненная дефибрилляция.
Признаками остановки кровообращения являются: потеря сознания; отсутствие пульса на сонных артериях; остановка дыхания; судороги; расширение зрачков и отсутствие их реакции на свет; изменение цвета кожных покровов.
Для подтверждения остановки сердца достаточно наличие первых трех признаков.
Сердечно-легочная реанимация (СЛР) не показана, и ее можно не начинать в случаях: если установлено, что с момента остановки сердца (при нормальной температуре окружающей среды) прошло свыше 25 мин; больные заранее зафиксировали свой отказ от СЛР.
В иных случаях при оказании помощи на догоспитальном этапе СЛР начинается немедленно.
Поводом для прекращения СЛР является отсутствие признаков восстановления кровообращения и дыхания при использовании всех доступных методов СЛР в течение 30 мин.
СЛР на догоспитальном этапе
Она включает в себя элементарное поддержание жизни (по П. Сафару) или первичный реанимационный комплекс (по А. Зильберу):
Кроме того, производятся мероприятия (рис. 1) специализированного реанимационного комплекса (по А. Зильберу), включающего:
Восстановление проходимости дыхательных путей. При возникновении неотложных состояний проходимость дыхательных путей часто нарушается в результате западения языка, аспирации рвотными массами, кровью. Необходимо очистить ротоглотку и выполнить «тройной прием Сафара» — разогнуть голову в шейном отделе позвоночника; выдвинуть нижнюю челюсть вперед и вверх; открыть рот. Если невозможно исключить перелом шейного отдела позвоночника и разгибать голову нельзя, ограничиваются выдвижением челюсти и открытием рта.
Если зубной протез цел, его оставляют в полости рта, так как это сохраняет контур рта и облегчает проведение ИВЛ.
При обструкции дыхательных путей инородным телом пострадавшего укладывают на бок и производят 3–5 резких ударов нижней частью ладони в межлопаточной области, затем пальцем пытаются удалить инородное тело из ротоглотки. Если этот метод неэффективен, то выполняют прием Геймлиха: ладонь реаниматолога укладывается на живот между пупком и мечевидным отростком, вторую руку укладывают на первую и производят толчок снизу вверх по средней линии. После чего также пальцем пытаются удалить инородное тело из ротоглотки.
В связи с опасностью инфицирования реаниматолога при контакте со слизистой рта и носа, а также для повышения эффективности ИВЛ используется ряд приспособлений: устройство «ключ жизни»; пероральный воздуховод; трансназальный воздуховод; фаринго-трахеальный воздуховод; двухпросветный пищеводно-трахеальный воздуховод (комбитьюб); ларингеальная маска.
Большим шагом вперед явилось создание ларингеальной маски. Ларингеальный масочный воздуховод представляет собой интубационную трубку, которая не проходит через голосовую щель в трахею, а имеет на дистальном конце миниатюрную маску, которая надевается на гортань. Манжета, прилегающая к краю маски, раздувается вокруг гортани, обеспечивая герметичность по ларингеальному периметру. Ларенгеальная маска обладает множеством преимуществ, в том числе позволяет обойтись без разгибания головы в шейном отделе, если к этому имеются противопоказания.
Каждый врач скорой помощи должен уметь выполнять интубацию трахеи. Этот метод позволяет обеспечить оптимальную проходимость дыхательных путей, снизить вероятность регургитации при проведении комплекса реанимационных мероприятий, обеспечить более высокое внутрилегочное давление. Кроме того, через интубационную трубку можно вводить некоторые медикаменты.
ИВЛ. Искусственное дыхание — это вдувание воздуха или обогащенной кислородом смеси в легкие пациента без или с применением специальных устройств. Выдыхаемый человеком воздух содержит от 16 до 18% кислорода, поэтому эффективнее ИВЛ атмосферным воздухом, либо кислородо-воздушной смесью. Каждое вдувание должно занимать 1–2 с, а частота дыхательных движений составлять 12–16 в минуту. Адекватность ИВЛ оценивается по периодическому расширению грудной клетки и пассивному выдыханию воздуха.
Бригадой скорой помощи обычно используются либо воздуховод, либо лицевая маска и мешок Амбу, либо интубация трахеи и мешок Амбу.
Непрямой массаж сердца. После остановки кровообращения в течение 20–30 мин в сердце сохраняются функции автоматизма и проводимости, что позволяет его «запустить». Основной целью массажа сердца является создание искусственного кровотока. За время проведения непрямого массажа сердца происходит сжатие не только сердца, но и легких, которые содержат большое количество крови. Этот механизм принято называть грудным насосом.
При проведении непрямого массажа сердца пациент должен находиться на твердой поверхности. Одна ладонь реаниматолога располагается на нижней трети грудины по средней линии, вторая упирается в тыльную поверхность первой. Время надавливания и отпускания — 1 с, интервал между компрессиями — 0,5–1 с. Грудина у взрослого должна «продавливаться» на 5–6 см. При выполнении каких-либо лечебных мероприятий перерыв в тракциях не должен превышать 5–10 сек. Критериями эффективности непрямого массажа сердца являются появление пульсовых толчков на сонных артериях, артериальное давление на уровне 60–70 мм рт. ст., изменение цвета кожных покровов.
Если помощь оказывает один реаниматолог, то на два вдувания воздуха выполняются 15 тракций, если работают два реаниматолога, то на одно вдувание воздуха осуществляется 5 тракций.
 |
| Рисунок 2. Алгоритм неотложной помощи при фибрилляции желудочков |
Электрическая дефибрилляция сердца (ЭДС). Это важнейший компонент СРЛ. ЭДС эффективна только при сохранности энергетического ресурса миокарда, т. е. при регистрации на ЭКГ крупноволновых осцилляций от 0,5 до 1 мВ и более (рис. 2). Если же отмечаются низкие, аритмичные, полиморфные осцилляции, а также асистолия, то начинают с ИВЛ, непрямого массажа и медикаментозной терапии (рис. 3), добиваются перехода асистолии или мелковолновой фибрилляции желудочков в крупноволновую фибрилляцию и применяют ЭДС.
Первый разряд для ЭДС — 200 Дж, при неэффективности второй — 300 Дж, при неэффективности третий — 360 Дж. Перерыв между разрядами минимальный — для контроля ритма. Непрямой массаж сердца и ИВЛ прерываются только на момент разряда. Если первая серия из трех разрядов оказывается неэффективной, то на фоне продолжающейся ИВЛ, непрямого массажа сердца, медикаментозной терапии проводится вторая серия разрядов в той же последовательности.
В настоящее время на догоспитальном этапе применяются автоматические наружные дефибрилляторы, в этом случае ЭКГ регистрируется с электродов дефибриллятора, приложенных к грудной клетке. Дефибриллятор регистрирует ритм сердца и производит его автоматический анализ; при выявлении желудочковой тахикардии или фибрилляции желудочков конденсаторы автоматически заряжаются, и прибор дает разряд. Эффективность автоматических дефибрилляторов очень высока. Кроме автоматических, используются полуавтоматические наружные дефибрилляторы.
Медикаментозная терапия при сердечно-легочной реанимации. Медикаменты при СЛР могут вводиться: в периферическую вену; в центральную вену; в трахею.
По понятным причинам внутримышечный путь введения не показан. При наличии возможности катетеризируется периферическая вена. Если реаниматолог опытный и хорошо владеет методикой пункции центральной вены, можно использовать этот способ. Проблема в том, что в этом случае приходится прерывать реанимационные мероприятия, а перерыв больше, чем на 5–10 с нежелателен. Внутритрахеальный путь удобен, если выполнена интубация трахеи, в крайнем случае можно ввести препараты в трахею через перстнещитовидную мембрану. Эндотрахеально допустимо вводить адреналин, атропин, лидокаин. Препараты лучше развести в 10–20 мл 0,9% раствора натрия хлорида.
Адреналин остается средством выбора при остановке кровообращения. При асистолии и электромеханической диссоциации он «тонизирует» миокард и помогает «запустить» сердце, мелковолновую фибрилляцию переводит в крупноволновую, что облегчает ЭДС. Дозы: по 1–2 мг внутривенно струйно с интервалом 5 мин, суммарно обычно — до 10-15 мг.
М-холинолитик атропин снижает тормозящее влияние ацетилхолина на синусовый узел и атриовентрикулярную проводимость и, возможно, способствует высвобождению катехоламинов из мозгового слоя надпочечников. Он показан при брадисистолии и асистолии. Дозы — 1 мг, можно повторить через 5 мин, но не более 3 мг за время реанимации.
Все антиаритмические препараты оказывают депрессивное действие на миокард и небезвредны для организма пациента. При развившейся фибрилляции желудочков их следует вводить лишь в случае нескольких неудачных попыток ЭДС, поскольку они, подавляя желудочковую эктопию затрудняют восстановление самостоятельного ритма. Лидокаин считается одним из наиболее эффективных средств при рефрактерной фибрилляции желудочков, устойчивой желудочковой тахикардии и тахикардиях неясной этиологии с широким комплексом QRS. Доза для насыщающего внутривенного введения — 1,5 мг/кг струйно (обычно — 75–100 мг). Одновременно начинается введение поддерживающей дозы 2–4 мг в мин. Для этого 1 г лидокаина разводится в 250 мл 5% раствора глюкозы.
Показанием к введению гидрокарбоната натрия можно считать затянувшуюся более чем на 15 мин реанимацию, если остановке сердца предшествовали выраженный метаболический ацидоз или гиперкалиемия. Доза — 1 ммоль/кг, внутривенно однократно, при повторном введении она уменьшается вдвое. Некоторые авторы считают, что при адекватных реанимационных мероприятиях гидрокарбонат натрия следует вводить только под контролем кислотно-основного состояния, поскольку организм значительно хуже адаптируется к алкалозу, чем к ацидозу.
В качестве инфузионных растворов целесообразно использовать 0, 9% раствор хлорида натрия, но наиболее эффективен раствор лактата Рингера по Хартману, а из коллоидов — растворы со средней молекулярной массой, содержащие гидроксиэтилкрахмал — волювен или венофундин.
Во всех случаях показана экстренная госпитализация по витальным показаниям в отделение реанимации и интенсивной терапии.
И. Г. Труханова, доктор медицинских наук, доцент
Е. В. Двойникова, кандидат медицинских наук, доцент
Самарский государственный медицинский университет, Самара
Остановка сердца с успешным восстановлением сердечной деятельности (I46.0)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Различают 3 вида состояний, развивающихся после прекращения деятельности сердца:
Реанимация в терминальной стадии любой неизлечимой болезни не имеет перспектив и не должна применяться.
Абсолютное противопоказание к оживлению – выраженные гипостатические пятна в отлогих частях тела, являющиеся достоверным признаком биологической смерти.
Дополнительные признаки:
— изменение цвета кожных покровов (очень бледный или цианотичный);
— расширение зрачков.
Наличие любых трех из четырех основных признаков в любой комбинации дает право поставить диагноз «клиническая смерть» и начать проведение с ердечно-легочной и церебральной реанимации ( СЛЦР ).
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Виды прекращения сердечной деятельности:
На основе учета степени и характера нарушения проводимости может быть построена рациональная классификация видов остановки сердца.
Первая группа нарушений проводимости сердца включает нарушения проведения возбуждений между различными отделами сердца, при этом возбудимость и сократимость миокарда внутри каждого отдела сердца сохраняются.
К данной группе относятся:
— асистолия всего сердца вследствие нарушений и полной блокады проводимости между синусовым узлом и предсердиями;
— асистолия желудочков в результате полной поперечной блокады;
— резко выраженная желудочковая брадикардия (меньше 30 сокращений в минуту) при неполной блокаде проводимости между предсердиями и желудочками или при наличии редкого автоматизма идиовентрикулярного происхождения.
Вторая группа нарушений проводимости сердца включает нарушения проведения возбуждения внутри проводящей системы желудочков, из-за чего координированность сокращений миокарда желудочков нарушается.
К данной группе относятся:
— фибрилляция и трепетание желудочков;
— пароксизмальная тахикардия, связанная с нарушением внутрижелудочковой или внутрипредсердной проводимости.
Этиология и патогенез
Привести к остановке сердца могут как кардиальные, так и некардиальные причины.
Заболевания сердца, способные привести к остановке сердца
I. Ишемическая болезнь сердца
Возможные причины электрической нестабильности миокарда:
— острая или хроническая ишемия миокарда;
— постинфарктное ремоделирование сердца с развитием хронической сердечной недостаточности.
II. Другие кардиальные причины:
1. Травма (часто с развитием тампонады).
2. Тяжелый стеноз устья аорты.
3. Прямая кардиостимуляция, катетеризация полостей сердца, коронарография (асистолия является одним из возможных осложнений).
4. Инфекционный эндокардит.
5. Кардиомиопатии (гипертрофическая кардиомиопатия, дилатационная кардиомиопатия, алкогольная кардиопатия, «сердце спортсмена»).
6. Синдром низкого выброса.
7. Миокардит (например, при дифтерии, гриппе).
8. Экссудативный перикардит (тампонада сердца с развитием электромеханической диссоциации и асистолии возникает при скоплении большого количества жидкости).
III. Экстракардиальные причины, способные привести к остановке сердца.
1. Циркуляторные:
— гиповолемия (в особенности в результате кровопотери);
— анафилактический, бактериальный или геморрагический шок;
— напряженный пневмоторакс, особенно у пациентов с легочными заболеваниями, травмой грудной клетки или находящихся на искусственной вентиляции легких;
— вазо-вагальный рефлекс (остановка сердца при ударе по передней брюшной стенке);
— тромбоэмболия крупных ветвей легочной артерии.
2. Респираторные:
3. Метаболические:
— острая гиперкальциемия (гиперкальциемический криз при первичном гиперпаратиреозе);
— переохлаждение (снижение температуры тела ниже 28 о С);
— тампонада сердца при уремии;
— гиперадреналинемия (гиперпродукция и усиленный выброс в кровь катехоламинов на высоте сильного психоэмоционального стресса).
4. Побочные эффекты при приеме следующих препаратов:
— средства для наркоза;
— недигидропиридиновые антагонисты кальция;
— препараты, удлиняющие интервал Q–T (дизопирамид, хинидин);
— передозировка сердечных гликозидов.
5. Разные причины:
— электротравма (поражение током, ударом молнии, осложнение электроимпульсной терапии при неадекватном использовании);
— асфиксия (в том числе утопление);
— сепсис, тяжелая бактериальная интоксикация;
— цереброваскулярные осложнения, в частности кровотечения;
— модифицированные диетические программы борьбы с излишней массой тела, основанные на приеме жидкости и белка.
Патогенез остановки сердца
Факторами, вызывающими электрическую нестабильность миокарда, могут выступать его острая или хроническая ишемия, повреждение, постинфарктное ремоделирование сердца с развитием хронической сердечной недостаточности.
Экспериментально выявлены следующие механизмы развития электрической нестабильности миокарда:
1.На клеточно-тканевом уровне появляется гетерогенность сократительного миокарда в результате чередования кардиомиоцитов с различной активностью оксиредуктаз, их диссеминированные повреждения, гипертрофия, атрофия и апоптоз. Наблюдается развитие интерстициального отека и явлений кардиосклероза, нарушающих консолидацию клеток миокарда в функциональный синцитий.
2. На уровне субклеточных структур:
— снижение и зональное насыщение плазмолеммы холестерином;
— изменение плотности бета-адренорецепторов и соотношения активности сопряженных с ними аденилатциклазы и фосфодиэстеразы;
— снижение объемной плотности Т-системы и нарушение ее контактов с цистернами саркоплазматического ретикулума;
— модификация вставочных дисков с разобщением некрусов;
— пролиферация митохондрий и их функциональное ассоциирование на значительной территории наиболее адаптированных кардиомиоцитов.
Выраженность выявленных изменений положительно коррелирует с достоверными нарушениями проведения электрических импульсов в миокарде.
Весомое значение имеют также механическое растяжение волокон миокарда вследствие дилатации камер сердца; гипертрофия сердечной мышцы и нарушения нейрогуморальной регуляции сердечного ритма, электролитного обмена, кислотно-основного состояния; гиперкатехоламинемия.
Возможно чередование периодов асистолии и резкой брадикардии с эпизодами фибрилляции желудочков или желудочковой тахикардии.
При экстракардиальных причинах патогенез умирания различен: при большой кровопотере деятельность сердца угасает постепенно; при гипоксии, асфиксии и раздражении блуждающих нервов возможна мгновенная остановка сердца.
Массивная эмболия сосудов легкого приводит к циркуляторному коллапсу и смерти в течение нескольких минут приблизительно в 10% случаев; некоторые пациенты умирают спустя какое-то время при прогрессирующей правожелудочковой недостаточности и гипоксии.
Использование модифицированных диетических программ, направленных на снижение массы тела с применением белков и жидкости, может приводить к развитию первичной дегенерации атриовентрикулярной проводящей системы с внезапной смертью при отсутствии тяжелого коронарного атеросклероза; часто при этом обнаруживается трифасцикулярная атриовентрикулярная блокада.
При ряде состояний (гипотермия, гиперкалиемия, острый миокардит, неадекватное применение ряда лекарственных препаратов) развитие асистолии может быть опосредовано остановкой или блокадой синусно-предсердного узла с последующим угнетением нижерасположенных пейсмекеров или синдромом слабости синусового узла, сопровождаемым обычно нарушением функции проводящей системы.
Фибромы и воспалительные процессы в области синусно-предсердного или предсердно-желудочкового узлов иногда могут привести к внезапной смерти у людей, не имевших ранее признаков болезни сердца.
При цереброваскулярных расстройствах внезапная остановка сердца чаще опосредована субарахноидальным кровоизлиянием, внезапным изменением внутричерепного давления или поражением ствола мозга.
Патогенез остановки сердца может варьировать в пределах действия одного этиологического фактора. Например, рефлекторная остановка дыхания может возникать при механической асфиксии, как результат непосредственного сдавления каротидных синусов. В иной ситуации могут сдавливаться крупные сосуды шеи, трахеи, может наблюдаться перелом шейных позвонков, что обуславливает несколько другой патогенетический оттенок непосредственного механизма остановки сердца. При утоплении вода может быстро залить трахеобронхиальное дерево, выключив альвеолы из функции оксигенации крови; в другом варианте механизм смерти определяют первичный спазм голосовой щели и критический уровень гипоксии.
Наиболее разнообразны причины «наркозной смерти»:
— рефлекторная остановка сердца в результате недостаточной атропинизации больного;
— асистолия как следствие кардиотоксического действия барбитуратов;
— выраженные симпатомиметические свойства некоторых ингаляционных анестетиков (фторотан, хлороформ, трихлорэтилен, циклопропан).
В ходе анестезии первичная катастрофа может возникнуть в сфере газообмена («гипоксическая смерть»).
При травматическом шоке главным патогенетическим фактором является кровопотеря. Однако в ряде наблюдений при травматическом шоке на первый план выступают первичные расстройства газообмена (травмы и ранения груди); интоксикация организма продуктами клеточного распада (обширные раны и размозжения), бактериальными токсинами (инфекция); жировая эмболия; выключение жизненно важной функции сердца, головного мозга в результате их прямой травмы.


