что вовлекается в первые реакции кетогенеза
Строение кетоновых тел
В обычных условиях синтез кетоновых тел также идет, хотя в гораздо меньшем количестве. Для этого используются как жирные кислоты, так и безазотистые остатки кетогенных и смешанных аминокислот.
Для детей раннего возраста характерна неустойчивость жирового обмена, связанная с недостаточностью регуляторного влияния ЦНС и эндокринной системы. Поэтому кетонемия и кетонурия у грудных детей наблюдается чаще, чем у взрослых.
Уровень ацетоацетата быстро нарастает между 12 и 24 часами жизни и сохраняется высоким первую неделю жизни, что свидетельствует об активной мобилизации жира из депо, высокой утилизации свободных жирных кислот в печени и малом использовании кетоновых тел в тканях.
У детей до 7 лет под влиянием различных стимулов (краткое голодание, инфекции, эмоциональное возбуждение) ускоряется синтез кетоновых тел и может легко возникать кетоацидоз, сопровождающийся неукротимой рвотой («ацетонемическая рвота«). Причиной этого служит неустойчивость углеводного обмена и малые запасы гликогена у детей, что усиливает липолиз в адипоцитах, накопление жирных кислот в крови и, следовательно, кетогенез в печени.
Синтез кетоновых тел (кетогенез)
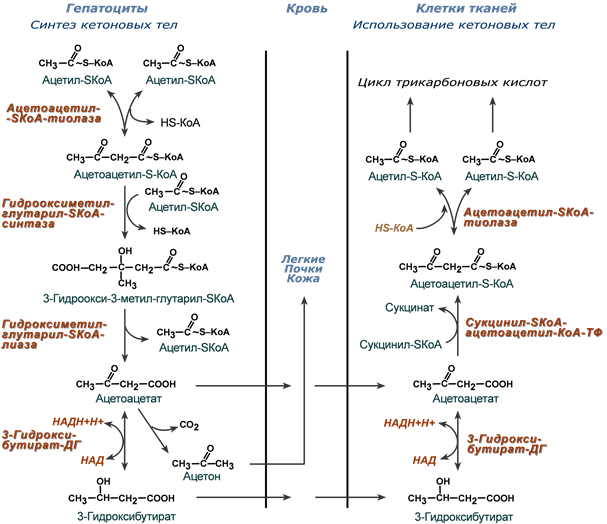
Реакции синтеза и утилизации кетоновых тел
Используются кетоновые тела клетками всех тканей, кроме печени и эритроцитов. Особенно активно, даже в норме, они потребляются миокардом и корковым слоем надпочечников.
В тканях реакции утилизации кетоновых тел в целом совпадают с обратным направлением реакций синтеза. В цитозоле клеток 3-гидроксибутират окисляется, образующийся ацетоацетат проникает в митохондрии, активируется за счет сукцинил-SКоА и превращается в ацетил-SКоА, который сгорает в ЦТК.
При сахарном диабете 1 типа (инсулинзависимом) в гепатоците глюкозы может быть много, т.к. глюкоза проникает в него через ГлюТ-2 без участия инсулина. Однако, точно также как при голодании, соотношение инсулин/глюкагон низкое, и оксалоацетат очень активно уходит на синтез глюкозы, что тормозит ЦТК и отправляет ацетил-SKoA на образование кетоновых тел.
При сахарном диабете 2 типа (инсулиннезависимом) инсулина достаточно и соотношение инсулин/глюкагон велико, поэтому глюконеогенез не активен и оксалоацетата хватает для поддержания ЦТК. Образуемый здесь ацетил-SKoA либо сгорает в ЦТК, либо используется для реакций синтеза холестерина и синтеза жирных кислот (которые стимулируются инсулином). К тому же при наличии инсулина попадающие в печень жирные кислоты будут не окисляться, а вовлекаться в синтез триацилглицеролов и ЛПОНП.
Параграф 47. 1. Кетоновые тела
Автор текста – Анисимова Елена Сергеевна.
Авторские права защищены. Продавать текст нельзя.
Курсив не зубрить.
Замечания можно присылать по почте: exam_bch@mail.ru
https://vk.com/bch_5
Параграф учебника по биохимии 47.1.
Кетоновые тела:
определение, обмен, синтез, использование, роль, значении при патологии, регуляция обмена.
Содержание параграфа:
47.1.1. Синтез кетоновых тел.
47.2.2. Окисление кетоновых тел.
47.1.3. Кетозы
Определение.
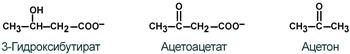
Кетоновые тела – это группа веществ:
ацетон, ;-кетобутират и ;-гидроксибутират.
(Но не у всех из них есть кетогруппы – только у кетобутирата).
Обмен кетоновых тел (КТ).
Обмен конкретного вещества – это
процессы образования (синтеза) и использования вещества.
КТ могут использоваться большинством тканей
для выработки энергии (АТФ)
и тем самым поддерживать жизнь тканей.
Нервная ткань использует кетоновые тела для миелинизации.
(В этом польза КТ).
Но избыток КТ приводит к ацидозу.
(В этом их патогенность).
Синтез КТ называется кетогенезом.
47.1.1. Синтез кетоновых тел (кетогенез).
Кетогенез происходит в печени
(в митохондриях гепатоцитов)
при накоплении в гепатоцитах ацетилКоА,
который образуется в основном из жирных кислот
при ;-окислении
(жирные кислоты поступают из крови,
в которую поступают из белой жировой ткани
или из липопротеинов
при распаде жира – липолизе, п.44.1).
1-я реакция кетогенеза:
из двух молекул ацетилКоА образуется ацето/ацетилКоА.
2-я реакция кетогенеза:
ацето/ацетилКоА вступает в реакцию с третьей молекулой ацетилКоА,
превращаясь в ГМГ-КоА
(;-Гидрокси/;-Метил/ГлутарилКоА:
это тиоэфир глутаровой кислоты
с группой ОН и метильной группами в ; положении)
под действием фермента ГМГ-КоА-синтазы.
3-я реакция: ГМГ-КоА расщепляется
на ацетилКоА и ацетоацетат
(синоним – ;-кето/бутират)
под действием фермента ГМГ-КоА/лиазы.
Ацетоацетат – это первое кетоновое тело.
4-я реакция кетогенеза:
бОльшая часть ацетоацетата вступает в обратимую реакцию в НАДН,
превращаясь в ;-ОН-бутират
(под действием фермента ;-ОН-бутират/дегидрогеназы),
поэтому основное кетоновое тело в крови – это ;-ОН-бутират.
После кетозенеза продукты кетошенеза
;-ОН-бутират и ;-кетобутираты поступают в кровь
и кровотоком доставляются в ткани.
Часть ацетоацетата без участия фермента превращается в ацетон
при отщеплении карбоксильной группы в виде СО2 (при декарбоксилировании).
Тут надо добавить таблицу с формулами
«Р е а к ц и и кетогенеза (синтеза кетоновых тел) в МХ гепатоцитов».
Но пока она в отдельном файле.
47.1.2. Окисление кетоновых тел.
Что происходит с КТ в тканях.
В тканях КТ (бутираты) превращаются в ацетилКоА,
который поступает в ЦТК для выработки АТФ.
Этот путь использования КТ тканями называется окислением КТ
и нужен для получения АТФ в клетках
(окисление ;-кето-бутирата дает 19 молекул АТФ,
а окисление ;-ОН-бутирата дает 21,5 АТФ).
Выработка ацетилКоА из КТ
снижает потребность головного мозга в глюкозе
как субстрате для выработки АТФ,
которая является основным источником ацетилКоА;
но глюкоза должна поступать в нейроны для получения из нее оксалоацетата,
иначе без него ацетилКоА не сможет использоваться в ЦТК.
Второй путь использования кетоновых тел в тканях:
в нервной ткани ацетилКоА,
полученный из кетоновых тел,
используется для синтеза жирных кислот (п.46)
для синтеза липидов миелиновых оболочек (мембран шванновских клеток),
то есть для миелинизации.
Как КТ превращаются в ацетилКоА.
;-ОН бутират превращается в ;-кетобутират
при отщеплении водорода под действием фермента ;-ОН/бутират/дегидрогеназы:
см. п.22 и 21
отщепленные атомы водорода переносятся на НАД+,
превращая его в НАДН, Н+;
использование НАДН, Н+ в ДЦ
дает 2,5 АТФ
(поэтому окисление ;-ОН/бутирата дает на 2,5 АТФ больше,
чем окисление ;-кето/бутирата).
;-кетобутират превращается в ;-кето/бутирил/КоА (=ацетоацетилКоА) одним из двух способов:
— либо вступая в реакцию с КоA
(при этом тратится 1 АТФ,
поэтому этот способ активации менее выгоден, чем следующий; см. 2а),
— либо вступая в реакцию с сукцинилКоА:
;-кетобутират + сукцинилКоА ;
;-кетобутирилКоА + сукцинат; см. 2б.
;-кето/бутирилКоА расщепляется на 2 молекулы ацетилКоА (см. 3),
поступление которых в ЦТК дает 20 молекул АТФ
(по 10 АТФ от каждого ацетилКоА – см. п.21).
Тут надо добавить таблицу с формулами превращений кетоновых тел в ацетилКоА
«Р е а к ц и и окисления кетоновых тел в тканях»
Но пока она в отдельном файле.
– это состояния, при которых повышена концентрация кетоновых тел в крови
(это повышение называется гипер/кетон/емией)
и присутствуют кетоновые тела в моче
(это называется кетонурией).
Из-за того, что 2 из 3 кетоновых тел (бутираты, но не ацетон) являются кислотами,
их избыток (кетоз) приводит к ацидозу:
чем больше в крови кетоновых тел,
тем сильнее ацидоз
(кислоты при рН около 7 диссоциируют на анион и протон Н+,
ацидозом является накопление именно протонов).
При умеренном ацидозе возникает тошнота,
а сильный ацидоз угрожает жизни
(см. о кетоацидотической коме при СД в п.103).
Кетозы являются результатом повышенного образования кетоновых тел
(результатом усиления кетогенеза).
Причиной усиления кетогенеза является:
увеличение концентрации ацетилКоА в гепатоцитах
из-за активации липолиза в жировой ткани и ГНГ в печени,
что бывает при:
1) при нарушении питания,
при котором употребляется много жиров
при недостаточном употреблении углеводов
(сало без хлеба, жирная колбаса без каши, масло без ничего и т.п.),
так как при этом образуется много ацетилКоА из жира,
но не хватает оксалоацетата из-за дефицита углеводов,
2) при недостатке инсулина при сахарном диабете,
поскольку инсулин мог бы затормозить липолиз и ГНГ),
3) при избытке таких гормонов, как:
1 – катехоламины
(избыток КА бывает у здоровых людей при стрессе
или у больных с гиперфункцией мозгового вещества надпочечников),
2 – глюкагон
(у здоровых при голоде),
3 – йодтиронины
(при гиперфункции ЩВЖ, при тиреотоксикозе),
4 – СТГ
(при гиперфункции гипофиза при акромегалии и при гигантизме).
Таким образом, кетозы бывают и у больных, и у здоровых,
но у здоровых кетозы менее сильные и менее опасны для жизни.
У здоровых кетозы бывают (физиологические кетозы) при:
1) избытке жиров в пище при недостатке углеводов,
2) при стрессе и голоде,
3) при беременности.
Хотя сильный кетоз при беременности является патологией, может быть опасен и т.д.
Патологические кетозы
бывают при лихорадках
и при эндокринных заболеваниях:
— сахарном диабете (см. п. 103),
— акромегалии,
— тиреотоксикозе.
При сильном кетозе бывает появление запаха ацетона,
но отсутствие запаха ацетона не гарантирует отсутствие кетоза:
нужно определять [кетоновых тел] в крови (кетонемию)
и присутствие кетоновых тел в моче (кетонурию).
Кетогенез, типы кетоновых тел, синтез и деградация
cetogénesis это процесс, с помощью которого получают ацетоацетат, β-гидроксибутират и ацетон, которые вместе называют кетоновыми телами. Этот сложный и тонко регулируемый механизм осуществляется в митохондриях, от катаболизма жирных кислот.
Получение кетоновых тел происходит, когда организм подвергается истощающим периодам голодания. Хотя эти метаболиты синтезируются в основном в клетках печени, они обнаруживаются в качестве важного источника энергии в различных тканях, таких как скелетные мышцы и ткани сердца и головного мозга..
Hydro-гидроксибутират и ацетоацетат являются метаболитами, используемыми в качестве субстратов в сердечной мышце и коре почек. В мозгу кетоновые тела становятся важными источниками энергии, когда организм исчерпал свой запас глюкозы.
Общие характеристики
Кетогенез считается очень важной физиологической функцией или метаболическим путем. Как правило, этот механизм осуществляется в печени, хотя было показано, что он может осуществляться в других тканях, способных метаболизировать жирные кислоты..
Образование кетоновых тел является основным метаболическим производным ацетил-КоА. Этот метаболит получают из метаболического пути, известного как β-окисление, которое является разложением жирных кислот.
Наличие глюкозы в тканях, где происходит β-окисление, определяет метаболическую судьбу ацетил-КоА. В особых ситуациях окисленные жирные кислоты почти полностью направляются на синтез кетоновых тел..
Типы и свойства кетоновых тел
Основным кетоновым телом является ацетоацетат или ацетоуксусная кислота, которая синтезируется главным образом в клетках печени. Другие молекулы, которые составляют кетоновые тела, происходят из ацетоацетата.
Восстановление ацетоуксусной кислоты приводит к образованию D-β-гидроксибутирата, второго кетонового тела. Ацетон представляет собой соединение, которое трудно разлагать, и он образуется в результате спонтанной реакции декарбоксилирования ацетоацетата (поэтому он не требует вмешательства какого-либо фермента), когда он присутствует в высоких концентрациях в крови.
Обозначение кетоновых тел было принято условно, поскольку, строго говоря, β-гидроксибутират не имеет кетонной функции. Эти три молекулы растворимы в воде, что облегчает их транспорт в крови. Его основная функция заключается в обеспечении энергией определенных тканей, таких как скелетные и сердечные мышцы..
Ферменты, участвующие в образовании кетоновых тел, в основном находятся в клетках печени и почек, что объясняет, почему эти два места являются основными продуцентами этих метаболитов. Его синтез происходит только и исключительно в митохондриальном матриксе клеток..
Как только эти молекулы синтезируются, они попадают в кровоток и попадают в ткани, которые в них нуждаются, где они разлагаются до ацетил-КоА..
Синтез кетоновых тел
Условия для кетогенеза
Метаболическая судьба ацетил-КоА от β-окисления зависит от метаболических потребностей организма. Это окисляется до СО2 и H2Или через цикл лимонной кислоты или синтез жирных кислот, если метаболизм липидов и углеводов в организме стабилен.
Когда организму требуется образование углеводов, оксалоацетат используется для производства глюкозы (глюконеогенез) вместо запуска цикла лимонной кислоты. Это происходит, как уже упоминалось, когда организм имеет некоторую неспособность получить глюкозу в таких случаях, как длительное голодание или наличие диабета..
В связи с этим ацетил-КоА, полученный в результате окисления жирных кислот, используется для производства кетоновых тел..
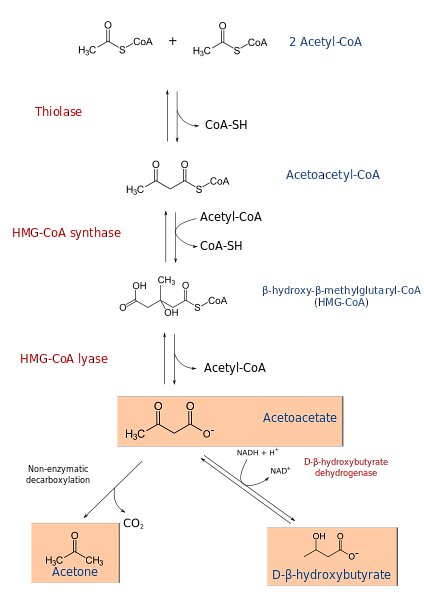
механизм
Процесс кетогенеза начинается с продуктов β-окисления: ацетацетил-КоА или ацетил-КоА. Когда субстратом является ацетил-КоА, на первом этапе происходит конденсация двух молекул, реакция, катализируемая ацетил-КоА-трансферазой, с образованием ацетацетил-КоА.
Ацетацетил-КоА конденсируется с третьим ацетил-КоА под действием синтазы ГМГ-КоА с образованием ГМГ-КоА (β-гидрокси-β-метилглутарил-КоА). HMG-CoA разлагается до ацетоацетата и ацетил-КоА под действием лиазы HMG-CoA. Таким образом получается первое кетоновое тело..
Ацетоацетат восстанавливается до β-гидроксибутирата путем вмешательства β-гидроксибутиратдегидрогеназы. Эта реакция зависит от НАДН.
Основным ацетоацетатным кетоновым телом является β-кетокислота, которая подвергается неферментативному декарбоксилированию. Этот процесс прост и производит ацетон и СО2.
Таким образом, эта серия реакций приводит к образованию кетоновых тел. Они, будучи растворимыми в воде, могут легко транспортироваться через кровоток без необходимости прикрепления к структуре альбумина, как в случае жирных кислот, которые нерастворимы в водной среде..
Β-окисление и кетогенез связаны между собой
Метаболизм жирных кислот производит субстраты для кетогенеза, поэтому эти два пути функционально связаны.
Ацетоацетил-КоА является ингибитором метаболизма жирных кислот, поскольку он останавливает активность ацил-КоА-дегидрогеназы, которая является первым ферментом β-окисления. Кроме того, он также оказывает ингибирование на ацетил-КоА-трансферазу и синтазу HMG-КоА..
Фермент синтаза HMG-CoA, подчиненный СРТ-I (фермент, участвующий в производстве ацилкарнитина при β-окислении), представляет важную регуляторную роль в образовании жирных кислот.
Регуляция β-окисления и его влияние на кетогенез
Питание организмов регулирует сложный набор гормональных сигналов. Углеводы, аминокислоты и липиды, потребляемые в рационе, откладываются в форме триацилглицеринов в жировой ткани. Инсулин, анаболический гормон, участвует в синтезе липидов и образовании триацилглицеринов.
На уровне митохондрий β-окисление контролируется поступлением и участием некоторых субстратов в митохондриях. Фермент CPT I синтезирует ацилкарнитин из цитозольного ацил-КоА.
Когда организм питается, активируется ацетил-КоА-карбоксилаза, и цитрат повышает уровень СРТ I, а его фосфорилирование уменьшается (циклическая АМФ-зависимая реакция).
Это вызывает накопление малонил-КоА, который стимулирует синтез жирных кислот и блокирует их окисление, предотвращая образование бесполезного цикла..
В случае голодания активность карбоксилазы очень низка, так как уровни фермента СРТ I были снижены, и он был фосфорилирован, активируя и стимулируя окисление липидов, что впоследствии позволит образованию кетоновых тел через ацетил-КоА.
деградация
Кетоновые тела диффундируют из клеток, где они синтезируются и транспортируются кровью в периферические ткани. В этих тканях они могут окисляться через цикл трикарбоновых кислот.
В периферических тканях β-гидроксибутират окисляется до ацетоацетата. Впоследствии настоящий ацетоацетат активируется ферментом 3-кетоацил-КоА-трансферазой.
Сукцинил-КоА действует как донор КоА, становясь сукцинатом. Активация ацетоацетата происходит, чтобы предотвратить превращение сукцинил-КоА в сукцинат в цикле лимонной кислоты при сопряженном синтезе ГТФ под действием сукцинил-КоА-синтазы..
Полученный ацетоацетил-КоА подвергается тиолитическому расщеплению с образованием двух молекул ацетил-КоА, которые включаются в цикл трикарбоновых кислот, более известный как цикл Кребса..
В клетках печени отсутствует 3-кетоацил-КоА-трансфераза, предотвращающая активацию этого метаболита в этих клетках. Таким образом, гарантируется, что кетоновые тела не окисляются в клетках, где они были произведены, но что они могут переноситься в ткани, где требуется их активность..
Медицинская значимость кетоновых тел
В организме человека высокие концентрации кетоновых тел в крови могут вызывать особые состояния, называемые ацидозом и кетонемией..
Производство этих метаболитов соответствует катаболизму жирных кислот и углеводов. Одной из наиболее распространенных причин патологического состояния кетогенеза является высокая концентрация фрагментов дикарбоната уксусной кислоты, которые не разлагаются путем окисления трикарбоновых кислот..
Вследствие этого наблюдается повышение уровня кетоновых тел в крови выше 2-4 мг / 100 Н и их присутствие в моче. Это приводит к нарушению промежуточного метаболизма указанных метаболитов..
Определенные дефекты нейрогландулярных факторов гипофиза, которые регулируют деградацию и синтез кетоновых тел, наряду с нарушениями метаболизма углеводородов, являются причиной состояния гиперцетонемии..
Сахарный диабет и накопление кетоновых тел
Сахарный диабет (тип 1) является эндокринным заболеванием, вызывающим увеличение выработки кетоновых тел. Недостаточное производство инсулина препятствует транспорту глюкозы в мышцы, печень и жировую ткань, накапливаясь в крови.
Клетки в отсутствие глюкозы начинают процесс глюконеогенеза и распада жиров и белков для восстановления их метаболизма. Как следствие, концентрация оксалоацетата снижается, а окисление липидов увеличивается..
Затем происходит накопление ацетил-КоА, которое в отсутствие оксалоацетата не может следовать по пути лимонной кислоты, вызывая высокую выработку кетоновых тел, характерных для этого заболевания..
Накопление ацетона определяется его присутствием в моче и дыхании людей, которые имеют это состояние, и на самом деле является одним из симптомов, которые указывают на проявление этого заболевания.
Синдром гиперкетонемии у детей и подростков: патогенез, причины, диагностика
В статье представлены современные данные о физиологии энергетического обмена и роли в нем кетоновых тел. Рассмотрены основные причины избыточного образования кетонов, методы диагностики, подходы к лечению.
The article presents modern data on the physiology of energy metabolism and the role of ketone bodies in it. The main causes of excessive ketone formation, diagnostic methods, approaches to treatment are considered.
Часть 1
Кетоновые тела (ацетоновые тела) — группа органических соединений, являющихся промежуточными продуктами обмена углеводов, жиров, белков. Кетокислоты — это продукт метаболизма ацетил-коэнзима А (ацетил-КоА), который при дефиците пищи образуется либо из собственных белков, либо из жира. К кетоновым телам относятся β-оксимасляная кислота (β-оксибутират), ацетоуксусная кислота (ацетоацетат) и ацетон.
Физиология энергетического обмена
Кетоновые тела синтезируются в основном в митохондриях печеночных клеток из ацетил-КоА, который объединяет несколько ключевых метаболических процессов клетки. Главная функция ацетил-КоА — доставлять атомы углерода с ацетил-группой в цикл трикарбоновых кислот (ЦТК, цикл Кребса), чтобы те были окислены с выделением энергии. Содержание ацетил-КоА определяет направление клеточного метаболизма в данный момент: будет ли происходить синтез и накопление гликогена, жира и синтез белков или, наоборот, будут расходоваться ранее накопленные энергозапасы в организме.
Образование кетоновых тел является физиологическим процессом и необходимой частью энергетического обмена. В процессе этого обмена происходит «сгорание» и взаимотрансформация углеводов, белков, жиров и других энергосубстратов с образованием энергии, которая либо превращается в тепло, либо аккумулируется в виде аденозинтрифосфата (АТФ).
В условиях дефицита энергии в организме воссоздание энергетических запасов возможно за счет активации глюконеогенеза или синтеза кетоновых тел (кетогенез).
Кетоновые тела играют важную роль в поддержании энергетического баланса организма, а активация кетогенеза является более целесообразной и оптимальной для организма в этих условиях. Кетоновые тела не только сохраняют структурные белки организма, угнетая секрецию и действие глюкагона — мощного стимулятора глюконеогенеза, но и по механизму обратной связи регулируют и ограничивают интенсивность кетогенеза [1].
Глюконеогенез — это метаболический путь биосинтеза глюкозы из не углеводных предшественников, активный в печени, почках, тонком кишечнике. Когда запасы гликогена в организме исчерпываются, печень переходит на синтез его путем глюконеогенеза. Субстратами глюконеогенеза являются: пировиноградная кислота (пируват), молочная кислота (лактат), глицерол, глюкогенные аминокислоты, жирные кислоты.
Трансформация пировиноградной кислоты возможна двумя путями — аэробным или анаэробным. Гликолиз, или путь Эмбдема–Мейергофа, — основной путь утилизации глюкозы в клетках. Одна молекула глюкозы превращается при этом в две молекулы пировиноградной кислоты. Превращение пирувата в ацетил-КоА происходит при участии набора ферментов, структурно объединенных в пируватдегидрогиназный комплекс (ПДК).
При аэробных условиях пируват проникает в митохондрии. Образованный ацетил-КоА в цикле Кребса окисляется до СО2 и Н2О. Основная часть глюкозы расходуется на синтез АТФ в процессе окислительного фосфорилирования.
Если содержание кислорода недостаточно, как это может быть в скелетных мышцах при интенсивной физической нагрузке или в тканях, где нет или очень мало митохондрий (эритроциты, белые мышцы, клетки сетчатки глаза, мозгового слоя коры надпочечников), гликолиз является конечным энергетическим процессом, в результате которого пируват преобразуется в лактат, а последний в продукт анаэробного гликолиза. Он образуется при любых состояниях организма в эритроцитах и работающих мышцах. Избыток лактата поступает в печень, где из него вновь синтезируется глюкоза (глюконеогенез). Таким образом, лактат используется в глюконеогенезе постоянно.
При мышечной работе глюкоза в миоците используется не только на энергетические нужды, но и на обеспечение постоянного притока оксалоацетата в ЦТК. При этом с увеличением продолжительности нагрузки «энергетическая» роль глюкозы снижается [2].
Ацетил-КоА является ключевым метаболитом липидного обмена. Он образуется при β-окислении жирных кислот в митохондриях печени. В матриксе митохондрий печеночных клеток происходит окисление жирных кислот в цикле Кноппа–Линена. Ключевым участником этого процесса является L-карнитин, который транспортирует длинноцепочечные жирные кислоты в митохондрии через внутреннюю мембрану последних. Этот процесс является инсулинозависимым. В норме цитрат образуется путем конденсации оксалоацетата и ацетил-КоА с участием фермента цитрат-синтетазы.
Аминокислоты (лейцин, тирозин, фенилаланин), образующиеся в результате распада мышечных белков, включаются в глюконеогенез при длительном голодании или продолжительной мышечной работе. В процессе катаболизма они превращаются в ацетоацетат и могут использоваться в синтезе кетоновых тел.
Включение лактата, глицерола и аминокислот в глюконеогенез зависит от физиологического состояния организма. При окислении одной молекулы β-оксибутирата образуется СО2 и Н2О и обеспечивается синтез 27 молекул АТФ.
Биологическая роль кетоновых тел
Кетоновые тела играют важную роль в поддержании энергетического баланса. Образовавшиеся ацетоновые тела поступают из гепатоцитов в кровь и разносятся к клеткам различных органов. Ацетоновые тела в норме достаточно хорошо утилизируются клетками периферических тканей, в особенности это касается скелетных мышц и миокарда, которые значительную часть нужной им энергии получают за счет окисления ацетоновых тел. Основным путем активации ацетоацетата в клетках является путь с участием тиафоразы. В гепатоцитах нет этого фермента. Именно поэтому образовавшийся в гепатоцитах ацетоацетат в них не активируется и не окисляется, тем самым создаются условия для «экспорта» ацетоацетата из гепатоцитов в кровь.
У здоровых при усилении липолиза увеличивается скорость утилизации кетоновых тел, которые являются важными источниками энергии при мышечной работе, голодании. Скелетные мышцы и почки используют кетоновые тела даже при их низкой концентрации в крови. Лишь клетки центральной нервной системы в обычных условиях практически не утилизируют ацетоновые тела [3].
Кетоновые тела это часть метаболического регулярного механизма для предотвращения излишней мобилизации жирных кислот и сдерживания протеолиза, что сберегает структурные белки организма. В норме кетоновые тела стимулируют выход инсулина из поджелудочной железы, что угнетает липолиз и таким образом ограничивает доставку липидов в печень и соответственно кетогенез. Во время голодания кетоновые тела являются одним из основных источников энергии для мозга [4]. В норме процессы синтеза и использования кетоновых тел уравновешены. Концентрация кетоновых тел в крови и в тканях обычно очень низка, поэтому содержание кетоновых кислот в плазме крови в норме присутствует в крайне низких количествах и составляет 0,1–0,3 ммоль (0,03–0,2 ммоль/л по ацетону).
Наличие кетоновых тел в моче всегда указывает на развитие патологического состояния в организме. Кетоновые тела удаляются с мочой в различных количествах: ацетон — 3–4%, ацетоуксусная кислота — 30–40%, β-гидроксимасляная — 60–70%.
Лабораторные тесты, выявляющие кетонурию, основаны на реакциях с ацетоацетатом и ацетоном, так как они не реагируют с β-оксибутиратом. Для качественного определения содержания кетоновых тел в моче используют цветные пробы Ланге, Легаля, Лестраде, Герхарда. Количество ацетоацетата в анализе мочи измеряют в плюсах (от одного + до четырех ++++). Присутствие +++ соответствует повышению уровня кетоновых тел в 400 раз, ++++ — в 600 раз. Физиологический кетоз может выявляться при голодании, тяжелой мышечной работе, у новорожденных [5].
Причины избыточного кетоза
Возникающая в патологических условиях гиперкетонемия связана с диссоциацией кетогенеза в печени и утилизацией кетоновых тел в других органах, то есть либо скорость синтеза кетоновых тел в печени превышает скорость их утилизации периферическими тканями организма, либо нарушена утилизации их как источника энергии в других органах.
Повышение содержания кетоновых тел в организме прежде всего вызывается дефицитом углеводов для обеспечения организма энергией, перегрузкой белками и жирами на фоне недостатка легкоперевариваемых углеводов в рационе, истощением организма, ожирением, нарушением эндокринной регуляции (сахарный диабет, тиреотоксикоз и др.), отравлением, травмами черепа и т. д. [4].
Интенсивное образование кетоновых тел происходит также при наличии дефицита оксалоацетата, так как последний является основным регулятором ЦТК. Обычно в клетке имеется баланс между образованием ацетил-КоА (из глюкозы, жирных кислот или аминокислот) и количеством оксалоацетата. Источником оксалоацетата является глюкоза (синтез из пирувата), поступление из фруктовых кислот самого цикла (яблочной, лимонной), образование из аспарагиновой кислоты. При недостаточном количестве оксалоацетата в плазме крови, наблюдаемом при патологических состояниях, концентрация кетоновых тел может значительно повышаться. Не успевая окисляться и представляя собой достаточно сильные органические кислоты, они вызывают развитие метаболического кетоацидоза.
Стимуляция кетогенеза при дефиците пищи, стрессе, длительной рвоте является компенсаторным процессом, в ходе которого восполняется энергетический дефицит за счет кетокислот.
Гиперкетонемия со сдвигом рН в кислую сторону может наблюдаться при угнетении цикла Кребса, в котором происходит «сгорание» кетоновых тел.
Скорость образования кетоновых тел зависит и от скорости окисления жирных кислот в печени, а процесс окисления ускоряется при усилении липолиза (распада жира) в жировой ткани. Интенсивное образование кетокислот происходит также при приеме с пищей так называемых кетогенных аминокислот (лейцина, тирозина, фенилаланина, изолейцина), некоторых белков и большого количества жиров [5].
При умеренном кетозе в крови циркулируют главным образом ацетоацетат и β-оксибутират. Ацетон образуется только при высоких концентрациях кетоновых тел и преимущественно удаляется через легкие.
Однако в экстремальных условиях из кетоновых тел с помощью глюконеогенеза может синтезироваться глюкоза, служащая источником энергии для работы центральной нервной системы.
Ацетоновые тела, накапливаясь в крови и тканях, оказывают ингибирующее действие на липолиз, в особенности это касается расщепления триглицеридов в адипоцитах. Снижение уровня липолиза в клетках жировой ткани приводит к уменьшению притока высших жирных кислот в гепатоциты и к снижению скорости образования ацетоновых тел и, следовательно, снижению их содержания в крови.
При дефиците энергии в результате изменения гормонального статуса и действия внутриклеточных механизмов регуляции нарастает скорость мобилизации жиров и усиливается глюконеогенез из аминокислот и глицерина. Липолиз активируется глюкагоном, адреналином. Длительная стимуляция кетогенеза или нарушение процессов кетолизиса приводят к изменению буферной емкости крови, а при содержании в чрезмерно высоких концентрациях кетоновых тел крови возникает угрожающий жизни декомпенсированный кетоацидоз.
Такая картина характерна при тяжелом течении сахарного диабета 1-го типа, гипогликемии, длительном голодании, стрессах различной этиологии, заболеваниях печени, тяжелой и длительной мышечной работе [6].
Кетоновые тела являются водорастворимыми кислотами, поэтому, в отличие от жирных кислот, они могут проходить через гематоэнцефалический барьер и служат, наряду с глюкозой, источником энергии для нервной ткани, особенно после 3–5 дней голодания, когда концентрация кетоновых тел в крови существенно увеличивается.
Сахарный диабет
Сахарный диабет 1-го типа является самой частой причиной кетоза и кетоацидоза. Ведущую роль в патогенезе кетоацидоза играет абсолютная инсулиновая недостаточность, приводящая к снижению утилизации глюкозы инсулинзависимыми тканями и, соответственно, гипергликемии и тяжелому энергетическому голоду в них. Инсулин влияет на все виды обмена. Дефицит инсулина при сахарном диабете является причиной резкого повышения в крови уровня всех контринсулярных гормонов (глюкагона, кортизола, катехоламинов, тироксина и др.). Они стимулируют мобилизацию липидов из жировых депо и доставку жирных кислот к органам, что является адаптивным механизмом, поставляющим альтернативный субстрат окисления в условиях снижения утилизации глюкозы клетками. Снижается активность липопротеинлипазы (ЛП-липазы) адипоцитов, поэтому свободные жирные кислоты не поступают в жировую ткань. Начинает преобладать эффект глюкагона, стимулирующий кетогенез в печени и гормончувствительную триацилглицерол-липазу (ТАГ-липазу) в адипоцитах.
При сахарном диабете в избыточном количестве начинает образовываться продукт β-окисления жирных кислот — ацетил-КоА. Однако способность цикла Кребса утилизировать данный продукт существенно снижена, так как β-окисление свободных жирных кислот в митохондриях зависит от их транспорта через мембрану митохондрий. А этот процесс является инсулинозависимым.
Если он затруднен, то жирные кислоты быстро превращаются в ацил-КоА, из которого образуется ацетил-КоА. Цикл Кребса и ресинтез жирных кислот не в состоянии полностью использовать избыточно образующийся ацетил-КоА, тем более что цитратный цикл тормозится этим избытком. В норме цитрат образуется путем конденсации оксалоацетата и ацетил-КоА с участием фермента цитрат-синтетазы. Активность последней при декомпенсации диабета снижена, в частности, из-за ингибирующего влияния АТФ, образующейся в избытке при окислении жирных кислот.
Уменьшено и образование оксалоацетата, так как в результате усиленного окисления свободных жирных кислот и повышенного глюконеогенеза увеличивается соотношение NADH/NAD+. Это ведет к недостаточному образованию цитрата и накоплению ацетил-КоА.
Этому процессу способствует увеличение содержания в печени карнитина (особенно в условиях активации эффектов глюкагона). Карнитин стимулирует транспорт жирных кислот в митохондрии клеток печени, где они подвергаются β-окислению, значительно ускоряя кетогенез.
В результате избыток ацетил-КоА становится источником образования больших количеств кетоновых тел: β-оксимасляной, ацетоуксусной кислот и ацетона.
У больных сахарным диабетом 1-го типа нарушается белковый обмен, который характеризуется преобладанием процессов катаболизма в результате активации процесса глюконеогенеза из глюкогенных аминокислот и снижения проницаемости клеточных мембран для аминокислот, что приводит к недостатку в тканях свободных аминокислот и нарушению процесса синтеза белка [6].
Гипоксия тканей вызывает активацию анаэробного гликолиза и повышение содержания лактата, который не может быть утилизирован в результате дефицита лактатдегидрогеназы на фоне дефицита инсулина. Это усугубляет нарушение кислотно-щелочного баланса организма и приводит к возникновению лактоацидоза.
Активное нарастание содержания кетоновых тел при декомпенсации сахарного диабета связано не только с усиленной продукцией, но со сниженной периферической утилизацией. При избыточном накоплении кетоновых тел буферная способность крови быстро истощается, что приводит к развитию декомпенсированного метаболического кетоацидоза. Кетоновые тела начинают выделяться с мочой в виде натриевых солей, а ацетон — также и в составе выдыхаемого воздуха.
Следствием увеличения концентрации ацетоацетата является ускорение образования ацетона, который обладает токсическим свойством. Он растворяется в липидных компонентах клеточных мембран и дезорганизует их. Страдают все ткани организма, а больше всего — клетки нервной ткани. Нарушается работа многих ферментативных систем. Это может проявляться потерей сознания [7].
При сахарном диабете 2-го типа сохраняется минимальная продукция инсулина, что объясняет редкость развития липолиза и состояния кетоацидоза и кетоацидотической комы при нарастании гипергликемии.
Гипогликемия и гипогликемические состояния
Кетотическая гипогликемия является самой частой причиной низкой концентрации глюкозы в крови. Стимуляция кетогенеза в условиях синдрома гипогликемии связана с активацией процессов липолиза при тяжелом энергетическом голоде. По мере истощения запасов гликогена в печени повышается содержание глюкагона, адреналина, норадреналина, кортизола, гормона роста, которые стимулируют глюконеогенез [8, 9].
Из жировой ткани интенсивно метаболизируются жирные кислоты для обеспечения источника энергии для мышечной деятельности и доступной глюкозы для центральной нервной системы. Жирные кислоты окисляются в печени с образованием кетоновых тел — ацетоацетата и β-оксибутирата.
Гипогликемии при дефиците ферментов
Нарушения обмена гликогена, связанные с его патологическим депонированием, проявляются гликогеновыми болезнями. Это группа наследственных нарушений, в основе которых лежит снижение или отсутствие активности ферментов, катализирующих реакции синтеза (агликогенозы) или распада гликогена (гликогенозы).
Дефект фермента глюкозо-6-фосфатазы (болезнь Гирке). Первичное нарушение при болезни Гирке (гликогеноз 1-го типа) происходит на генетическом уровне. Оно состоит в полной или почти полной неспособности клеток продуцировать глюкозо-6-фосфатазу, обеспечивающую отщепление свободной глюкозы от глюкозо-6-фосфата. В результате этого гликогенолиз прерывается на уровне глюкозо-6-фосфата и дальше не идет. Дефосфорилирование с участием глюкозо-6-фосфатазы является ключевой реакцией не только гликогенолиза, но и глюконеогенеза, который, таким образом, при болезни Гирке также прерывается на уровне глюкозо-6-фосфата.
Возникновение устойчивой гипогликемии, которая в реальных условиях неизбежна из-за непоступления в кровь глюкозы как конечного продукта гликогенолиза и глюконеогенеза, в свою очередь приводит к постоянной повышенной секреции глюкагона как стимулятора гликогенолиза. Глюкагон, однако, в условиях прерывания этого процесса способен лишь без пользы для организма непрерывно стимулировать его начальные стадии.
Психическое и соматическое развитие, а также биохимический статус (повышение уровня триглицеридов, холестерина, гиперурикемия, гипофосфатемия) у этих больных резко нарушены. Содержание глюкозы в плазме натощак постоянно снижено, в связи с чем даже при кратковременном голодании развиваются гипогликемические судороги, кетонурия и метаболический ацидоз. Последний обусловлен не только гиперкетонемией, но и повышенным накоплением и образованием в крови пирувата и лактата, что является результатом нарушенного глюконеогенеза. Характерными чертами заболевания являются: олигофрения, задержка роста, ожирение, остеопороз, большой живот (следствие увеличения печени и почек), ксантоматоз, липемия сетчатки, геморрагический диатез.
Диагноз основывается на данных клинической картины, сниженного содержания глюкозы и повышенной концентрации липидов и лактата в крови. Уровень глюкозы в плазме практически не меняется после введения глюкагона. Однако содержание лактата в крови после его введения возрастает. Биопсия печени, специальные гистохимические методы подтверждают недостаточность соответствующих ферментов [10].
Некоторые гипоталамо-гипофизарные синдромы могут сопровождаться гипогликемией: синдром Лоренса–Муна–Бидля–Борде, синдром Дебре–Мари, синдром Пехкранца–Бабинского (адипозогенитальная дистрофия).
Синдром Лоренса–Муна–Бидля–Борде характеризуется ожирением, гипогонадизмом, умственной отсталостью, дегенерацией сетчатки, полидактилией, глубокими дегенеративными изменениями гипоталамо-гипофизарной системы.
Синдром Дебре–Мари — заболевание обусловлено гиперфункцией задней доли гипофиза и гипофункцией аденогипофиза. Проявляется в раннем детском возрасте. Больные инфантильны, низкорослы, с избыточной массой. В клинической картине типично нарушение водного обмена с олигурией и олигодипсией, плотность мочи высокая. Психическое развитие не нарушено.
Синдром Пехкранца–Бабинского — причиной заболевания считают органические и воспалительные изменения гипоталамуса, которые ведут к ожирению, аномалиям развития скелета и гипоплазии половых органов.
Ожирение
Бурное нарастание ожирения во всех возрастных группах людей в большей степени связано с изменением образа жизни: снижение двигательной активности (компьютеризация, автомобилизация, урбанизация), изменения характера питания (переедание) и т. д. Избыточное поступление энергии или снижение ее затраты приводит к увеличению массы тела и развитию ожирения.
Жировая ткань обладает высокой метаболической активностью. В ней непрерывно совершаются интенсивные процессы обмена веществ, такие как синтез и гидролиз липидов, синтез жирных кислот, в том числе из углеводов, их этерификация в триглицериды или нейтральный жир, депонирование и расщепление их с образованием жирных кислот, использование последних для энергетических целей.
Ожирение приводит к значительным метаболическим и обменным нарушениям. Они характеризуются гиперинсулинизмом и нарушением толерантности к глюкозе; инсулинорезистентностью, вызываемой нарушением инсулинорецепторных взаимоотношений; увеличением содержания свободных жирных кислот в крови, склонностью к кетогенезу при голодании и к гипертриглицеридемии. При ожирении понижается активность липолитических ферментов в жировой ткани: липазы триглицеридов, что приводит к их накоплению, и липопротеинлипазы. Расщепление липопротеидов снижается. Гипертрофированные адипоциты слабее, чем гиперплазированные, реагируют на адреналин, норадреналин и другие липолитические вещества [11].
Важным проявлением нарушения межуточного обмена при ожирении является кетоз, связанный с повышенным липолизом, избыточным поступлением свободных жирных кислот в печень. Скорость реакции в ЦТК снижена, так как оксалоацетат используется для глюконеогенеза. В результате скорость образования ацетил-КоА превышает способность ЦТК окислять его. Ацетил-КоА используется для синтеза кетоновых тел. Из-за избытка кетоновых тел нарушается их утилизация.
Этому способствует наблюдающаяся гипогликемия, гиперлипидемия, кетонемия при применении длительной гипокалорийной диеты. А сопутствующий дефицит углеводов тормозит использование ацетил-КоА в цикле Кребса. При дефиците углеводов в организме возникает недостаток энергии в клетках. Усиливается липолиз [12].
Избыток неэстерифицированных жирных кислот, поступающих в печень, вызывает развитие жировой инфильтрации в ней, что нарушает окисление и выведение липопротеидов из печени, обуславливая накопление кетоновых тел. Для эффективного использования продуктов распада жира необходимы продукты углеводного обмена — жиры «сгорают» в пламени углеводов.
Окончание статьи читайте в следующем номере.
ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва