что внутри атома и дальше
Атомы: строительные блоки молекул
Если молекулы – основные структуры, задействованные в химии – это слова, из которых состоят все окружающие нас материалы, тогда атомы – это буквы, строительные блоки молекул. Слова бывают разной длины, и типичная молекула тоже может содержать несколько атомов, или несколько сотен, или даже сто тысяч атомов. Молекула столовой соли NaCl состоит из двух атомов, натрия Na и хлора Cl. Молекула воды H2O содержит два атома водорода и один кислорода. Молекула столового сахара C12H22O11 содержит 12 атомов углерода, 11 кислорода и 22 водорода, организованных определённым образом.
Откуда нам известно о существовании атомов? Иногда их можно «видеть», так же, как мы видим молекулы, которые они могут формировать. Не глазами, но более продвинутыми устройствами. Один из методов использует сканирующий туннельный микроскоп, способный показывать атомы в кристалле или даже передвигать их по одному. Другой метод использует нашу возможность захвата ионов (немного изменённых атомов – подробности ниже).
На фото – три иона, пойманных одновременно. На них падает свет, они поглощают его и снова испускают. Повторно испущенный свет можно обнаружить, благодаря чему мы можем увидеть, где находятся ионы – примерно так отражение света от небольшого, но яркого бриллианта может помочь нам найти его.
Сколько же типов атомов существует? Типы называются «химическими элементами» и точное их количество зависит от того, как их считать. Но допустим, что атомный алфавит состоит из примерно сотни химических элементов, а к тонкостям подсчёта вернёмся позже. Так же, как мы могли назначить буквам алфавита от А до Я номера от 1 до 33, каждому элементу назначается не только имя, но и атомный номер (обозначается «Z»). Самые простые атомы – у водорода, их атомный номер = 1. Самые сложные в изобилии встречаются в природе, это уран с атомным номером 92. Другие – кислород (8), азот (7), кальций (20), криптон (36), лантан (57), платина (78). Полный список ищите в периодической системе элементов Менделеева. У каждого элемента своя химия – то, как он ведёт себя внутри молекул – примерно так, как у каждой буквы есть свои правила, по которым она может встречаться в словах.
Вопросы, которые можно задать об атомах:
1. Из чего состоят атомы?
2. В чём смысл атомного номера?
3. Каков главный источник различий в химическом поведении атомов разных элементов?
4. До какой степени разные атомы одного элемента схожи между собой?
5. Как части атома удерживаются вместе?
6. Почему атомы удерживаются вместе и образуют молекулы?
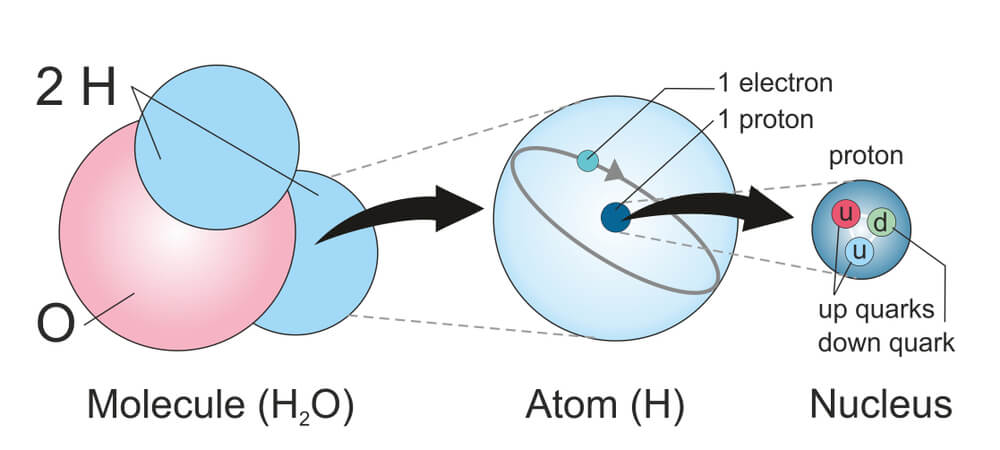
Оказывается, на все эти вопросы лучше всего отвечать, начав с первого: из чего состоят атомы? Атомы состоят из того, что обычно называют «субатомными частицами» (к сожалению, этот термин некорректен, поскольку у этих «частиц» есть некоторые свойства, частицам не присущие). Конкретнее, атомы состоят из набора небольших и очень лёгких электронов, окружающих крохотное, но тяжёлое атомное ядро, в котором содержится большая часть массы атома. Ядро состоит из других «частиц», в свою очередь также состоящих из других «частиц», и мы до них ещё доберёмся.
Рисованный атом
Частенько мы видим изображения атомов, нарисованные на книгах по химии, на рекламках и предупреждающих знаках. Пример – рис. 1. Он передаёт очень грубую идею того, как устроен атом: снаружи у него есть определённое количество электронов (синие), и они вращаются вокруг центрального атомного ядра. Ядро – это скопление протонов (красные) и нейтронов (белые).
Теперь мы можем ответить на 2-й вопрос: что означает атомное число Z? Это просто количество протонов в ядре. У кислорода атомный номер 8, и у него в ядре 8 протонов.
В простейших условиях атомное число также равняется количеству электронов атома. С количеством нейтронов всё сложнее, мы вернёмся к этому позже. У электронов отрицательный электрический заряд (-е), а у протонов – положительный (+е). Нейтроны нейтральны, электрического заряда у них нет. Когда количество электронов и протонов совпадает, их заряды взаимно уничтожаются, и у атома электрического заряда не наблюдается – такой атом нейтрален.
Но нет ничего необычного – к примеру, в процессе формирования молекул – если атом приобретёт или потеряет один или несколько внешних, валентных электронов. В этом случае электрические заряды электронов и протонов не уничтожаются, и получившийся заряженный атом называют ионом.
Более реалистичный атом
Хотя рис. 1 примерно описывает архитектуру атома – электроны действительно находятся снаружи, а ядро, состоящее из протонов и нейтронов, в середине – он совершенно не передаёт реальную форму и суть атома, поскольку он выполнен не в масштабе, а мы живём в квантовом мире, в котором объекты ведут себя так, что их сложно нарисовать или представить.
С проблемой масштаба можно разобраться, нарисовав более точное (хотя всё ещё несовершенное) изображение, рис. 2.

Рис 2. Атом – по большей части пуст (серая область). По нему быстро движутся электроны (голубые точки, нарисованы не в масштабе, а гораздо больше). В центре находится тяжёлое ядро (красные и белые точки, нарисованы больше, чем в масштабе).
Вот, что я попытался передать этим изображением. Во-первых, электроны очень, очень малы, настолько малы, что мы так и не смогли измерить их размер – может статься, что они точечные и не имеют размера, но они точно не больше, чем 1/100 000 000 от диаметра атома. Во-вторых, ядра (и протоны с нейтронами, их составляющие) также крайне малы, хотя они и больше, чем электроны. Их размер измерен, и он примерно в 10 000 – 100 000 раз меньше диаметра атома. Атом немного похож на деревню. Протоны и нейтроны в ядре – большие дома, находящиеся в центре деревни, а электроны – далеко разбросанные фермерские домики. На большей части сельской местности растут зерновые культуры и нет домов. И хотя территория, считающаяся частью деревни, может быть большой, реально занимаемая домами площадь очень мала.
Но эта аналогия не полная, поскольку электроны, в отличие от фермерских домиков, очень быстро двигаются по серому региону на картинке и вокруг ядра со скоростями порядка 1% от скорости света. Покрываемая ими территория обычно не сферическая, а более сложной формы, кроме того не все электроны перемещаются по одной и той же территории.
Но, как я вас предупреждал, рис. 2 тоже не точный. Во-первых, нужно было бы нарисовать ядро в тысячи раз меньше, а электроны – в миллионы раз меньше, только тогда их не было бы видно. Если бы атом был размером с вашу спальню, то его ядро было бы размером с пылинку. По сравнению со своими компонентами, атомы огромны! В каком-то смысле большую часть атома составляет пустота!
Во-вторых, изображение не передаёт мутную природу квантовой механики. Уравнения квантовой механики описывают и предсказывают поведение молекул, атомов и субатомных частиц, и эти уравнения говорят нам, что у этих частиц могут быть очень странные и неинтуитивные свойства. Хотя электроны в каком-то смысле точечные (допустим, если вы захотите столкнуть два электрона друг с другом, то обнаружите, что можете сдвинуть их вместе на сколь угодно малое расстояние, и они ничем не выдадут своей внутренней структуры, если она вообще есть), есть возможность сделать так, что они, будучи оставленными в покое, будут распространяться как волна и заполнят всё серое пространство на рис. 2. Если это звучит странно, это не оттого, что вы чего-то не поняли: это странно и об этом тяжело думать. Я-то уж точно не знаю, как нарисовать атом, чтобы не вводить вас в заблуждение, и эксперты всё ещё спорят о том, как лучше всего о нём думать. Так что пока просто примите это как странный факт.
Размер электрона слишком мал для измерения, и его масса настолько мала, что электрон может распространиться по всему атому. А вот у ядра есть вполне измеренный и известный размер, а его масса так велика – больше 99,9% массы всего атома – что оно вообще не распределяется в пространстве. Ядро сидит в середине серой области.
Атом и его химия
Лучший приходящий мне в голову способ описать атом: большая часть массы атома содержится в ядре, находящемся в его центре, вокруг которого распределились чрезвычайно мелкие электроны гораздо меньшей массы, причём сделали это совершенно не так, как ведут себя частицы, заполнив всю серую область рис. 2.
Небольшой размер ядра по отношению к полному размеру атома, и то, что оно обычно находится в его центре, объясняет, почему оно играет относительно слабую роль в химии. Химия происходит – то есть, формируются и меняются молекулы – когда атомы приближаются друг к другу, а это происходит, когда внешние, валентные электроны одного атома близко подходят к внешним электронам другого – когда край серой области одного атома приближается к краю серой области другого. В химических процессах атомное ядро остаётся в центрах атомов, и никогда не приближается к другим ядрам. Основная роль ядра – обеспечение положительного заряда, удерживающего электроны, и большей части массы (определяющей, как сложно другим объектам передвигать этот атом).
Это отвечает на 3-й вопрос: химию атома в основном определяют подробности, связанные с его внешними электронами. Эти детали можно узнать (сложным способом, через уравнения квантовой механики), исходя из атомного номера Z.
Вместо того, чтобы заняться химией – темой, которой хватит на целый курс – мы перейдём на уровень ниже, к субатомным частицам, по пути отвечая на другие вопросы. Перечислим вопросы, с которыми мы разобрались, и вопросы, которые ещё предстоит изучить.
1. Из чего состоят атомы? Снаружи – электроны, в центре – атомное ядро (из протонов и нейтронов).
2. В чём смысл атомного номера? Это количество протонов в ядре атома, которое, в обычных условиях равно количеству электронов, его окружающих.
3. Каков главный источник различий в химическом поведении атомов разных элементов? Свойства внешних электронов, определяемые общим количеством электронов у каждого элемента, к примеру, атомным номером.
4. До какой степени разные атомы одного элемента схожи между собой? Обсудим это в статье про изотопы.
5. Как части атома удерживаются вместе? Обсудим это в статье о роли электрических сил и квантовой механики.
6. Почему атомы удерживаются вместе и образуют молекулы? Обсудим это в статье о роли электронов и электрических сил в построении молекул из атомов.
А вот вам ещё вопрос, который мог возникнуть при изучении рис. 2:
Если атом – по большей части пуст, почему объекты кажутся твёрдыми? Почему нельзя протянуть руку через экран компьютера, если экран состоит из атомов, по большей части пустых?
Что находится внутри атомного ядра?
Большая часть массы атома сосредоточена в его ядре. Ядро атома окружено чрезвычайно маленькими и легкими электронами, которые вращаются в атоме, но не нарушают значительного пустого пространства между ядром и границами атома. Чтобы получить четкое изображение ядра атома, нужно сначала знать, что происходит с электронами и остальной частью атома.
Электроны вокруг ядра атома
Электроны имеют свои специфические орбиты, а именно: S, P, D, F, а затем G. Каждая орбита представляет собой сферическую оболочку, и имена выводятся из спектра испускаемого света из этих оболочек, описывающих характер спектральных линий. Другой факт об электронах заключается в том, что они находятся везде, что позволяют квантовые законы.
Электроны вращаются вокруг плотного ядра атома в облаках отрицательного заряда.
В атоме углерода, например, шесть электронов. Два из них занимают сферическую оболочку в центре атома, а остальные четыре распределены в смеси сферических оболочек и трехлопастных оболочек. Таким образом, ядро окружено чем-то вроде облаков отрицательного заряда, а электроны находятся везде, где только могут быть, но не заполняют пустые пространства. Электроны помогают создавать молекулы.
Электронные связи между атомами
Если два атома углерода подходят достаточно близко, их ближайшие электроны взаимодействуют и образуют одинарную связь. Эта связь в химии называется сигма-связью. Затем облака изгибаются и соединяются, создавая «Пи-связь», которая выглядит как деревья, соединяющие верхние ветви над улицей.
Связи становятся все более и более сложными в различных ситуациях, и это выходит за рамки данной статьи. Тем не менее одна вещь остается постоянной во всех этих связях: электроны все еще рассеяны в относительно огромном облаке вокруг очень плотного ядра, и там все еще много пустого пространства. Электрические поля и электронные облака удерживают эту огромную пустоту вместе. Что же тогда находится внутри ядра атома?
Протоны и нейтроны
Внутри протонов и нейтронов
В 1950-х годах наука поняла, что протоны и нейтроны состоят из более мелких частиц. Несколько лет спустя, в 1964 году, американский физик Мюррей Гелл-Манн представил кварки. Он не знал, сколько типов кварков существует, но сегодня открыто по крайней мере шесть кварков: верхний (символ u α ), нижний (символ d α ), странный (символ s α ), очарованный (символ c α ), красивый (символ b α ) и истинный (символ t α ).
Если рассматривать протон как баскетбольный мяч, каждый кварк будет меньше песчинки. Следовательно, большая часть протона и нейтрона также является пустым пространством, в то время как кварки перемещаются со скоростью, близкой к скорости света.
Маленькие ядра удерживают частицы настолько малы, что наше самое мощное и самое точное оборудование не может их видеть. В то же время они обладают самой сильной силой, когда-либо существовавшей в пустых пространствах и сверхмалых частицах, называемых кварками.
Общие вопросы об атомном ядре
Вопрос: Что находится в ядре атома?
Ядро атома состоит из протонов и нейтронов. Протоны несут положительный заряд, равный электронам, вращающимся вокруг, а нейтроны не несут заряда, но весят столько же, сколько протоны.
Вопрос: Какова функция ядра атома?
Ядро атома создает силу, необходимую для того, чтобы держать атом вместе и в порядке. Это самая тяжелая часть атома и очень плотная. Размер ядра по отношению ко всему атому подобен мячу на футбольном поле.
Вопрос: Ядро атома нейтрально?
Ядро атома несет положительный электрический заряд. Однако атом нейтрален, поскольку количество электронов с отрицательным зарядом равно количеству протонов в ядре.
Ядра атомов: в самом сердце материи

Рис. 1
Ядро атома получается крохотным, его радиус в 10 000–100 000 раз меньше всего атома. Каждое ядро содержит определённое количество протонов (обозначим его Z) и определённое количество нейтронов (обозначим его N), скреплённых вместе в виде шарика, по размеру не сильно превышающего сумму их размеров. Отметим, что протоны и нейтроны вместе часто называют «нуклонами», а Z+N часто называют A – общее количество нуклонов в ядре. Также Z, «атомное число» – количество электронов в атоме.
Типичное мультяшное изображение атома (рис. 1) чрезвычайно преувеличивает размер ядра, но более-менее правильно представляет ядро как небрежно соединённое скопление протонов и нейтронов.
Содержимое ядра
Откуда нам известно, что находится в ядре? Эти крохотные объекты просто охарактеризовать (и это было просто исторически) благодаря трём фактам природы.
1. Протон и нейтрон отличаются по массе всего лишь на тысячную часть, так что если нам не нужна чрезвычайная точность, можно сказать, что у всех нуклонов масса одинакова, и назвать её массой нуклона, mнуклон:
(≈ означает «примерно равно»)
2. Количество энергии, необходимой для удержания вместе протонов и нейтронов в ядре, относительно мало – порядка тысячной доли части энергии массы (E = mc 2 ) протонов и нейтронов, так что масса ядра почти равна сумме масс его нуклонов:
3. Масса электрона равняется 1/1835 массы протона – так что почти вся масса атома содержится в его ядре:
Тут подразумевается наличие четвёртого важного факта: все атомы определённого изотопа определённого элемента одинаковы, как и все их электроны, протоны и нейтроны.
Поскольку в самом распространённом изотопе водорода содержится один электрон и один протон:
масса атома Mатом определённого изотопа просто равна Z+N, помноженному на массу атома водорода
и погрешность этих уравнений примерно равна 0,1%.
Поскольку нейтроны электрически нейтральны, электрический заряд Qядро ядра просто равен количеству протонов, помноженному на электрический заряд протона («e»):
В отличие от предыдущих уравнений, это уравнение выполняется точно.
Эти уравнения проиллюстрированы на рис. 2

Рис. 2
Используя открытия последних десятилетий XIX века и первых десятилетий XX, физики знали, как измерить в эксперименте оба обозначенных красным значения: заряд ядра в e, и массу любого атома в атомах водорода. Так что эти значения были известны уже в 1910-х. Однако правильно интерпретировать их смогли только в 1932 году, когда Джеймс Чедвик определил, что нейтрон (идею которого предложил Эрнест Резерфорд в 1920-м) является отдельной частицей. Но как только стало понятно, что нейтроны существуют, и что их масса практически равна массе протона, сразу же стало ясно, как интерпретировать числа Z и N — количество протонов и нейтронов. А также сразу родилась новая загадка – почему у протонов и нейтронов почти одинаковая масса.
Честно говоря, физикам того времени с научной точки зрения страшно повезло, что всё это было так легко установить. Закономерности масс и зарядов настолько просты, что даже самые долгие загадки были раскрыты сразу после открытия нейтрона. Если бы хотя бы один из перечисленных мною фактов природы оказался неверным, тогда на то, чтобы понять, что происходит внутри атомов и их ядер, ушло бы гораздо больше времени.

Рис. 3
Откуда нам известно, что ядро атома маленькое?
Одно дело – убедить себя, что определённое ядро определённого изотопа содержит Z протонов и N нейтронов; другое – убедить себя, что ядра атомов крохотные, и что протоны с нейтронами, будучи сжатыми вместе, не размазываются в кашу и не разбалтываются в месиво, а сохраняют свою структуру, как подсказывает нам мультяшное изображение. Как это можно подтвердить?
Я уже упоминал, что атомы практически пусты. Это легко проверить. Представьте себе алюминиевую фольгу; сквозь неё ничего не видно. Поскольку она непрозрачная, вы можете решить, что атомы алюминия:
1. Настолько крупные, что между ними нет просветов,
2. Настолько плотные и твёрдые, что свет сквозь них не проходит.
Насчёт первого пункта вы будете правы; в твёрдом веществе между двумя атомами почти нет свободного пространства. Это можно наблюдать на изображениях атомов, полученных при помощи особых микроскопов; атомы похожи на маленькие сферы (краями которых служат края электронных облаков), и они довольно плотно упакованы. Но со вторым пунктом вы ошибётесь.

Рис. 4
Если бы атомы были непроницаемыми, тогда сквозь алюминиевую фольгу ничто не смогло бы пройти – ни фотоны видимого света, ни рентгеновские фотоны, ни электроны, ни протоны, ни атомные ядра. Всё, что вы направили бы в сторону фольги, либо застревало бы в ней, либо отскакивало бы – точно так же, как любой кинутый объект должен отскочить или застрять в гипсокартонной стенке (рис. 3). Но на самом деле электроны высокой энергии легко могут пройти через кусочек алюминиевой фольги, как и рентгеновские фотоны, высокоэнергетические протоны, высокоэнергетические нейтроны, высокоэнергетические ядра, и так далее. Электроны и другие частицы – почти все, если точнее – могут пройти через материал, не потеряв ни энергии, ни импульса в столкновениях с чем-либо, содержащимся внутри атомов. Лишь малая часть их ударится об атомное ядро или электрон, и в этом случае они могут потерять большую часть своей начальной энергии движения. Но большая часть электронов, протонов, нейтронов, рентгеновских лучей и всякого такого просто спокойно пройдут насквозь (рис. 4). Это не похоже на швыряние гальки в стену; это похоже на швыряние гальки в сетчатый забор (рис. 5).

Рис. 5
Чем толще фольга – к примеру, если складывать всё больше и больше листов фольги вместе – тем вероятнее частицы, запущенные в неё, столкнуться с чем-либо, потеряют энергию, отскочат, изменят направление движения или даже остановятся. То же было бы верно, если бы вы наслаивали одну за другой проволочные сетки (рис. 6). И, как вы понимаете, из того, насколько далеко средняя галька может проникнуть сквозь слои сетки и насколько велики разрывы в сетке, учёные могут подсчитать на основании пройденной электронами или атомными ядрами дистанции, насколько атом пустой.

Рис. 6
Посредством таких экспериментов физики начала XX века установили, что внутри атома ничто – ни атомное ядро, ни электроны – не может быть большим, чем одна тысячная миллионных миллионных долей метра, то есть в 100 000 раз меньше самого атома. То, что такого размера достигает ядро, а электроны по меньшей мере в 1000 раз меньше, мы устанавливаем в других экспериментах – например, в рассеянии высокоэнергетических электронов друг с друга, или с позитронов.
Чтобы быть ещё более точным, следует упомянуть, что некоторые частицы потеряют часть энергии в процессе ионизации, в котором электрические силы, действующие между летящей частицей и электроном, могут вырвать электрон из атома. Это дальнодействующий эффект, и столкновением на самом деле не является. Итоговая потеря энергии значительна для летящих электронов, но не для летящего ядра.
Вы можете задуматься над тем, похоже ли то, как частицы проходят сквозь фольгу, на то, как пуля проходить сквозь бумагу – расталкивая части бумаги в стороны. Возможно, первые несколько частиц просто расталкивают атомы в стороны, оставляя большие отверстия, через которые проходят последующие? Мы знаем, что это не так, поскольку мы можем провести эксперимент, в котором частицы проходят внутрь и наружу контейнера, сделанного из металла или стекла, внутри которого вакуум. Если бы частица, проходя через стенки контейнера, создавала отверстия по размеру превышающие атомы, тогда внутрь устремились бы молекулы воздуха, и вакуум бы исчез. Но в таких экспериментах вакуум остаётся!
Также довольно легко определить, что ядро – это не особенно структурированная кучка, внутри которой нуклоны сохраняют свою структуру. Об этом уже можно догадаться по тому факту, что масса ядра очень близка к сумме масс содержащихся в нём протонов и нейтронов. Это выполняется и для атомов, и для молекул – их массы почти равны сумме масс их содержимого, кроме небольшой коррекции на связывающую энергию – и это отражено в том факте, что молекулы довольно легко разбить на атомы (к примеру, нагрев их так, чтобы они сильнее сталкивались друг с другом), и выбить электроны из атомов (опять-таки, при помощи нагрева). Сходным образом относительно легко разбить ядра на части, и этот процесс будет называться расщеплением, или собрать ядро из более мелких ядер и нуклонов, и этот процесс будет называться синтезом. К примеру, относительно медленно двигающиеся протоны или небольшие ядра, сталкивающиеся с более крупным ядром, могут разбить его на части; нет необходимости, чтобы сталкивающиеся частицы двигались со скоростью света.

Рис. 7
Но чтобы понять, что это не является неизбежным, упомяну, что этими свойствами не обладают сами протоны и нейтроны. Масса протона не равняется примерной сумме масс содержащихся в нём объектов; протон нельзя разбить на части; а для того, чтобы протон продемонстрировал что-нибудь интересное, необходимы энергии, сравнимые с энергией массы самого протона. Молекулы, атомы и ядра относительно просты; протоны и нейтроны чрезвычайно сложны.