что влияет на степень гидролиза
Гидролиз
Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н + и ОН — ионами воды малодиссоциированные электролиты.
Гидролиз солей может протекать:
→ обратимо : только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо : практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью окисления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Обратимый гидролиз солей
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
CH3COONa + HOH ↔ CH3COOH + NaOH
CH3COO — + Na + + HOH ↔ CH3COOH + Na + + OH —
сокращенное ионное уравнение:
CH3COO — + HOH ↔ CH3COOH + OH —
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO3 2- + HOH ↔ HCO3 2- + OH —
или в молекулярной форме:
или в молекулярной форме:
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
или в молекулярной форме:
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
Fe 3+ + HOH ↔ FeOH 2+ + H +
FeCl3 + HOH ↔ FeOHCl2 + H Cl
FeOH 2+ + HOH ↔ Fe(OH)2 + + H +
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
Fe(OH)2 + + HOH ↔ Fe(OH)3 + H +
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
Сведем вышеописанную информацию в общую таблицу:
Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
! Исключения: (соли Ca, Sr, Ba и Fe 2+ ) – в этом случае получим обычный обменный процесс:
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
Соли Fe 3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H + OH — ) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример : изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:
2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример : изменение степени гидролиза Na2CO3 в зависимости от температуры:
По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Факторы, влияющие на степень гидролиза
Чем слабее основание и кислота, образующие соль, тем она сильнее гидролизуется.
2. Концентрация соли
При разбавлении степень гидролиза растет, так как растет число молекул воды, являющихся исходным веществом в реакции гидролиза, поэтому, по принципу Ле Шателье, равновесие смещается вправо
Гидролиз является эндотермическим процессом, поэтому при повышении температуры степень гидролиза увеличивается, так как равновесие смещается вправо.
4. Присутствие одноименных ионов
Если в раствор соли, имеющий кислую реакцию, добавить кислоту (т.е. ионы 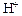
Если добавить щелочь (т.е. ионы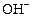
Аналогично, если в раствор соли, имеющий щелочную реакцию, добавить щелочь, гидролиз ослабится, а при добавлении кислоты – усилится.
Часто необходимо подавить гидролиз. Для этого растворы солей следует хранить в концентрированном виде при низких температурах.
Влияние концентрации раствора, температуры, рН среды на степень гидролиза. Гидролиз кислых солей. Совместный гидролиз солей. Многостадийность реакций гидролиза



Факторы, влияющие на степень гидролиза
1. Природа соли. Чем слабее основание и кислота, образующие соль, тем она сильнее гидролизуется.
2. Концентрация соли. При разбавлении степень гидролиза растет, так как растет число молекул воды, являющихся исходным веществом в реакции гидролиза, поэтому, по принципу Ле Шателье, равновесие смещается вправо
3. Температура. Гидролиз является эндотермическим процессом, поэтому при повышении температуры степень гидролиза увеличивается, так как равновесие смещается вправо.
4. Присутствие одноименных ионов. Если в раствор соли, имеющий кислую реакцию, добавить кислоту (т.е. ионы ), то равновесие сместится влево и гидролиз ослабится.
Если добавить щелочь (т.е. ионы), катионы будут связываться в молекулы H2O, и равновесие сместится вправо. Гидролиз усилится.
Аналогично, если в раствор соли, имеющий щелочную реакцию, добавить щелочь, гидролиз ослабится, а при добавлении кислоты – усилится.
Часто необходимо подавить гидролиз. Для этого растворы солей следует хранить в концентрированном виде при низких температурах.
Кислые соли образуются в результате неполного замещения водорода на металл или аммонийную группу. Таким образом, они состоят из металла, водорода и кислотного остатка. Образование их возможно только для многоосновных кислот.
Примеры таких соединений:
— дигидрофосфат натрия NaH2PO4;
— гидрофосфат натрия Na2HPO4;
— гидросульфат калия KHSO4.
В названии их присутствуют приставки «гидро-» (при наличии одного незамещенного катиона водорода) или «дигидро-» (при наличии двух незамещенных катионов водорода).
Обычно такой гидролиз солей описывается молекулярным и суммарным молекулярными уравнениями:
2CrCl3 (по катиону) + 3K2S (по аниону) + 6H2O ↔ 2Cr(OH)3↓ + 3H2S↑ + 6KCl
— суммарное молекулярное уравнение:
2CrCl3 + 3K2S + 12H2O ↔ 2Cr(OH)3↓ + 3H2S↑ + 6KCl + 6H2O (отличия в уравнениях выделены шрифтом). Другие примеры реакций совместного гидролиза с взаимным его усилением:
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaCl = <2AlCl3 + 3Na2CO3 = Al2(CO3)3 6NaCl>+
Обычно в каждом отдельном растворе гидролиз ограничивается только первой стадией
Такое усиление гидролиза происходит также при смешивании растворов двух слабо гидролизованных солей, содержащих многозарядные:
— кислотные остатки слабых кислот
Протекание гидролиза зависит от соотношения сил кислоты и основания. Гидролиз усиливается взаимно, если к раствору соли слабой кислоты и сильного основания добавить сильной кислоты или к раствору соли сильной кислоты и слабого основания добавить щелочь.
Например, если имеются две разные емкости с гидролизованными растворами солей
Al(NO3)3 (по катиону): Al3+ + H2O ↔ AlOH2+ + H+
К2СО3 (по аниону): CO32- + H2O ↔ HCO3- + OH-
2Al(NO)3)3 + 3K2CO3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6KNO3
2Al3+ + 3CO32- + 3HOH = 2Al(OH)3↓ + 3CO2↑
т.е. происходит взаимное усиление гидролиза (гидролиз каждой из солей протекает до конца, т.е. результатом является полный гидролиз солей)
Аналогичный эффект взаимного усиления гидролиза наблюдается с растворами солей
Взаимный гидролиз протекает с выделением аммиака, слабой летучей кислоты (H2CO3, H2S, H2SO3 и др.), при выпадении осадка слабого основания или нерастворимой кислоты (H2SiO3)>
Совокупность стадий, из которых складывается химическая реакция, составляет ее механизм. Многостадийность реакций приводит к тому, что экспериментально наблюдаемые кинетические уравнения их не соответствуют стехиометрическим уравнениям. Согласно опытным данным, окисление ионов железа идет со скоростью: v = k• [Fe2+]2?[O2]. Как следует из стехиометрических уравнений, ожидаемый суммарный порядок для реакции равен 9, а фактически он равен 3.
Подобного рода расхождения позволяют определенно утверждать, что данная реакция является сложной и включает совокупность параллельных или последовательных элементарных процессов. В соответствии с этим закон действующих масс в полной мере применим лишь к одностадийным реакциям. В случае многостадийных реакций зависимость их скорости от концентрации исходных веществ может быть рассчитана аналитически или установлена опытным путем.
Урок №14. Гидролиз
Гидролизу подвергаются как неорганические, так и органические вещества в результате обменной реакции между молекулами воды и вещества. Реакции гидролиза могут протекать как обратимо, так и необратимо.
Примеры гидролиза
Неорганических веществ
CH 3 COONH 4 +H 2 O↔CH 3 COOH+NH 4 OH
Органических веществ
CH 3 COOCH 3 +H 2 O↔CH 3 COOH+CH 3 OH
C 2 H 5 ONa+H 2 O↔C 2 H 5 OH+NaOH
Факторы, влияющие на степень гидролиза
Степень гидролиза зависит от:
природы растворяемого вещества
1). Гидролиз эндотермическая реакция, поэтому повышение температуры усиливает гидролиз.
2). Чем меньше концентрация соли, тем выше степень ее гидролиза. При разбавлении водой равновесие смещается в сторону протекания реакции, т.е. вправо, степень гидролиза возрастает.
3). Повышение концентрации ионов водорода ослабляет гидролиз, в случае гидролиза по катиону. Аналогично, повышение концентрации гидроксид-ионов ослабляет гидролиз, в случае гидролиза по аниону.
4). Добавки посторонних веществ могут влиять на положение равновесия в том случае, когда эти вещества реагируют с одним из участников реакции. Так, при добавлении к раствору сульфата меди
2CuSO 4 + 2H 2 O (CuOH) 2 SO 4 + H 2 SO 4
раствора гидроксида натрия, содержащиеся в нем гидроксид-ионы будут взаимодействовать с ионами водорода. В результате их концентрация уменьшится, и, по принципу Ле Шателье, равновесие в системе сместится вправо, степень гидролиза возрастет. А если к тому же раствору добавить раствор сульфида натрия, то равновесие сместится не вправо, как можно было бы ожидать (взаимное усиление гидролиза) а наоборот, влево, из-за связывания ионов меди в практически нерастворимый сульфид меди.
5). Концентрация соли. Рассмотрение этого фактора приводит к парадоксальному выводу: равновесие в системе смещается вправо, в соответствии с принципом Ле Шателье, но степень гидролиза уменьшается.
Al(NO 3 ) 3
Соль гидролизуется по катиону. Усилить гидролиз этой соли можно, если:
нагреть или разбавить раствор водой;
добавит раствор щёлочи (NaOH);
добавить раствор соли, гидролизующейся по аниону Nа 2 СО 3 ;
Ослабить гидролиз этой соли можно, если:
растворение вести на холоду;
готовить как можно более концентрированный раствор Al(NO 3 ) 3 ;
добавить к раствору кислоту, например HCl
Гидролиз солей многокислотных оснований и многоосновных кислот проходит ступенчато
Например, гидролиз хлорида железа (II) включает две ступени:
FeCl 2 + H 2 O FeOHCl + HCl
Fe(OH)Cl + H 2 O Fe(OH) 2 + HCl
Гидролиз карбоната натрия включает две ступени:
Nа 2 СО 3 + H 2 O NаНСО 3 + NаОН
NаНСО 3 + Н 2 О NаОН + Н 2 СО 3
Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота:
Al 2 S 3 + 6H 2 O =>2Al(OH) 3 ↓+ 3H 2 S↑
2AlCl 3 +3Na 2 S≠Al 2 S 3 +6NaCl
2AlCl 3 +3Na 2 S+6H 2 O=2Al(OH) 3 ↓+6NaCl+3H 2 S↑ (взаимное усиление гидролиза)
Поэтому их получают в безводных средах спеканием или другими способами, например:
2Al+3S = t°C =Al 2 S 3
Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be 2+ , Co 2+ , Ni 2+ , Zn 2+ , Pb 2+ , Cu 2+ и др.) и растворимые карбонаты/гидрокарбонаты.
При этом образуются нерастворимые основные соли (гидроксокарбонаты):
2MgCl 2 + 2Na 2 CO 3 + H 2 O = Mg 2 (OH) 2 CO 3 + 4NaCl + CO 2
CaCl 2 + Na 2 CO 3 = CaCO 3 + 2NaCl,
2AlCl 3 + 3K 2 S +6H 2 O = 2Al(OH) 3 + 3H 2 S↑ + 6KCl
2CrCl 3 + 3K 2 CO 3 + 3H 2 O = 2Сr(ОН) 3 + 3СO 2 + 6KCl
2AlCl 3 + 3Na 2 SO 3 + 3Н 2 О=2Al(ОН) 3 + 6NaCl + 3SО 2
2AlCl 3 + 3Na 2 S + 3Н 2 О=2Al(ОН) 3 + 6NaCl + 3H 2 S
Соли Fe 3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
2FeCl 3 + 3K 2 CO 3 + 3H 2 O = 2Fe(ОН) 3 + 3СO 2 + 6KCl
Обратите внимание: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl 3 + 3K 2 S (изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H + OH — ) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
SO 2 Cl 2 + 2 H 2 O = H 2 SO 4 + 2 HCl,
SOCl 2 + 2 H 2 O = H 2 SO 3 + 2HCl,
PCl 5 + 4 H 2 O = H 3 PO 4 + 5HCl,
CrO 2 Cl 2 + 2H 2 O = H 2 CrO 4 + 2HCl,
PCl 5 + 8NaOH = Na 3 PO 4 + 5NaCl + 4H 2 O,
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
POCl 3 + 3H 2 O = H 3 PO 4 + 3HCl
Примеры реакций гидролиза
(NH 4 ) 2 CO 3 карбонат аммония – соль, слабой кислоты и слабого основания. Растворима. Гидролизуется по катиону и аниону одновременно. Число ступеней – 2.
1 ступень: (NH 4 ) 2 CO 3 +H 2 O↔NH 4 OH+NH 4 HCO 3
2 ступень: NH 4 HCO 3 +H 2 O↔NH 4 OH+H 2 CO 3
Реакция раствора слабощелочная pH>7, т.к гидроксид аммония более сильный электролит, чем угольная кислота. К д (NH 4 OH)>К д (H 2 CO 3 )
CH 3 COONH 4 ацетат аммония – соль, слабой кислоты и слабого основания. Растворима. Гидролизуется по катиону и аниону одновременно. Число ступеней – 1.
CH 3 COONH 4 +H 2 O↔NH 4 OH+СH 3 COOH
Реакция раствора нейтральная pH=7, т.к К д (CH 3 COOН)=К д (NH 4 OH)
1 ступень: K 2 HPO 4 +H 2 O↔KH 2 PO 4 +KOH
2 ступень: KH 2 PO 4 +H 2 O↔H 3 PO 4 +KOH
Реакция раствора 2 ступени слабокислая pH=6,4, так как процесс диссоциации дигидроортофосфат ионов преобладает над процессом гидролиза, при этом ионы водорода не только нейтрализуют гидроксид-ионы, но и остаются в избытке, что и обуславливает слабокислую реакцию среды.
Задача: Определите среду растворов гидрокарбоната и гидросульфита натрия.
Решение:
1) Рассмотрим процессы в растворе гидрокарбоната натрия. Диссоци а ция этой соли идёт в две ступени, катионы водорода образуются на второй ступени:
Гидролиз гидрокарбоната натрия описывается уравнением:
NaHCO 3 +H 2 O↔H 2 CO 3 +NaOH
Константа гидролиза заметно больше константы диссоциации, поэтому раствор NaHCO 3 имеет щелочную среду.
2) Рассмотрим процессы в растворе гидросульфита натрия. Диссоци а ция этой соли идёт в две ступени, катионы водорода образуются на второй ступени:
Гидролиз гидросульфита натрия описывается уравнением:
NaHSO 3 +H 2 O↔H 2 SO 3 +NaOH
В этом случае константа диссоциации больше константы гидролиза, поэтому раствор NaHSO 3 имеет кислую среду.
Задача: Определить среду раствора соли цианида аммония.
Решение:
NH 4 CN +H 2 O ↔ NH 4 OH+ HCN







