что влияет на мутность воды
Мутность воды
Мутность воды – это характеристика уменьшения прозрачности из-за воздействия внутренних и сторонних факторов. В мутной воде находятся твердые мелкие частицы, которые не растворяются, а оседают на дно.
Источники
Причиной мутности часто являются частицы песка, гальки и ила.Они смываются осадками, поступают с талыми водами в реки и возникают в разрушенных скважинах. Если мутность воды в бассейне не представляет угрозу для ее использования, то мутную воду из скважины употреблять в пищу нежелательно.
Мутность зависит от сезонов года. Меньше всего примесей в воде зимой, а больше всего – осенью и вестной за счет паводков, обильных дождей, перемещающихся водорослей, планктона и других организмов.
Влияние на здоровье человека и коммуникации
Рост вредных бактерий в большом количестве способен приводить к постепенному разрушению сантехнического оборудования и коммуникаций.
Дезинфекцию воды стоит проводить с минимальной мутностью, иначе она не будет иметь смысла.
Норма мутности воды
Согласно СанПиН допустимое значение мутности воды для питьевой воды составляет 2,6 ЕМФ. ЕМФ – единица мутности по формазину.
Определение мутности воды
Точное измерение мутности воды можно осуществить только в лаборатории.Определение мутности воды по ГОСТ осуществляется с помощью сравнивания двух образцов – стандартного и из водоема. Для этого используется фотометрический метод с помощью суспензии коалина и при использовании формазина.
Условия отбора пробы
Для того, чтобы анализ воды на мутность показал верный результат, необходимо правильно собрать исследуемый материал. Для этого понадобится:
Если Вы собираетесь провести анализ водопроводной воды, то слейте ее сильным напором в течение 10-15 минут и наполните тару до краев под тонкой струей. Плотно закройте сосуд крышкой и доставьте в лабораторию.
Тара не должна быть из-под сладких и газированных напитков. Моющее средство использовать запрещается.
Как убрать мутность воды
Если Вы получили анализ с высоким показателем мутности воды, необходимо заняться ее очисткой перед употреблением.
Если Вам известен источник загрязнения, можно попытаться его устранить, или же установить систему, устраняющую мутность воды. Существуют следующие методы борьбы с мутностью:
В Лаборатории «ИОН» вы сможете провести анализ воды любого происхождения. Мы работаем более 20-ти лет, используя современные приборы и качественные материалы, сотрудничаем с крупнейшими разработчиками аналитического оборудования и лучшими специалистами страны. Гарантируем качественное проведение работ в строго установленные сроки.

Мутность — это когда в воде находятся в не растворенном (твердом) состоянии мелкие частицы. Они не достаточно велики, чтобы быть заметными невооруженным глазом, даже в обычный микроскоп они могут быть не видны. Например коллоиды — это частицы, размер которых не превышает 500 нанометров, но они достаточно велики, чтобы преломлять луч света, проходящий через колбу с водой. Мы видим, что вода не на 100% прозрачная и говорим — вода мутная.
Посмотрите это видео, чтобы понимать какие бывают частицы и как они влияют на мутность воды
Мутность поверхностной воды (реки, ручьи, пруды, озера, моря) обусловлена в основном жизнью в ней микроорганизмов и органическими веществами, часто взвесью песка. Такая вода легко поддается осветлению с помощью осветлительных колонн. Используются такие материалы: Filter AG, Сорбент АС, Сорбент МС, МФУ, Кварцевый песок,ОДМ-2Ф, активированные угли, словом, различные легкие насыпные материалы с развитой поверхностью для удаления взвесей.
Мутность воды взятой из подземных источников (колодец, абиссинка, скважина) или поселкового водопровода может быть также обусловлена:
Причем, если мы получаем воду из подземного источника изначально мутную и эта муть быстро оседает при отстое воды — скорее всего это взвесь глины, песка. А если вода приходит совершенно прозрачная, но постояв в открытой емкости мутнеет — это признак окисления растворенных в воде металлов — железа, марганца. Разбираться с тем как окисляются металлы в воде мы будем в других статьях.
Чтобы лучше понять физический смысл понятия МУТНОСТЬ ВОДЫ посмотрите вот этот небольшой кинофильм советских времен:
А сейчас поговорим о методах анализа воды, как определяется мутность и что она означает в анализе воды.
Определение мутности
Мутность воды определяется фотометром (как работает фотометрия ВИДЕО) посредством сравнения исследуемой воды со стандартными взвесями.

Традиционно в качестве стандартной взвеси использовалась взвесь каолина (глины), в таком случае говорят: «Мутность по каолину мг/л», имеется ввиду сколько миллиграмм каолина на литр (или кубический дециметр) было добавлено для получения идентичной мутности в сравнении с исследуемом образцом.
Сейчас чаще всего для определения мутности используют формазин (полимер) при этом мутность измеряют в ЕМ/литр (единицы мутности на литр)
В таком случае говорят: «…единицы мутности по формазину (ЕМФ)»
Мутность в анализе воды
Разберем пример из практики:
У меня есть анализ от одного из клиентов. Вот ссылка на него: «исводцентр_анализ.doc» можете качнуть весь анализ, но я предлагаю сначала посмотреть на картинку:


Из этого я делаю вывод, что все железо, практически полностью окислилось в бутылке пока воду везли в лабораторию, пока вода ждала в лаборатории своей очереди на исследование. И железо перешло в трехвалентное состояние — коллоидное — очень мелкие частицы, которые не видно глазом, но прекрасно видно мутность воды.
Если в эту воду добавить пару капель коагулянта — коллоиды быстро слипнутся и взвесь осядет на дно. Так же можно просто подождать в воде заведутся аэробные железобктерии, которые «съедят» железо, в результате чего оно опять же выпадет в осадок в виде хлопьев.
Теперь, когда Вы знаете все о мутности воды Вам будет интересно посмотреть для закрепления материала, так сказать, вот этот короткий новостной ролик из архива:
Что влияет на мутность воды
Запах скошенной травы, сена
Запахи естественного происхождения, не подходящие под предыдущие определения
Запахи второй группы (искуственного происхождения) называют по определяющим запах веществам: хлорный, бензиновый и т.д.
Вкус и привкус
Интенсивность вкуса и привкуса определяется также по 6-балльной шкале (табл.4)
Таблица 4. Характеристика вод по интенсивности вкуса
Оценка вкуса и привкуса, баллы
Интенсивность вкуса и привкуса
Характер проявления вкуса и привкуса
Вкус и привкус не ощущается
Вкус и привкус сразу ощущается потребителем, но обнаруживаются при тщательном тестировании
Вкус и привкус замечаются, если обратить на это внимание
Вкус и привкус легко замечаются и вызывают неодобрительный отзыв о воду
Вкус и привкус обращают на себя внимание и заставляют воздержаться от питья
Вкус и привкус настолько сильны, что делают воду непригодной к употреблению
Для питьевой воды допускаються значения показателй вкуса и привкуса не более 2 баллов.
Различают 4 вид вкусов:
Показатель качества воды, характеризующий интенсивность окраски воды и обусловленный содержанием окрашенных соединений, выражается в градусах платино-кобальтовой шкалы и определяется путем сравнения окраски испытуемой воды с эталонами.
Цветность природных вод обусловлена главным образом присутсвием гумусовых веществ и соединений трехвалентного железа, колеблется от единиц до тысяч градусов (табл.5)
Таблица 5. Характеристика вод по цветности
Единицы измерения, градус платино-кобальтовой шкалы
Взвешенные твердые примеси, присуствующие в природных водах, состоят из частиц глины, песка, ила, суспедированных органических и неорганических веществ, планктона и различных микроорганизмов. Взвешенные частицы влияют на прозрачность воды.
Водородный показатель (рН)
Таблица 6. Классификация вод по рН
От величины рН зависит развитие и жизнедеятельность многих организмов, агрессивное действие воды на металлы и бетон. Величина рН воды также влияет на процессы превращения различных форм биогенных элементов, изменяет токсичность загрязняющих веществ.
В соответсвии с требованиями к составу и свойствам питьевой воды, величина рН не должна выходить за пределы интервала значений 6,0-9,0. Контроль уровня рН особенно важен на всех стадиях водоочистки, так как его «уход» в ту или иную сторону может не только существенно сказаться на запахе, привкусе и внешнем виде воды, но и повлиять на эффективность водоочистных мероприятий.
При низком рН вода обладает высокой коррозионной активностью, а при высоких уровнях (рН>11) вода приобретает характерную мылкость, неприятный запах, вызывает раздражение глаз и кожи.
Таблица 7. Характеритика вод по минерализации
Единица измерения, г/л
Граница 50 г/л между солеными водами и рассолами обусловлена тем, что соленость больше этого значения не бывает в морях; Такая соленость характерна только для соленых озер и некоторых подземных вод.
Таблица 8. Характеристика вод по общей минерализации (наиболее распространеннная градация)
Общая минерализация, г/л
В соответствии с гигиеническими требованиями к качеству питьевой воды суммарная минерализация не должна превышать 1000 мг/л. Вода содержащая большое количество солей, отрицательно влияет на растения и человека, вызывает образование накипи на стенках котлов, коррозию, засоление почв. Регулярное употребление высокоминерализированной воды приведет к болезням пищеварения, обмена веществ, повышеной сухости кожи.
По стандарту ИСО 6107-1-8: 1996, включающему более 500 терминов, жесткость определяется как способность воды образовать пену мылом. Содержание в питьевой воде кальция и магния играет важнейшую роль для человеческого организма. Недостаточность кальция в организме негативно сказывается на функии сердечной мышцы и на активности некоторых ферментов. А недостаток содержания кальция в крови ведет к понижению возбуждаемости нервной системы и, как следствие, к возникновению судорог. Кальций необходим для формирования костных тканей, в том числе зубов. Соли магния тоже необходимы человеку, поскульку входят в ряд жизненно важных ферментов. Дефицит магния проводит к коронарной болезни сердца; с другой стороны, повышенное содержание магния угнетающе действуют на нервную систему, поражая двигательные нервные окончания.
По значению общей жесткости природные воды делят на группы (табл.9)
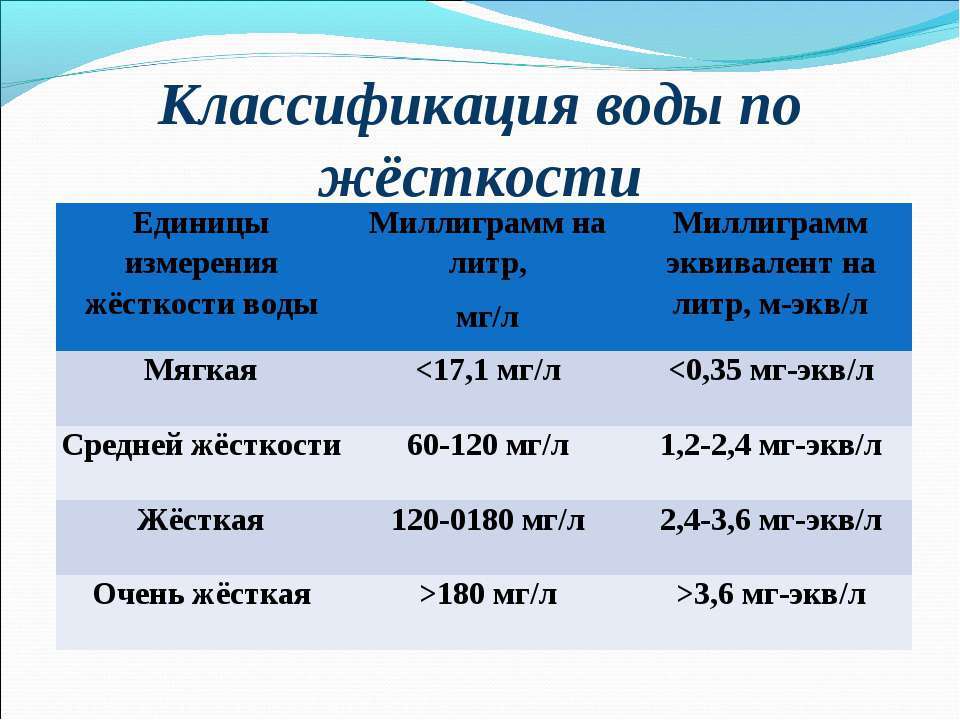
Таблица 9. Классификация воды по жесткости
Единица измерения, ммоль/л
Основные единицы жесткости воды и их соотношение:
Немецкий градус, do
gpg (grain per gallon,
Повышенная жесткость воды негативно отражается на здоровье человека. В быту появление накипи приводит к уменьшению срока слыжбы водонагревателей, ухудшаются моющие свойства мыла и стиральных порошков, из-за горьковатого привкуса ухудшаются вкусовые свойства воды.
Порог вкуса для иона кальция лежит в диапазоне 2-6 ммоль/л, в зависимости от соответствующего аниона. Порог вкуса для магния и того ниже, наилучшие вкусовые свойства имеет вода с жсткостью 1,6-3,0 ммоль/л.
Всемирная организация здравоохранения (ВОЗ) не регламентирует величину жесткости по показаниям влияния на здоровье. В материалах ВОЗ говориться о том, что несмотря на выявленную статистическим путем зависимость между жесткостью питьевой воды и сердечно-сосудистыми заболеваниями, этих данных недостаточно для вывода о причинном характере этой связи. Однозначно не доказано и то, что мягкая вода оказывает отрицательный эффект на баланс минеральных веществ в организме человека.
Растворенный кислород
Скорость потребления кислорода увеличивается с повышением температуры, количества организмов и веществ, подвергающихся химическому и биохимическому окислению.
Концентрация кислорода в воде определяет направление и скорость процессов химического и биохимического окисления органических и неорганических соединений. Понижение содержания кислорода до 2 мг/л вызывает массовую гибель рыбы в водоемах. Неблагоприятно сказывается на состоянии водных объектов и чрезмерное насыщение воды кислородом в результате процессов фотосинтеза, если это происходит в водоемах с застойной водой.
Содержание кислорода в водоемах с различной степенью загрязненности:
Таблица 10. Уровень загрязнения воды и класс качества
| Растворенный кислород | |||
| Очень чистые, I | лето, мг/л | зима, мг/л | % насыщения |
| Чистые, II | 9 | 14-13 | 95 |
| Умеренно загрязненные, III | 8 | 12-11 | 80 |
| Загрязненные, IV | 7-6 | 10-9 | 70 |
| Грязные, V | 5-4 | 5-4 | 60 |
| Очень грязные, VI | 3-2 | 5-1 | 30 |
| 0 | 0 | 0 | |
*Турбулизация приводит к нарушению поверхностного натяжения воды. При этом разрывается поверхностная пленка и облегчается выход газов из воды. Благодаря турбулентному движению происходит перемешивание частиц воды и непрерывное обновление поверхности соприкосновения воды с паром. Это ускоряет выход газа из воды и переход его в пар. Турбулизация движения воды создается потоком пара, пересекающим струи воды.
Вопросы контроля качества воды внесли в понятие биогенных элементов широкий смысл: к ним относят соединения (точнее, компоненты воды), которые, во-первых, являются продуктами жизнедеятельности различных организмов; во-вторых, являются «строительным материалом» для живых организмов. В первую очередь к ним относятся соединения азота (нитраты, нитриты, органические и неорганические аммонийные соединения), фосфора (ортофосфаты, полифосфаты, органические эфиры фосфорной кислоты и др.).
Соединение серы интересны в этой связи,в меньшей степени, так как сульфаты уже расматривали в аспекте компонента минерального состава воды, а сульфиды и гидросульфиты, если приутствуют в природных водах, то в очень малых концентрациях и могут быть обнаружены по запаху.
Нитраты
Фосфаты и общий фосфор
Биохимическая потребность в кислороде (БПК)
В естественных условиях находящиеся в воде органические вещества разрушаются бактериями с образованием двуокиси углерода. При этом на окисление потребляется растворенный в воде кислород. Таким образом, в процессе биохимического окисления органических веществ в воде происходит уменьшение концентрации кислорода, и эта убыль косвенно является мерой содержания в воде органических веществ.
Таблица 11. Характеристика вод по БПК5
| Степень загрязнения (класс чистоты) | БПК5, мг О2 /дм 3 |
| Очень чистая | |
| Чистая | 1,1-1,9 |
| Умеренно загрязненная | 2,0-2,9 |
| Загрязненная | 3,0-3,9 |
| Грязная | 4,0-10,0 |
| Очень грязная | Более 10,0 |
Особенностью биохимического окисления органических веществ в воде является сопутствующий ему процесс нитрификации (окисление азотосодержащих соединений нитрофицирующими бактериями), искажающий характер потребления кислорода.
Аммоний
Катионы аммония являются продуктом микробиологического разложения белков животного и растительного происхождения. Образовавшийся таким образом аммоний вновь вовлекается в процесс синтеза белков. По этой причине аммоний и его соединения в небольших концентрациях обычно присутствуют в природных водоемах.
Аммонийные соединения в больших количествах входят в состав минеральных и органических удобрений, кроме того, аммонийные соединения в значительных количествах присутсвуют в нечистотах (фекалиях). По этим причинам повышенное содержание аммонийного азота в поверхностных водах обячно является признаком хозяйственно-фекальных загрязнений.
ПДК аммиака и ионов аммония в воде водоемов составляет 2,6 мг/л. Согласно СанПин 2.1.45.1074-01 ПДК аммония в питьевой воде составляет 2,0 мг/л. По данным ВОЗ, сожержание аммония не должно превышать 0,5 мг/л. Постоянный прием внутрь воды с повышенным содержанием аммония вызывает хронический ацидоз и изменения в тканях.
Нитриты
Нитритами называются соли азотистой кислоты. Нитрит-анионы являются промежуточными продуктами биологического разложения азотсодержащих органических соединений. Благодаря способности превращаться в нитраты, нитриты, как правило, отсутствуют в поверхностных водах. ПДК нитритов (по NO 2- ) в воде водоемов составляет 3,3 мг/л, для питьевой воды – 2,0 мг/л.
Фтор (фториды)
Фтор в виде фторидов может содержаться в природных и грунтовых водах. Избыток фтора в организме вызывают разрушение зубной эмали, осаждает кальций, что приводит к нарушениям кальциевого и фосфорного обмена. По этим причинам определение фтора в питьевой воде, а также грунтовых водах (например, воде колодцев и артезианских скважин) и воде водоемов хозяйственно-питевого назначения, является очень важным. ПДК фтора в питьевой воде для разных климатических районов составляет от 0,7 до 1,5 мг/л.
Железо общее

В природной воде железо содержится в виде соединений, в которых железо может быть двух- или трехвалентным. В свою очередь, соединения железа могут образовывать истинные или коллоидные растворы. На воздухе двухвалентное железо быстро окисляется до трехвалентного, растворы которого имеют бурую окраску.
Таким образом, поскольку соединения железа в воде могут существовать в различных формах, точные результаты могут быть получены только при определении суммарного железа во всех его формах, так называемого «общего железа», хотя иногда возникает необходимость определить железо в его индивидуальных формах.
Железобактерии встречаются практически везде. Их «визитной карточкой» можно считать ржавую слизь, покрывающие трубу водопровода.
Некоторые виды бактерий (например, Gallionella ferruginea, вид стебельчатых, лентоподобных бактерий) «питаюся» растворенным железом в процессе своей жизнедеятельности. При этом происходит преобразование двухвалентного железа в трехвалентное, которое сохраняется в желеобразной оболочке вокруг бактерии, при отмирании железобактерии откладываются в вышеупомянутой слизи.
Некоторые органические молекулы способны связывать железо в сложные растворимые комплексы, называемые хелатами. Так, прекрасными хелатообразующими агентами являются фульво- и гуминовые кислоты, играющие важную роль в почвенном ионообмене.
Согласно СанПин 2.1.4.1074-01 содержание железа не должно превышать 0,3 мг/л (а по нормам Европейского сообщества даже 0,2 мг/л). При уровне установленного ВОЗ переносимого суточного потребления (ПСП) железа, равном 0,8 мг/кг массы тела человека, безопасное для здоровья суммарное содержание железа в воде составляет 2 мг/л. Избыток железа, в первую очередь, оказывает токсичное влияние на печень, селезенку, головной мозг; может усиливать протекание воспалительных процессов.
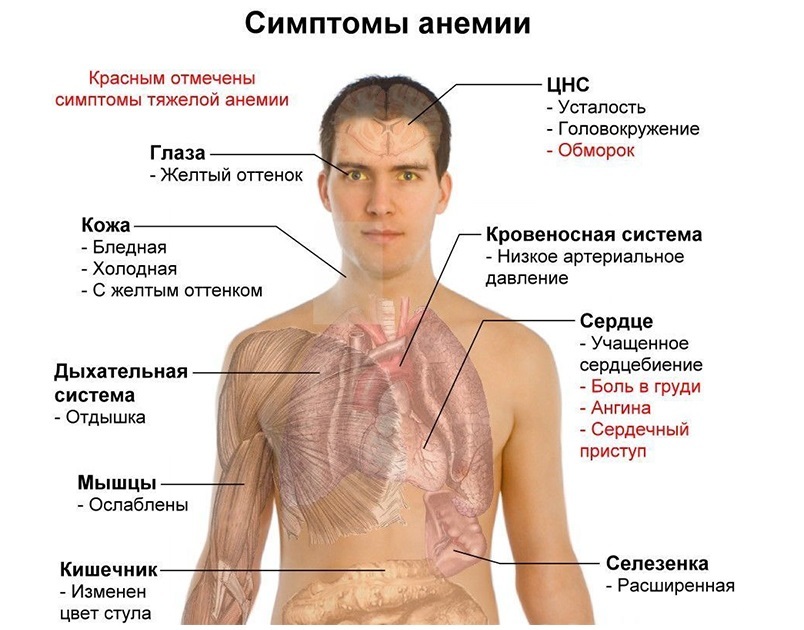
Дефицит железа в организме приводит к анемии, патологиям сердечной мышцы и скелетных мышц, а также может быть причиной снижения иммунитета. Железо незаменимо в процессах кроветворения и внутриклеточного обмена.
Тяжелые металлы
Понятие «Тяжелые металлы» не относится к строго определенным. Разные авторы в составе группы тяжелых металлов указывают разные химические элементы. В экологических публикациях в эту группу включают около 40 элементов с атомной массой более 50 атомных единиц.
Группа специалистов, работающая под патронажем Европейской экономической комиссии ООН и занимающаяся мониторингом выбросов в окружающую природную среду тяжелых металлов, включает в эту группу также цинк, мышьяк, селен, сурьму.
Группа растворенных примесей:
Группа нерастворенных примесей:
Содержание органических веществ в воде оченивается по методикам определения окисляемости воды, содержания органического углерода, биохимической потребности в кислороде, а также поглощения в ультрафиолетовой области.
Величина, характеризующая содержание в воде органических и минеральных веществ, окисляемых одним из самых сильных окислителей при определенных условиях, называется окисляемостью. Существует несколько видов окисляемости воды: перманганатная, бихроматная, иодатная, цериевая (методики определения двух последних применяются редко).
Для природных малозагрезненных вод рекомендовано определять перманганатную окисляемость (перманганатный индекс); в более загрязненных водах определяют, как правило, бихроматную окисляемость (ХПК).
Окисляемость перманганатная определяется мгО/л, если учитывается масса ионов кислорода в составе перманганата калия, пошедшего на окисление «органики», или мг KMnO4/л, если оценивается количество перманганата калия, пошедшего на окисление «органики».
Таблица 12. Характеристика вод по перманганатной окисляемости
| Величина окисляемости | Единица измерения, мг О/л |
| Очень малая | до 4 |
| Малая | более 4 до 8 |
| Средняя | более 8 до 12 |
| Высокая | более 12 до 20 |
| Очень высокая | более 20 |
Каждый из показателей качества воды в отдельности хотя и несет информацию о качестве воды, все же не может служить мерой качества воды, т.к. не позволяет судить о значениях других показателей. Вместе с тем, результатом оценки качества воды должны быть некоторые интегральные показатели, которые охватывали бы основные показатели качества воды (либо те из них, по которым зафиксированно неблагополучие).

В простейшем случае, при наличии результатов по нескольким оцениваемым показателям, может быть рассчитана сумма приведенных концентраций компонентов, т.е. отношение их фактических концентраций к ПДК.
При наличии результатов анализов по достаточному количеству показателей можно определять классы качества воды, которые являются интегральной характеристикой загрязненности поверхностных вод. Классы качества определяются по индексу загрязнения воды (ИЗВ).
Значение ИЗВ рассчитываются для каждого пункта отбора проб (створа). Далее по таблице, в зависимости от значения ИЗВ, определяют класс качества воды.
Таблица 13. Характеристики интегральной оценки качесвта воды
| ИЗВ | Класс качества воды | Оценка качества (характеристика) воды |
| Менее и равно 0,2 | I | Очень чистые |
| Более 0,2-1 | II | Чистые |
| Более 1-2 | III | Умеренно грязные |
| Более 2-4 | IV | Загрязненные |
| Более 4-6 | V | Грязные |
| Более 6-10 | VI | Очень грязные |
| Свяше 10 | VII | Чрезвычайно грязные |
В число 7 основных, так называемых «лимитируемых» показателей, при расчете ИЗВ в обязательном порядке входят концентрация растворенного кислорода и значение БПК5, а также значения еще четырех показателей, являющихся для данного водоема (воды) наиболее не благополучными или имеющих наибольшие приведенные концентрации.
Для рассчета ИЗВ показатели выбираются независимо от лимитирующего признака вредности, однако при равенстве приведенных концентраций предпочтение отдается веществам, имеющим санитарно-токсикологический признак вредности (как правило, такие вещества обладают относительно большей вредностью).
Задачи интегральной оценки качества воды практически совпадают с задачами гидрохимического мониторинга, т.к. для окончательного вывода о классе качества воды необъодимы результаты анализов по целому ряду показателей в течение продолжительного периода.
Микробиологические показатели
Уровень загрязненности и класс качества водных объктов иногда устанавливают в зависимости от микробиологических показателей.
Таблица 14. Оценка качесвта вод по микробиологическим показателям
| Класс чистоты | Характеристика класса чистоты воды | Число сапрофитных бактерий, 1000 клеток/мл | Отношение общего числа бактерий к числу сапрофитных бактерий | |
| I | Очень чистая | Менее 0,5 | Менее 0,5 | До 1000 |
| II | Очень чистая | От 0,5 до 1,0 | От 0,5 до 5,0 | Более 1000 |
| III | Умеренно загрязненная | Более 1,0 до 3,1 | Более 5,0 до 10,0 | От 1000 до 100 |
| IV | Умеренно загрязненная | Более 3,1 до 5,0 | Более 10,0 до 50,0 | Менее 100 |
| V | Грязная | Более 5,0 до 10,0 | Более 50,0 до 1000 | Менее 100 |
| VI | Очень грязная | Более 10,0 | Более 1000 | Менее 100 |
** Эвтрофикация (др.-греч. εὐτροφία — хорошее питание) — насыщение водоёмов биогенными элементами, сопровождающееся ростом биологической продуктивности водных бассейнов.