что в воде хорошо растворяется в
Вода как растворитель играет предельно важную роль далеко не только в плане нашего быта. Исследователи давно говорят, что данное волшебное соединение является основой для образования жизни вообще. И именно поэтому его наличие выступает обязательным условием для существования чего-то более сложного, нежели неживая природа.
Растворимость тех или иных химических элементов напрямую связана с существованием воды, так как она чаще всего выступает той средой, которая преобразует все вокруг себя и создает новые формы органической и неорганической материи.
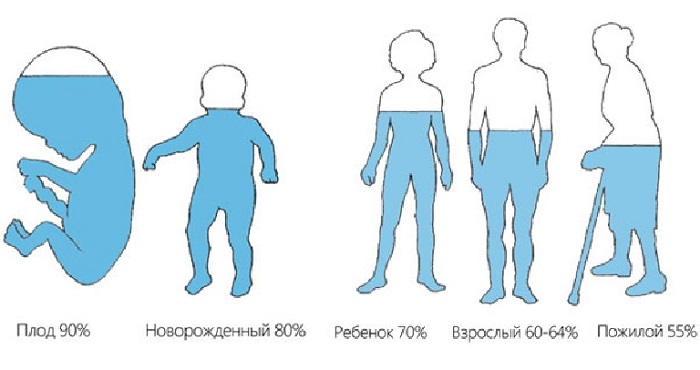
Человек примерно на 70% состоит из воды (имеется ввиду кровь, межклеточная жидкость, плазма крови и прочие вещества), у большинства других существ этот показатель колеблется от 50 до 95%. Очевидно, что свойства данного соединения оказывают решающую роль на происходящие вокруг нас и внутри нас процессы синтеза, регенерации и многие другие.
Это универсальный растворитель, который буквально формирует окружающий мир, постоянно преображает и обновляет его!
Свойства воды как растворителя
Вода – сложное вещество, отличающееся многими уникальными характеристиками, которые нельзя встретить больше нигде.
Она способна растворить большую часть существующих в природе комплексных соединений, содержащих в своей структуре молекулы как с положительными, так и отрицательными ионами одновременно.
При проведении так называемых кинетических исследований все растворы также изготавливаются на основе H2O.
Яркий пример особенности воды – при схожести по своей структуре с метаном CH4, она имеет температуру кипения выше на целых 250 0 С!
Важную роль играет также ее способность выступать одновременно либо донором, либо акцептором частиц водорода, благодаря чему проходят многие химические процессы. Химия говорит нам еще и о том, что вода выступает идеальным растворителем для диссоциирующих соединений.
Интересно отметить, что по причине высокого уровня диэлектрической проницаемости, вода отлично экранирует электрические поля ионов друг от друга. Благодаря этому притяжение противоположно заряженных частиц в воде снижается примерно в 80 раз.
Какие вещества растворяются в воде
Даже если школьник ходит только в 3 класс, он наверняка может привести примеры материалов, которые боятся контакта с водой, или, другими словами, растворяются в ней и теряют свои свойства.
Вот перечень только некоторых веществ такого типа:
К хорошо растворимым относятся: соль, сахар, сода, хлориды, щелочные металлы и нитраты, а также бромиды. Воздух также претерпевает изменения при контакте с жидкой средой. Крахмал полностью растворим, спирт тоже.
Есть и такие материалы, которые являются нерастворимыми: сульфид меди, стекло, золото, керосин, серебро, растительный жир и многие другие. Правда, при некоторых условиях даже они не способны устоять от такого мощного воздействия.
В организме человека есть целая группа витаминов (С, В1, 2, 3(РР), В12 и другие), которые способны оказывать свое положительное воздействие на здоровье только в контакте с H2O. Это касается также и фолиевой кислоты, биотина и т. д.
Что не растворяется в воде
Существуют такие химические образования, которые не воспринимают воздействия воды в качестве растворителя совсем.
Хороший пример: углерод С, который находится в простом карандаше, многие металлы и сплавы, типа алюминия, а также золото, серебро, медь.
Такая ситуация складывается благодаря тому, что между молекулами и атомами нерастворимых веществ действуют сильные связи, которые водород разрушить не в состоянии. Полярное состояние молекулы также способствует большей прочности материала, который состоит из таких частиц.
Многие вещи, которые мы видим вокруг себя в быту, также являются нерастворимыми. Очень популярный пример – пластик.
В мировом океане плавает огромное пятно из пластикового мусора, которое ежегодно растет, и количество пластмассы там совершенно не желает уменьшаться естественным путем. Его не могут никак переработать, что очень плохо для всей экосистемы.
Именно поэтому экологи бьют тревогу и в ЕС уже сейчас планируется отказ от целлофановых пакетов, пластиковых стаканчиков и трубочек и тому подобные меры.
Значение воды как растворителя
Как уже упоминалось в начале статьи, рассматриваемые свойства воды являются ключевыми для всей живой и неживой природы нашей планеты.
Если бы она не обладала этими характеристиками, то большинство химических процессов на Земле, в живых организмах, в органической природе бы просто остановилось. Картинка такого мира была бы очень неутешительна – темная пустыня без признаков жизни.
Роль воды настолько огромна, что именно ее определение в далеких планетах и галактиках является для астрономов основным занятием в надежде когда-то отыскать там если не разумное существование, то хотя бы зачатки жизни.
Растворимость
Растворимость (Р, χ или ks) – это характеристика насыщенного раствора, которая показывает, какая масса растворенного вещества может максимально раствориться в 100 г растворителя. Размерность растворимости — г/ 100 г воды. Поскольку мы определяем массу соли, которая приходится на 100 г воды, в формулу растворимости добавляем множитель 100:
здесь mр.в. – масса растворенного вещества, г
mр-ля – масса растворителя, г
Иногда используют обозначение коэффициент растворимости kS.
Задачи на растворимость, как правило, вызывают сложности, так как эта физическая величина для школьников не очень привычна.
Растворимость веществ в различных растворителях меняется в широких пределах.
В таблице приведена растворимость некоторых веществ в воде при 20 o С:
Растворимость, г на 100 г H2O
Растворимость, г на 100 г H2O
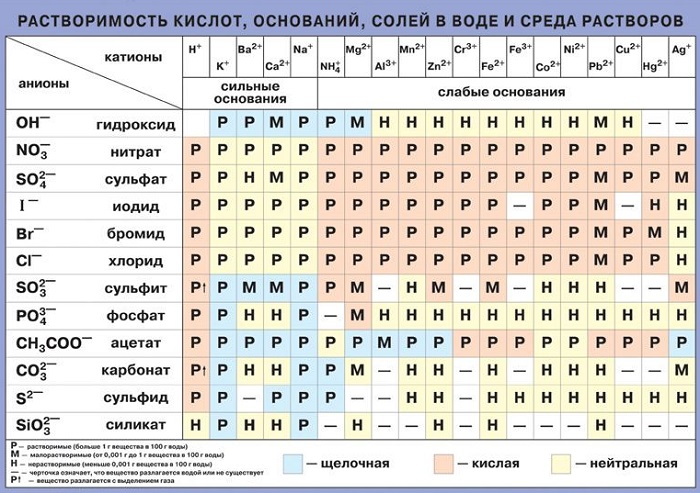
От чего же зависит растворимость веществ? От ряда факторов: от природы растворенного вещества и растворителя, от температуры и давления. В справочных таблицах предлагается вещества делят на хорошо растворимые, малорастворимые и нерастворимые. Такое деление очень условное, поскольку абсолютно нерастворимых веществ нет. Даже серебро и золото растворимы в воде, однако их растворимость настолько мала, что можно пренебречь ей.
Зависимость растворимости от природы растворенного вещества и растворителя*
Большинство солей щелочных металлов и аммония хорошо растворимы в воде. Хорошо растворимы почти все нитраты, нитриты и многие галогениды (кроме галогенидов серебра, ртути, свинца и таллия) и сульфаты (кроме сульфатов щелочноземельных металлов, серебра и свинца). Для переходных металлов характерна небольшая растворимость их сульфидов, фосфатов, карбонатов и некоторых других солей.
Растворимость газов в жидкостях также зависит от их природы. Например, в 100 объемах воды при 20 o С растворяется 2 объема водорода, 3 объема кислорода. В тех же условиях в 1 объеме Н2О растворяется 700 объемов аммиака.
Влияние температуры на растворимость газов, твердых веществ и жидкостей*
Растворение газов в воде вследствие гидратации молекул растворяемого газа сопровождается выделением теплоты. Поэтому при повышении температуры растворимость газов понижается.
Влияние давления на растворимость газов, твердых веществ и жидкостей*
На растворимость твердых и жидких веществ в жидкостях давление практически не оказывает влияния, так как изменение объема при растворении невелико. При растворении газообразных веществ в жидкости происходит уменьшение объема системы, поэтому повышение давления приводит к увеличению растворимости газов. В общем виде зависимость растворимости газов от давления подчиняется закону У. Генри (Англия, 1803 г.): растворимость газа при постоянной температуре прямо пропорциональна его давлению над жидкостью.
Закон Генри справедлив лишь при небольших давлениях для газов, растворимость которых сравнительно невелика и при условии отсутствия химического взаимодействия между молекулами растворяемого газа и растворителем.
Влияние посторонних веществ на растворимость*
В присутствии в воде других веществ (солей, кислот и щелочей) растворимость газов уменьшается. Растворимость газообразного хлора в насыщенном водном растворе поваренной соли в 10 раз меньше. Чем в чистой воде.
Эффект понижения растворимости в присутствии солей называется высаливанием. Понижение растворимости обусловлено гидратацией солей, что вызывает уменьшение числа свободных молекул воды. Молекулы воды, связанные с ионами электролита, уже не являются растворителем для других веществ.
Примеры задач на растворимость
Задача 1. Массовая доля вещества в насыщенном растворе равна 24% при некоторой температуре. Определите коэффициент растворимости этого вещества при данной температуре.
Решение:
Для определения растворимости вещества примем массу раствора равной 100 г. Тогда масса соли равна:
mводы = mр-ра – mр.в. = 100 — 24 = 76 г
χ = mр.в./mр-ля⋅100 = 24/76⋅100 = 31,6 г вещества на 100 г воды.
Еще несколько аналогичных задач:
2. Массовая доля соли в насыщенном растворе при некоторой температуре равна 28,5%. Определите коэффициент растворимости вещества при этой температуре.
3. Определите коэффициент растворимости нитрата калия при некоторой температуре, если массовая доля соли при этой температуре равна 0,48.
4. Какая масса воды и соли потребуется для приготовления 500г насыщенного при некоторой температуре раствора нитрата калия, если его коэффициент растворимости при этой температуре равен 63,9г соли в 100г воды?
Ответ: 194,95 г
5. Коэффициент растворимости хлорида натрия при некоторой температуре составляет 36г соли в 100г воды. Определите молярную концентрацию насыщенного раствора этой соли, если плотность раствора 1,2 г/мл.
6. Какая масса соли и 5% раствора её потребуется для приготовления 450г насыщенного при некоторой температуре раствора сульфата калия, если его коэффициент растворимости при этой температуре равен 439г/1000г воды?
7. Какая масса нитрата бария выделится из раствора, насыщенного при 100ºС и охлаждённого до 0ºС, если во взятом растворе было 150мл воды? Коэффициент растворимости нитрата бария при температурах 0ºС и 100ºС равен соответственно 50г и 342г в 100г воды.
8. Коэффициент растворимости хлорида калия при 90ºС равен 500г/л воды. Сколько граммов этого вещества можно растворить в 500г воды при 90ºС и какова его массовая доля в насыщенном растворе при этой температуре?
9. В 500г воды растворено при нагревании 300г хлорида аммония. Какая масса хлорида аммония выделится из раствора при его охлаждении до 50ºС, если коэффициент растворимости соли при этой температуре равен 50г/л воды?
Растворение в воде: что, как и при каких условиях
Вода — универсальный растворитель, приспособленный к любому виду жизнедеятельности. Она растворяет почти любые вещества, в частности ионные и полярные соединения. Уникальные свойства воздействия характеризуются высокой диэлектрической проницаемостью. В природе вода содержит массу веществ и соединений, попавших в неё так или иначе.
Процесс растворения
На первый взгляд, процесс распада прост, но его суть гораздо сложнее, чем выглядит. Именно поэтому существуют вещества, растворимые в воде и нерастворимые в других жидкостях. Создание раствора связано с физическими процессами: диффузия описывает само разжижение частиц в результате размешивания. Гидратация является процессом, при котором образуются химические связи воды с добавленным веществом.
Растворение веществ характеризуется:
Доказательством произошедшего смешивания выступает изменение цвета раствора. Например, примесь сульфата меди (которая изначально белого цвета) окрашивает воду в интенсивный голубой цвет. Если за окраску отвечают химические свойства оснований, то выделение теплоты происходит из-за физических причин. Таким образом, это полностью физико-химический процесс.
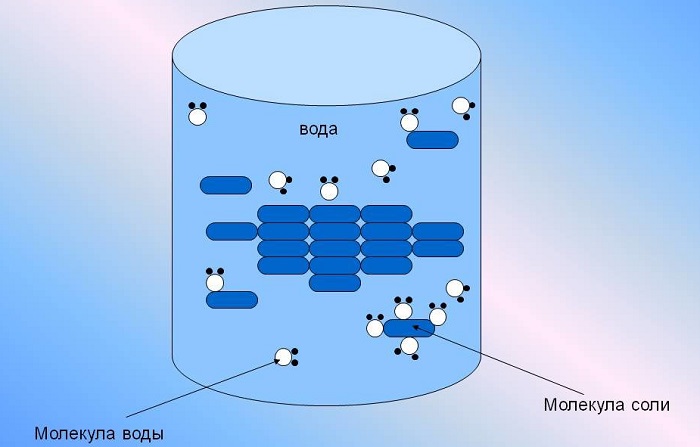
Что такое раствор
Раствор — однородная смесь веществ с растворителем. Растворимые вещества распадаются под действием полярных молекул воды на мелкие частицы, в результате смешиваясь до полной однородности. Водные растворы бывают бесцветными и окрашенными, но неизменно одно — они прозрачные вне зависимости от цвета.
Не имеет значения, добавлять воду в какое-то вещество или сыпать его. Также процесс постепенно произойдет и без вмешательства (размешивания), в некоторых случаях образуется видимый осадок. В других случаях, раствор окрашивается в цвет добавленного вещества, но обязательно остается прозрачным на просвет.
Не растворившиеся вещества оседают на дно плотным слоем под давлением воды. Либо могут оставаться на поверхности в виде неравномерных частиц. Жидкости образуют слои, поскольку имеют разную плотность с водой. Например, растительное масло образует пленку на поверхности.
Какие вещества растворяются в воде, а какие — нет
Вода действительно универсальна и уникальна по своим свойствам. Иногда требуется сильнее перемешать, чтобы добиться полного разрушения частиц, но в большинстве своем вода размывает любые соединения. Однако есть вещества, которые не подвластны даже ей.
Существует условие, по которому количество воды должно быть превышающим, чтобы вещества именно разошлись, а не осели на дно. На примере пищевой соли: при добавлении большого количества, она перестает растворяется и образует плотный, напоминающий камень, слой.
Кроме того, от некоторых веществ жидкость можно очистить, от других — нет. Так, например, ртуть в воде растворяется и процесс очищения невозможен. Другие похожие вещества из встречаемых в быту: поваренная и морская соль, сахар любого типа, пищевая сода, крахмал. Они невидимые и склоны к окрашиванию воды, но частицы настолько мелкие, что они попросту проходят фильтрацию вместе с раствором. Сыпучие вещества вроде песка или глины не растворяются, потому воду можно отфильтровать.
Классификация способности по веществам:
Отдельная группа — жирорастворимые и водорастворимые витамины. Они необходимы для здоровья человека, а за счет собственной способности растворяться, накапливаются в организме из-за содержания воды. К водорастворимому типу относятся витамины С, В1, В2, В3 (РР), В6, В12, фолиевая кислота, пантотеновая кислота и биотин.
Таким образом, вода как растворитель весьма уникальна. Список сложно и нерастворимых веществ достаточно короткий, чтобы говорить об универсальности воды в качестве растворителя.
Что растворено в воде

Наталья Резник / «Здоровье-инфо»
Моря и океаны
Моря и океаны покрывают более двух третей поверхности Земли. Вода в них соленая: 1 л морской воды содержит 35 г солей. В основном это хлорид натрия, но есть и сульфат магния; среди множества других ионов в морской воде встречаются бром, иод, никель, олово, цинк, медь, серебро и золото. Независимо от глубины или географической точки, состав воды мирового океана весьма постоянен, хотя соленость ее может быть разной. Средиземное море, например, содержит до 40 г солей на литр, потому что сильное испарение с его поверхности не компенсируется притоком пресной воды из рек.
Пить морскую воду нельзя не только из-за невозможной горечи. Ее потребление приводит к обезвоживанию. В составе морской воды слишком много солей, для выведения которых организм вынужден использовать собственную воду. Если потерпевший кораблекрушение решит от отчаяния утолить жажду морской водой, при потреблении 500 мл он потеряет не менее 800 мл мочи.
Реки и озера

Жесткость воды имеет физиологическое значение. Избыток кальция поступает вместе с водой в организм и откладывается в суставах и на стенках сосудов в виде труднорастворимого карбоната.
Вода вымывает из почвы органические вещества – гумусовые кислоты, которые образуют взвесь. Они придают воде буроватый оттенок, неприятный привкус и запах. Цветность воды зависит и от присутствия некоторых ионов, в том числе трехвалентного железа и марганца. А вообще в современных реках может оказаться все, что человек выльет в воду или в почву: пестициды, радиоактивные элементы, соли тяжелых металлов, кислоты и нефтепродукты, детергенты, аммиак.
Каждый ребенок знает, что речную воду надо кипятить, потому что в ней микробы. Количество микроорганизмов определяет общее микробное число, то есть количество жизнеспособных бактерий разных видов в 1 мл воды. А видовой состав бактерий может быть разным и зависит от водной флоры и фауны, растительности на берегах водоема и многих других причин. Однако чем больше общее микробное число, тем выше вероятность, что среди микроорганизмов окажутся патогенные виды.
На состав речной воды влияют выпадающие осадки, таяние снегов, половодье и притоки, впадающие в более крупную реку или озеро, а также время года. Зимой в воде относительно много сульфидов, нитритов и некоторых гуминовых веществ, зато мало бактерий.
Колодцы, родники и скважины
Еще один традиционный источник питьевой воды – колодец. Его глубина обычно составляет 5-10 м, а питается он подпочвенными водами, которые подвержены загрязнениям. Все, что попадает в почву – нитраты, нитриты, детергенты, пестициды и тяжелые металлы, – может оказаться в колодезной воде.

Есть еще родники, бьющие из глубин. Вода в них не лучше колодезной, так как поступает из того же водоносного слоя. Состав ключевой воды зависит от паводков, ливней, загрязнения местности.
Чистая дождевая вода
Дождевая вода всегда была синонимом воды чистой – она льется прямо с неба, примесям в ней взяться, вроде бы, неоткуда. Однако небольшое количество солей содержит даже самый чистый дождик. В дождевой воде растворяется атмосферный углекислый газ, поэтому она всегда немного подкислена. А промышленные выбросы – сернистый газ и закись азота – делают дождевую воду еще более кислой. Еще грязнее она становится, когда стекает в подставленные бочки с крыш или деревьев. Вода смывает с древесных крон пыль, экскременты насекомых и выделения растений, вымывает из растений разные элементы (например, углерод, кальций, марганец).
Вода из-под крана
В наше время большинство людей набирает воду не из колодца или дождевой бочки, а из-под крана. С одной стороны, водопроводная вода – это гарантия качества. Воду предварительно очищают от взвешенных ила и песка, органики и неприятных запахов, обеззараживают и даже умягчают. Но добиться полного удаления всех примесей невозможно. Кроме того, для очистки и обеззараживания воду хлорируют, что чревато неприятными последствиями. Дело в том, что взаимодействуя с остатками органики, хлор образует вредные вещества, в том числе хлороформ, четыреххлористый углерод и диоксины, которые провоцируют рак печени, мочевого пузыря и желудка. Диоксины также попадают в воду из технических стоков и атмосферного воздуха (они содержатся в выхлопных газах, табачном дыме и дыме, который образуется при сжигании пластикового мусора). Диоксины сохраняются в воде 10-15 лет, а в человеческом организме – 6-8 лет.
На многих водопроводных станциях воду фторируют, а избыток фтора вреден для эмали зубов. В водопроводной воде могут также оказаться сульфиды, сульфаты, а также промышленные загрязнения в виде хрома, никеля, ртути, свинца, мышьяка, меди, радионуклидов.

Даже пластик нельзя считать идеальным материалом, потому что при производстве пластиковых труб используют много органических веществ, которые могут попадать в воду. Кроме того, любые трубы – приют для микроорганизмов. Полностью очистить воду от бактерий невозможно. Общее микробное число питьевой воды не должно превышать 100 на 1 л, но микроорганизмы скапливаются в малейших неровностях труб и там размножаются.
Так что люди, которые хотят пить гарантированно чистую воду, должны ее как можно лучше очищать уже после того, как наберут из-под крана.
Вода, универсальный растворитель
Строение воды
Вода — уникальное вещество и все её аномальные свойства: высокая температура кипения, значительная растворяющая и диссоциирующая способность, малая теплопроводность, высокая теплота испарения и другие обусловлены строением её молекулы и пространственной структурой.
У отдельно взятой молекулы воды есть качество, которое проявляется только в присутствии других молекул: способность образовывать водородные мостики между атомами кислорода двух оказавшихся рядом молекул, так, что атом водорода располагается на отрезке, соединяющем атомы кислорода. Свойство образовывать такие мостики обусловлено наличием особого межмолекулярного взаимодействия, в котором существенную роль играет атом водорода. Это взаимодействие называется водородной связью.
Каждая из присоединённых к данной молекул воды сама способна к присоединению дальнейших молекул. Этот процесс можно называть «полимеризацией». Если только одна из двух возможных связей участвует в присоединении следующей молекулы, а другая остаётся вакантной, то «полимеризация» приведёт к образованию либо зигзагообразной цепи, либо замкнутого кольца. Наименьшее кольцо, по-видимому, может состоять из четырёх молекул, но величина угла 90° делает водородные связи крайне напряжёнными. Практически ненапряжёнными должны быть пятизвенные кольца (угол 108 о ) шестизвенные (угол 120° ), также как и семизвенные – напряжённые.
Рассмотрение реальных структур гидратов показывает, что, действительно, наиболее устойчиво шестизвенное кольцо, находимое в структурах льдов. Плоские кольца являются привилегией клатратных гидратов, причём во всех известных структурах чаще всего встречаются плоские пятизвенные кольца из молекул воды. Они, как правило, чередуются во всех структурах клатратных гидратов с шестизвенными кольцами, очень редко с четырёхзвенными, а в одном случае — с плоским семизвенным.
В целом структура воды представляется как смесь всевозможных гидратных структур, которые могут в ней образоваться.
Уникальные свойства воды интересуют людей с древнейших времен. Это единственное вещество на Земле, которое при нормальных для человека условиях может находится сразу в трех агрегатных состояниях — жидком, твердом и газообразном.
Лед, плотность, кристаллизация. При замерзании плотность воды уменьшается, поэтому лед всплывает. Благодаря этому уникальному свойству воды озера и реки не промерзают до дна, и водные обитателимогут пережить зиму.
Уменьшение плотности льда происходит вследствие увеличения объема. Именно поэтому замерзающая вода рвет водопроводные трубы.Вода может быть переохлаждена до отрицательных температур без перехода в твердое состояние. Однако при малейшем сотрясении или попадании каких-либо частиц переохлажденная вода быстро превращается в лед. Посторонние частицы, пузырьки воздуха в этом случае становятся центрами кристаллизации.
Высокая скрытая теплота испарения воды спасает водоемы от быстрого высыхания жарким летом. А высокая скрытая теплота плавления защищает нас весной от слишком быстрого таяния огромного количества снега, скопившегося за зиму.
Растворитель. Вода является универсальным растворителем. Это качество объясняется особым строением молекулы воды. Молекулы сильно поляризованы, благодаря чему легко входят во взаимодействие с молекулами других веществ. Именно свойство сильного растворителя затрудняет получение абсолютно химически чистой воды.
Высокое поверхностное натяжение воды наблюдал каждый из нас. Вспомните, как по поверхности пруда бегают водомерки. Даже не очень тяжелый предмет из несмачиваемого материала может оставаться на поверхности воды. В отсутствии гравитации капля воды стремится принять идеальную форму шара. Кстати, еще одно полезное свойство воды — способность поглощать микроволновое излучение — позволяет нам разогревать продукты в микроволновой печи.
Видео
Какие вещества растворяются в воде
Даже если школьник ходит только в 3 класс, он наверняка может привести примеры материалов, которые боятся контакта с водой, или, другими словами, растворяются в ней и теряют свои свойства.
Вот перечень только некоторых веществ такого типа:
К хорошо растворимым относятся: соль, сахар, сода, хлориды, щелочные металлы и нитраты, а также бромиды. Воздух также претерпевает изменения при контакте с жидкой средой. Крахмал полностью растворим, спирт тоже.
Есть и такие материалы, которые являются нерастворимыми: сульфид меди, стекло, золото, керосин, серебро, растительный жир и многие другие. Правда, при некоторых условиях даже они не способны устоять от такого мощного воздействия.
В организме человека есть целая группа витаминов (С, В1, 2, 3(РР), В12 и другие), которые способны оказывать свое положительное воздействие на здоровье только в контакте с H2O. Это касается также и фолиевой кислоты, биотина и т. д.
Характеристики универсального растворителя
полярность
Это большая часть того, почему вода является универсальным растворителем. Полярность – это неравномерность распределения электронов в молекула, что приводит к одной молекуле, имеющей две противоположные стороны; один отрицательный и один положительный. Теперь вода имеет молекулярную формулу H2O, поэтому каждая молекула воды имеет два атома водорода и один атом кислорода, как вы можете видеть на диаграмме ниже. Атомы водорода не находятся на противоположных сторонах друг друга, и они несут частичный положительный заряд. Это означает, что они создают положительно заряженную часть молекулы, в то время как кислородный конец создает отрицательно заряженную часть. Эта полярность означает, что вода может присоединяться и, следовательно, растворять полярные и ионные (заряженные) вещества.
Высокая удельная теплоемкость
Количество энергии, необходимое для повышения температуры одного грамма воды на 1 градус Цельсия, является ее удельной теплотой, и при одной калории на грамм она намного выше, чем удельная теплоемкость большинства жидкостей. Это хорошая новость для нас, так как мы на 60% состоим из воды, и мы не смогли бы выжить, если бы наши тела сильно и быстро остыли и нагрелись. Это также имеет решающее значение для выживания всех других организмов, в том числе водных организмов. Это означает, что океаны и реки не замерзают постоянно или не испаряются при изменении температуры. Если вода не может стабилизировать свою температуру, энергия, которая выделяется во время обмена веществ в живых организмах, может привести к перегреву и смерти.
Уникальные свойства плотности и температуры
Когда мы помещаем кубик льда в воду, он плавает, и, к счастью, то же самое относится и к айсбергу. Если бы лед был более плотным, чем вода, он бы постоянно замерзал наверху, а затем опускался, пока все водоемы не превратятся в лед, уничтожая всю жизнь. Вода также существует в виде газа, жидкости и твердого вещества в очень небольшом диапазоне температур, что означает, что мы можем найти ее во всех трех формах на Земле в зависимости от того, где мы находимся, и часто в одном и том же месте. Это не часто встречающаяся собственность.
Что не растворяется в воде
Существуют такие химические образования, которые не воспринимают воздействия воды в качестве растворителя совсем.
Хороший пример: углерод С, который находится в простом карандаше, многие металлы и сплавы, типа алюминия, а также золото, серебро, медь.
Такая ситуация складывается благодаря тому, что между молекулами и атомами нерастворимых веществ действуют сильные связи, которые водород разрушить не в состоянии. Полярное состояние молекулы также способствует большей прочности материала, который состоит из таких частиц.
Многие вещи, которые мы видим вокруг себя в быту, также являются нерастворимыми. Очень популярный пример – пластик.
В мировом океане плавает огромное пятно из пластикового мусора, которое ежегодно растет, и количество пластмассы там совершенно не желает уменьшаться естественным путем. Его не могут никак переработать, что очень плохо для всей экосистемы.
Именно поэтому экологи бьют тревогу и в ЕС уже сейчас планируется отказ от целлофановых пакетов, пластиковых стаканчиков и трубочек и тому подобные меры.
Почему вода считается универсальным растворителем?
Наше тело работает через химические изменения, которые происходят на клеточном уровне. Точно так же растения и животные страдают химическими изменениями в своих организмах..
Эти изменения происходят в водных растворах или растворах, в которых вода является основным растворителем..
Поскольку вода обладает свойствами полярности (отрицательный и положительный заряд) и способностью образовывать водородные связи, она считается отличным растворителем.
Способность воды растворять большое разнообразие молекул является ключом для этих химических реакций, происходящих в организмах. Отсюда важность воды для жизни на планете..
Благодаря своей способности растворять большое количество растворенных веществ, больше, чем любая другая жидкость, вода известна как «универсальный растворитель». Важно отметить, что не все вещества хорошо растворяются в воде, например, масла.
Молекулы масел не имеют областей заряда ни положительных, ни отрицательных, поэтому они не притягиваются молекулами воды.
Молекулы воды состоят из атомов водорода и кислорода. Водород имеет положительный заряд, а кислород — отрицательный, что позволяет молекулам воды притягиваться ко многим различным типам молекул и, следовательно, способно растворять их.
Есть и другие свойства воды, такие как поверхностное натяжение, ее уникальная плотность и температура, которые позволяют воде быть отличным растворителем..
Вода существует в трех возможных формах, таких как газ, жидкость или твердое вещество, что обычно не встречается в других растворителях.