что в переводе с греческого означает галогены
Галогены
Элементы главной подгруппы VII группы периодической системы – фтор, хлор, бром, йод и астат – называют галогенами, что в переводе с греческого означает «рождающие соли». Действительно, продукты взаимодействия галогенов с металлами представляют собой соли.
Одна из дорог, ведущих в Рим к местам соледобычи, так и называлась – Via Salaria (Соляная дорога). Это древнее название сохранилось и по сей день. Почему же обычной поваренной соли, знакомой каждому с детства, воздают такие почести?
Сегодня она общедоступна, а в древности ее ценили наравне с золотом: римским легионерам порой платили не деньгами, а поваренной солью. Интересно, что английское слово salary – «зарплата» происходит от латинского sal (соль).

В древности соль добывали из соляных озёр, расположенных неподалеку от устья реки Тибр. Позже ее стали получать из морской воды. Для этого участки суши, затопляемые во время прилива, специально огораживали. По мере испарения воды первой кристаллизовалась поваренная соль. Ее собирали, а остававшийся рассол, содержащий прочие соли, выливали обратно в море.
Соляную кислоту HCl в Средние века называли соляным спиртом. Впервые она упоминается в сочинениях немецкого алхимика Василия Валентина во второй половине XV в. Им описан метод получения соляного спирта сухой перегонкой смеси, состоящей из купороса, квасцов и поваренной соли. Алхимики изучали действие соляного спирта на металлы и оксиды. А вот состав этого вещества долгое время был для учёных загадкой.
Как открывали галогены
Согласно теории кислот, выдвинутой А.Л. Лавуазье, особые их свойства обусловлены присутствием не водорода, а кислорода. Лавуазье высказал гипотезу, что соляная кислота содержит вместе с кислородом (а возможно, и водородом) еще и новый элемент, который он назвал мурием (от лат. muria – «рассол»). Сегодня известно, что этот элемент – хлор.
Свободный хлор (от греч. «хлорос» — «жёлто-зеленый») впервые получен в 1774 г. К.В.Шееле действием соляной кислоты на минерал пиролюзит MnO2:
Но еще долго хлор считали «окисленной соляной кислотой», оксидом элемента мурия, основываясь на свойстве этого газа взаимодействовать с растворами щелочей, подобно кислотным оксидам. В течение многих лет учёные безуспешно пытались восстановить «оксид мурия», пока наконец Г. Дэви в 1810 г. не высказал предположение, что это новое простое вещество. Дэви дал ему название «хлорин» (Chlorine). Оно до сих пор используется в английском языке. Слово «хлор» предложил в 1812 г. Ж.Л. Гей-Люссак. Тогда же была установлена формула соляной кислоты, а кислородную теорию кислот сменила водородная, согласно которой обязательно составной частью является водород.
Флюорит, или плавиковый шпат, CaF2 издревле использовали в качестве флюса – вещества, которое при выплавке металлов добавляют в руду, чтобы понизить ее температуру плавления. Раствор, образующийся при воздействии на флюорит серной кислоты, содержит плавиковую кислоту HF. Уже в XVII в. он служил для вытравливания узоров на стеклянной посуде. В чистом виде эту кислоту в 1771 г. выделил Шееле, а ее состав установил французский ученый Андре Мари Ампер в 1810 г. Он же предложил назвать содержащийся в этой кислоте элемент фтором (от греч. «фторос» — «гибель»).

Бром открыт в 1826 г. французским химиком А.Ж. Баларом. Это была его первая самостоятельная работа, и так случилось, что она увенчалась выдающимся результатом – обнаружением нового химического элемента. Пропуская хлор через соляной рассол, полученный при упаривании морской воды, Балар заметил, что раствор окрашивается в бурый цвет. Современный химик без труда объяснит это явление: хлор вытесняет бром из бромидов, содержащихся в морской воде: 2KBr + Cl2 = 2KCl + Br2.

По иронии судьбы знаменитый немецкий химик Юстус Либих за несколько лет до Балара фактически держал в руках водный раствор брома, но не обратил на него внимания, приняв за соединение хлора с йодом. Досадуя на свою самонадеянность, Либих впоследствии говорил: «Не Балар открыл бром, а бром открыл Балара».
Комиссия Парижской академии наук рекомендовала назвать новый элемент, исходя из свойств его соединений, аналогично названиям других галогенов. Таким отличительным свойством учёные сочли резкий неприятный запах этого вещества. Название элемента образовано от греческого слова «бромос», что означает «зловоние».
Позднее бром стали получать кипячением подкисленного рассола с пиролюзитом MnO2:
В 1811 г. французский химик Бернар Куртуа из золы морских водорослей выделил йод (от греч. «иодес» — «фиолетовый», по цвету паров).
Существование самого тяжелого из галогенов – астата было предсказано Д.И. Менделеевым, который назвал его экаиодом, т.е. первым аналогом йода. Однако получен он был лишь в 1940 г. группой американских ученых из Калифорнийского университета. Все изотопы астата радиоактивны и имеют небольшой период полураспада – не более 8,1часа. Отсюда и название элемента, образованное от греческого «астатос» — «неустойчивый».
Общие физические и химические свойства галогенов
Молекулы простых веществ-галогенов при обычных условиях имеют состав Г2, т.е. F2, Cl2, Br2, I2. Все галогены имеют характерный запах, ядовиты.
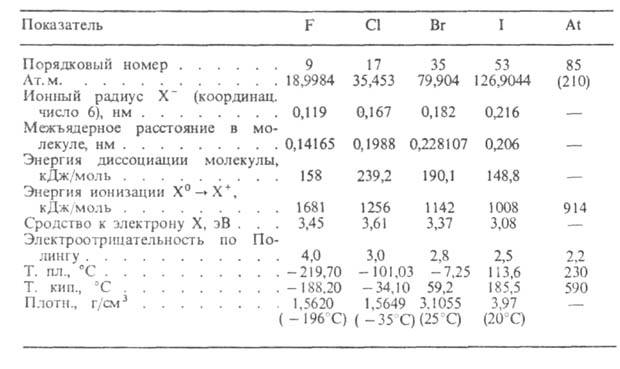
Сверху вниз в подгруппе с ростом порядкового номера закономерно изменяются физические свойства простых веществ-галогенов: температура кипения и плавления, агрегатное состояние.
Фтор – газ светло – зеленого цвета; хлор – легко сжижающийся газ желто-зеленого цвета; бром – тяжелая жидкость красно-бурого цвета; йод – твердое кристаллическое вещество с металлическим блеском. Растворимость простых веществ-галогенов в воде в подгруппе сверху вниз уменьшается. Фтор активно взаимодействует с водой, хлор – сравнительно мало растворим в воде, еще менее растворимы в воде бром и йод.
Так как у атомов галогенов на внешнем электронном слое имеется один неспаренный электрон, для них характерна валентность I.
Кроме фтора, у атомов всех галогенов в возбужденном состоянии может увеличиваться число неспаренных электронов, а поэтому соответственно числу неспаренных электронов атомы галогенов в соединениях могут проявлять валентность III, V, VII.
Окислительная способность атомов и молекул галогенов сверху вниз в подгруппе уменьшается от фтора к йоду, так как с увеличением радиуса атома способность галогена присоединять электроны уменьшается, т.е. уменьшаются неметаллические свойства галогенов. Фтор – самый сильный окислитель, так как атом фтора имеет наименьший радиус по сравнению с атомами других галогенов.
Окислительную активность галогенов несложно сопоставить, изучив реакции вытеснения одних галогенов другими из водных растворов галогенидов. Наблюдается такая закономерность: галоген с меньшим порядковым номером вытесняет из солей галоген с большим порядковым номером. Например, бром вытесняет йод из йодидов: Br2 + 2KI = I2 + 2KBr, но не реагирует с хлорид-ионами.
Все галогены легко взаимодействуют с водородом по уравнению: Г2 + Н2 = 2НГ
Галогеноводороды (HF – фтороводород, HCl – хлороводород, HBr – бромоводород, HI – йодоводород) – это газообразные соединения, легко растворяются в воде. Водные растворы галогеноводородов являются кислотами: HF – фтороводородная (плавиковая), HCl – хлороводородная (соляная), HBr – бромоводородная, HI – йодоводородная.
В ряду кислот HF→ HCl→ HBr→ HI происходит усиление кислотных свойств. Это можно объяснить тем, что сверху вниз в подгруппе галогенов с увеличением заряда ядра атома увеличиваются радиусы атомов. Из всех бескислородных кислот йодоводородная кислота является самой сильной.
Известен ряд соединений галогенов с кислородом. Однако все эти соединения неустойчивы, не получаются при непосредственном взаимодействии элементов с кислородом и могут быть получены только косвенным путем. Из кислородсодержащих соединений наиболее устойчивы соли кислородсодержащих кислот. Во всех кислородсодержащих соединениях галогены, кроме фтора, проявляют положительные степени окисления +1, +3, +5 и +7.
В ряду кислородсодержащих кислот HClO→ HClO2→ HClO3→ HClO4 наблюдается усиление кислотных свойств.
Скачать:
Скачать бесплатно реферат на тему: «Галогены» Галогены.docx (Одна Загрузка)
Скачать рефераты по другим темам можно здесь
*на изображении записи фотография минерала флюорита
Галогены
К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At, а также (формально) искусственный элемент унунсептий Uus.
| Фтор F | Хлор Cl | Бром Br | Иод I |
|---|---|---|---|
 |  |  |
Все галогены — неметаллы. На внешнем энергетическом уровне 7 электронов, являются сильными окислителями. При взаимодействии с металлами возникает ионная связь, и образуются соли. Галогены, (кроме F) при взаимодействии с более электроотрицательными элементами, могут проявлять и восстановительные свойства вплоть до высшей степени окисления +7.
Содержание
Распространённость элементов и получение простых веществ
Как уже было сказано выше, галогены имеют высокую реакционную способность, поэтому встречаются в природе обычно в виде соединений.
Их распространённость в земной коре уменьшается при увеличении атомного радиуса от фтора к иоду. Количество астата в земной коре измеряется граммами, а унунсептий в природе отсутствует. Фтор, хлор, бром и иод производятся в промышленных масштабах, причем хлор производится в гораздо больших количествах.
В природе эти элементы встречаются в основном в виде галогенидов (за исключением иода, который также встречается в виде иодата натрия или калия в месторождениях нитратов щелочных металлов). Поскольку многие хлориды, бромиды и иодиды растворимы в воде, то эти анионы присутствуют в океане и природных рассолах. Основным источником фтора является фторид кальция, который очень малорастворим и находится в осадочных породах (как флюорит CaF2).
Основным способом получения простых веществ является окисление галогенидов. Высокие положительные стандартные электродные потенциалы Eo(F2/F − ) = +2,87 В и Eo(Cl2/Cl − ) = +1,36 В показывают, что окислить ионы F − и Cl − можно только сильными окислителями. В промышленности применяется только электролитическое окисление. При получении фтора нельзя использовать водный раствор, поскольку вода окисляется при значительно более низком потенциале (+1,32 В) и образующийся фтор стал бы быстро реагировать с водой. Впервые фтор был получен в 1886 г. французским химиком Анри Муассаном при электролизе раствора гидрофторида калия KHF2 в безводной плавиковой кислоте.
В промышленности хлор в основном получают электролизом водного раствора хлорида натрия в специальных электролизёрах. При этом протекают следующие реакции:
полуреакция на аноде: 
полуреакция на катоде:
Окисление воды на аноде подавляется использованием такого материала электрода, который имеет более высокое перенапряжение по отношению к O2, чем к Cl2 (таким материалом оказался катодное и анодное пространства разделены полимерной ионообменной мембраной. Мембрана позволяет катионам Na + переходить из анодного пространства в катодное. Переход катионов поддерживает электронейтральность в обеих частях электролизёра, так как в течение электролиза отрицательные ионы удаляются от анода (превращение 2Cl − в Cl2) и накапливаются у катода (образование OH − ). Перемещение OH − в противоположную сторону могло бы тоже поддерживать электронейтральность, но ион OH − реагировал бы с Cl2 и сводил на нет весь результат.
Физические свойства галогенов
| Простое вещество | Температура плавления, °C | Температура кипения, °C |
| F2 | −220 | −188 |
| Cl2 | −101 | −34 |
| Br2 | −7 | 58 |
| I2 | 113,5 | 184,885 |
| At2 | 244 | 309 [2] |
Химические свойства галогенов
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к астату. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например:
2Al + 3F2 = 2AlF3 + 2989 кДж, 2Fe + 3F2 = 2FeF3 + 1974 кДж.
Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) — все реакции при этом сильно экзотермические, например:
При нагревании фтор окисляет все другие галогены по схеме
где Hal = Cl, Br, I, At, причем в соединениях HalF степени окисления хлора, брома, иода и астата равны +1.
Наконец, при облучении фтор реагирует даже с инертными (благородными) газами:
Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер:
Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Для сравнения приведем уравнения реакций хлора с теми же простыми веществами, что и для фтора:
2Al + 3Cl2 = 2AlCl3(кр) + 1405 кДж, 2Fe + ЗCl2 = 2FeCl3(кр) + 804 кДж, Si + 2Cl2 = SiCl4(Ж) + 662 кДж, Н2 + Cl2 = 2HCl(г)+185кДж.
Особый интерес представляет реакция с водородом. Так, при комнатной температуре, без освещения хлор практически не реагирует с водородом, тогда как при нагревании или при освещении (например, на прямом солнечном свету) эта реакция протекает со взрывом по приведенному ниже цепному механизму:
Cl2 + hν → 2Cl, Cl + Н2 → HCl + Н, Н + Cl2 → HCl + Cl, Cl + Н2 → HCl + Н и т. д.
Возбуждение этой реакции происходит под действием фотонов ( hν ), которые вызывают диссоциацию молекул Cl2 на атомы — при этом возникает цепь последовательных реакций, в каждой из которых появляется частица, инициирующая начало последующей стадии.
Реакция между Н2 и Cl2 послужила одним из первых объектов исследования цепных фотохимических реакций. Наибольший вклад в развитие представлений о цепных реакциях внёс русский учёный, лауреат Нобелевской премии (1956 год) Н. Н. Семёнов.
Хлор вступает в реакцию со многими сложными веществами, например замещения и присоединения с углеводородами:
Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:
а также обратимо реагирует с водой:
Cl2 + Н2О = HCl + HClO — 25 кДж.
Хлор, растворяясь в воде и частично реагируя с ней, как это показано выше, образует равновесную смесь веществ, называемую хлорной водой.
Заметим также, что хлор в левой части последнего уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала −1 (в HCl), у других +1 (в хлорноватистой кислоте HOCl). Такая реакция — пример реакции самоокисления-самовосстановления, или диспропорционирования.
Хлор может таким же образом реагировать (диспропорционировать) со щелочами:
Cl2 + 2NaOH = NaCl + NaClO + Н2О (на холоде), 3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2О (при нагревании).
Химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора.
Для примера приведем реакции взаимодействия брома с кремнием и водородом:
Si + 2Br2 = SiBr4(ж) + 433 кДж, Н2 + Br2 = 2HBr(г) + 73 кДж.
Являясь более «мягким» реагентом, бром находит широкое применение в органической химии.
Отметим, что бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду», тогда как иод практически в воде не растворим и не способен её окислять даже при нагревании; по этой причине не существует «иодной воды». Но иод способен растворяться в растворах иодидов с образованием комплексных анионов:
Образующийся раствор называется раствором Люголя.
Иод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие же иода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
Таким образом, химическая активность галогенов последовательно уменьшается от фтора к астату. Каждый галоген в ряду F — At может вытеснять последующий из его соединений с водородом или металлами, то есть каждый галоген в виде простого вещества способен окислять галогенид-ион любого из последующих галогенов. Астат ещё менее реакционноспособен, чем иод. Но и он реагирует с металлами (например с литием):
2Li + At2 = 2LiAt — астатид лития.
ГАЛОГЕНЫ
Полезное
Смотреть что такое «ГАЛОГЕНЫ» в других словарях:
ГАЛОГЕНЫ — ГАЛОГЕНЫ, химические элементы VII группы периодической системы: фтор F, хлор Cl, бром Br, иод I и астат At. Фтор и хлор газы, бром жидкость, остальные кристаллы. Все галогены, кроме At, широко распространены в природе входят в состав многих… … Современная энциклопедия
ГАЛОГЕНЫ — ГАЛОГЕНЫ, элементы (ФТОР, ХЛОР, БРОМ, ЙОД и АСТАТ), принадлежащие к VII группе периодической таблицы. Они реагируют с большинством других элементов и органическими соединениями. Химическая активность падает от начала к концу группы. Галогены… … Научно-технический энциклопедический словарь
ГАЛОГЕНЫ — (устар. выражение галоиды) химические элементы фтор F, хлор Cl, бром Br, иод I и астат At, составляющие главную подгруппу VII группы периодической системы Менделеева. Названы от греческих hals соль и genes рождающий (при соединении с металлами… … Большой Энциклопедический словарь
Галогены — фтор, хлор, бром, йод; входят в VII группу периодической системы. Все члены группы образуют соединения с водородом, причем связь их повышается с уменьшением атомной массы; температура образования различных солей уменьшается с увеличением атомной… … Российская энциклопедия по охране труда
ГАЛОГЕНЫ — общее название пяти хим. элементов, составляющих VII подгруппу Периодической системы элементов Д. И. Менделеева, фтора, хлора, брома, йода и астата. Все Г. неметаллы, их молекулы двухатомны; Г. реагируют со всеми простыми веществами, являются… … Большая политехническая энциклопедия
ГАЛОГЕНЫ — ПОДГРУППА VIIA. ГАЛОГЕНЫ ФТОР, ХЛОР, БРОМ, ИОД, АСТАТ Галогены и особенно фтор, хлор и бром имеют большое значение для промышленности и лабораторной практики как в свободном состоянии, так и в виде различных органических и неорганических… … Энциклопедия Кольера
Галогены — В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете … Википедия
галогены — ов; мн. (ед. галоген, а; м.). [от греч. hals соль и genesis род, происхождение]. Группа химических элементов (фтор, хлор, бром, йод и др.), образующих соли при соединении с металлами. ◁ Галогенный, ая, ое. Г ые соединения. Г ая лампа (лампа… … Энциклопедический словарь
галогены — halogenai statusas T sritis chemija apibrėžtis F, Cl, Br, I, (At). atitikmenys: angl. halogens; haloid elements; haloids rus. галогены … Chemijos terminų aiškinamasis žodynas
Галогены — (от греч. hals соль и. genes рождающий, рожденный) химические элементы Фтор F, Хлор Cl, Бром Br, Иод I и Астат At, составляющие главную подгруппу VII группы периодической системы Д. И. Менделеева. Названы Г. по свойству давать соли при… … Большая советская энциклопедия
ГАЛОГЕНЫ
ХАРАКТЕРИСТИКА ГАЛОГЕНОВ
Степени окисления Г.: Ч 1 (наиб. характерная); + 1 (НОF, НХО и др.); + 3 у С1 и Вr (НХО 2, XF3); + 4 у С1, Вr, I (ХO2); + 5 (НХO3, XF5 и др.); + 6 у С1 (С12 О б); + 7 у С1, Вr и I (HC1O4, C12O7, НВrO4, IF7 и др.).
Ионы Г. в виде лигандов входят в состав молекул многочисленных комплексных соед., фтор и хлор участвуют в образовании мостиковых связей, напр. в А12 С1 б, Ta4F20. наиб. активны атомарные и ионизированные Г., к-рые получают в плазме, газовых разрядах или термокаталитич. разложением молекул Х 2 и используют для синтеза термически нестойких галогенидов или ионного травления пов-стей металлов, полупроводниковых материалов.
Г. (за исключением астата) широко распространены в природе; они входят в состав мн. минералов, содержатся в морской воде; в своб. виде не встречаются. Все Г. ядовиты и обладают бактерицидными св-вами.
Соединения, напоминающие по хим. св-вам Г., напр. дициан (CN)2, диоксоциан (CON)2, дитиоциан (SCN)2, наз. псевдогалогенами, а соли металлов, содержащие группы CN, CON, SСN,-псевдогалогенидами. Э. Г. Раков.
ГАЛОГЕНЫ
Смотреть что такое «ГАЛОГЕНЫ» в других словарях:
ГАЛОГЕНЫ — ГАЛОГЕНЫ, химические элементы VII группы периодической системы: фтор F, хлор Cl, бром Br, иод I и астат At. Фтор и хлор газы, бром жидкость, остальные кристаллы. Все галогены, кроме At, широко распространены в природе входят в состав многих… … Современная энциклопедия
ГАЛОГЕНЫ — ГАЛОГЕНЫ, элементы (ФТОР, ХЛОР, БРОМ, ЙОД и АСТАТ), принадлежащие к VII группе периодической таблицы. Они реагируют с большинством других элементов и органическими соединениями. Химическая активность падает от начала к концу группы. Галогены… … Научно-технический энциклопедический словарь
Галогены — фтор, хлор, бром, йод; входят в VII группу периодической системы. Все члены группы образуют соединения с водородом, причем связь их повышается с уменьшением атомной массы; температура образования различных солей уменьшается с увеличением атомной… … Российская энциклопедия по охране труда
ГАЛОГЕНЫ — общее название пяти хим. элементов, составляющих VII подгруппу Периодической системы элементов Д. И. Менделеева, фтора, хлора, брома, йода и астата. Все Г. неметаллы, их молекулы двухатомны; Г. реагируют со всеми простыми веществами, являются… … Большая политехническая энциклопедия
ГАЛОГЕНЫ — ПОДГРУППА VIIA. ГАЛОГЕНЫ ФТОР, ХЛОР, БРОМ, ИОД, АСТАТ Галогены и особенно фтор, хлор и бром имеют большое значение для промышленности и лабораторной практики как в свободном состоянии, так и в виде различных органических и неорганических… … Энциклопедия Кольера
Галогены — В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете … Википедия
ГАЛОГЕНЫ — ГАЛОИДЫ ИЛИ ГАЛОГЕНЫ химические элементы: хлор, иод, бром, фтор, образующие с металлами соли без кислорода, напр. хлористый натрий (повар. соль). Словарь иностранных слов, вошедших в состав русского языка. Павленков Ф., 1907. ГАЛОИДЫ или ГАЛОГЕНЫ … Словарь иностранных слов русского языка
галогены — ов; мн. (ед. галоген, а; м.). [от греч. hals соль и genesis род, происхождение]. Группа химических элементов (фтор, хлор, бром, йод и др.), образующих соли при соединении с металлами. ◁ Галогенный, ая, ое. Г ые соединения. Г ая лампа (лампа… … Энциклопедический словарь
галогены — halogenai statusas T sritis chemija apibrėžtis F, Cl, Br, I, (At). atitikmenys: angl. halogens; haloid elements; haloids rus. галогены … Chemijos terminų aiškinamasis žodynas
Галогены — (от греч. hals соль и. genes рождающий, рожденный) химические элементы Фтор F, Хлор Cl, Бром Br, Иод I и Астат At, составляющие главную подгруппу VII группы периодической системы Д. И. Менделеева. Названы Г. по свойству давать соли при… … Большая советская энциклопедия