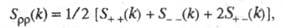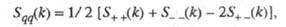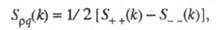что в химии является электролитом
Электролит (химия)
Электроли́т — химический термин, обозначающий вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы. Примерами электролитов могут служить кислоты, соли и основания. Электролиты — проводники второго рода, вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов и обладающие вследствие этого ионной проводимостью.
Содержание
Степень диссоциации
Классификация
Исходя из степени диссоциации все электролиты делятся на две группы
Между этими двумя группами четкой границы нет, одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом — слабого.
Использование термина «Электролит»
В естественных науках
Термин электролит широко используется в биологии и медицине. Чаще всего подразумевают водный раствор, содержащий те или иные ионы (напр., «всасывание электролитов» в кишечнике).
Электролиты в технике
Слово электролит широко используется в науке и технике, в разных отраслях оно может иметь различающийся смысл.
Электролит в электрохимии
Многокомпонентный раствор для электроосаждения металлов, а также травления и др. (технический термин, например, электролит золочения).
Электролит аккумуляторный
Обиходное название раствора серной кислоты для свинцовых аккумуляторов
Электролитический конденсатор
относящийся к типу «Электролитический», в котором в качестве одной из обкладок используется электролит. Конденсаторы данного типа, в отличии от других типов, обладают несколькими отличительными особенностями
Примечания
См. также
Полезное
Смотреть что такое «Электролит (химия)» в других словарях:
электролит — – вещество, водный раствор или расплав которого проводит электрический ток. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Электролит — Электролит вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы, однако само вещество электрический ток не проводит. Примерами электролитов могут служить растворы кислот, солей и оснований.… … Википедия
Числа переноса катионов в водных растворах при 25 °С — Электролит Эквивалентная концентрация, моль/л 0 0,01 0,02 0,05 0,1 0,2 … Химический справочник
Электрохимия — Электрохимия раздел химической науки, в котором рассматриваются системы и межфазные границы при протекании через них электрического тока, исследуются процессы в проводниках, на электродах (из металлов или полупроводников, включая графит) и… … Википедия
КОЛЛОИДЫ — КОЛЛОИДЫ, КОЛЛОИДНАЯ ХИМИЯ. Коллоиды (от греч. ко 11а клей, желатина), название, данное Грэмом (Graham) группе веществ, типичными представителями которых являются желатина или гум ми арабик. Коллоидная химия является наиболее молодой хим.… … Большая медицинская энциклопедия
Тетрахлороаурат(III) водорода — Общие Т … Википедия
Цезий — 55 Ксенон ← Цезий → Барий … Википедия
Литий — Запрос «Lithium» перенаправляется сюда; см. также другие значения. Эта статья о химическом элементе. О применении в медицине см. Препараты лития. 3 Гелий ← Литий … Википедия
Электролит, понятие, свойства и виды
Электролит, понятие, свойства и виды.
Электролит – вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или вследствие движения ионов в кристаллических решётках твёрдых электролитов.
Электролит (определение и понятие):
Электролит – вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или вследствие движения ионов в кристаллических решётках твёрдых электролитов.
Электролиты – вещества, расплавы или растворы которых проводят электрический ток.
Электролиты – вещества, подвергающиеся в растворах или расплавах электролитической диссоциации и проводящие электрический ток за счет движения ионов. Таким образом, движение электрического тока в электролитах обусловлено ионной проводимостью.
Электролиты – это проводники второго рода, вещества, электропроводность которых обусловлена подвижностью положительно или отрицательно заряженных ионов.
К электролитам относятся вещества с ионной или сильнополярной ковалентной связью. К электролитам относятся растворы солей, оснований и кислот, а также вода. Кроме того, некоторые газы ведут себя как электролиты в условиях высокой температуры или низкого давления. Некоторые кристаллы (например, иодид серебра, диоксид циркония) также являются твердыми электролитами.
Соответственно неэлектролиты – вещества, расплавы и водные растворы которых не проводят электрический ток. К неэлектролитам относятся вещества с неполярной и малополярной ковалентной связью. К неэлектролитам относятся газы (двухатомные газы, благородные газы и др.), твердые вещества и органические вещества (спирты, эфиры, бензол, бензин, сахарозу и пр.).
Способность растворов или расплавов электролитов проводить электрический ток объясняется тем, что молекулы электролитов при растворении в воде или других растворителях (например, этаноле, жидком аммиаке, жидком сернистом ангидриде) либо при расплавлении распадаются на электрически положительно и отрицательно заряженные частицы — ионы. Величина заряда иона численно равна валентности атома или группы атомов, образующих ион.
Электролитическая диссоциация (ионизация):
Процесс распада молекул в растворе или расплаве электролита на ионы называется электролитической диссоциацией (или ионизацией). Процесс диссоциации носит обратимый характер. Одновременно с процессами диссоциации в растворах или расплавах электролита протекают и процессы ассоциации ионов в молекулы. При неизменных внешних условиях (температура, концентрация и др.) устанавливается динамическое равновесие между диссоциациями (распадами) и ассоциациями. Это означает, что определенное количество молекул электролита распадается на ионы и такое же количество молекул образуется вновь из ионов. Поэтому в растворах или расплавах электролита всегда диссоциирована определённая доля молекул вещества.
Уравнение диссоциации молекулы электролита (КA) на катион (К + ) и анион (А — ) в общем виде записывается так:
Для конкретных химических соединений уравнение диссоциации выглядит следующим образом:
Число положительных и отрицательных ионов электролита в растворе или расплаве может быть разным, но суммарный заряд катионов всегда равен суммарному заряду анионов, поэтому раствор (или расплав) в целом электрически нейтрален.
Процесс диссоциации электролитов в воде легче всего происходит у соединений с ионной связью (солей, щелочей), которые при растворении образуют гидратированные ионы. Как правило, соединения с ионной связью (соли и щелочи) диссоциируют полностью. Соединения с сильнополярной ковалентной связью диссоциируют частично. При растворении вещества с сильнополярной ковалентной связью (например, хлороводород HCl) диполи воды ориентируются у соответствующих полюсов растворяемой молекулы, поляризую связь и превращая ее в ионную с последующей гидратацией ионов.
Гидратированные ионы устойчивы. Они беспорядочно передвигаются в растворе. Однако под действием электрического тока их движение приобретает направленный характер.
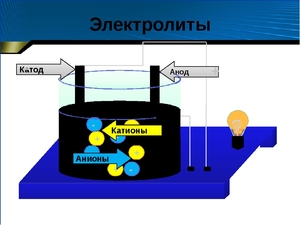
Растворы электролитов обладают способностью проводить электрический ток вследствие движения ионов. Если в раствор или расплав электролита опустить электроды и на электроды подать электрический ток, то под действием электрического тока ионы приобретут направленное движение: положительно заряженные ионы (катионы) будут двигаться к катоду (отрицательному электроду), отрицательно заряженные (анионы) – к аноду (положительному электроду). Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами. Направленное движение катионов и анионов в растворе или расплаве электролита в противоположных направлениях равносильно электрическому току.
Для измерения количественной характеристики электролитической диссоциации введено понятие степень диссоциации.
Степень диссоциации (α) — это отношение числа молекул, диссоциировавших на ионы (n), к общему числу молекул (N) в растворе электролита.
Степень диссоциации выражается в долях или процентах.
Степень диссоциации (т.е. полнота диссоциации) электролита зависит от многих факторов: от природы электролита, температуры, концентрации и вида растворителя. Так, один и тот же электролит при разной температуре или при одинаковой температуре, но в разных растворителях, будет диссоциирован в разной степени. Так, диссоциация происходит только в полярном растворителе, в частности, в воде. Соли и щелочи диссоциируются полностью. С увеличением концентрации ионизация электролита идет труднее, и наоборот. Повышение температуры способствует повышению степени диссоциации, и наоборот.
Мерой способности электролитов распадаться на ионы в растворах может служить константа электролитической диссоциации (константа ионизации) (Кд).
Константа диссоциации (Кд) – это отношение произведения концентрации диссоциированных ионов к концентрации недиссоциированных молекул электролита.
Константу диссоциации можно выразить уравнением:
KA – концентрация недиссоциированного соединения в растворе;
K + – концентрация катионов в растворе;
A − – концентрация анионов в растворе.
Константа диссоциации (Кд) показывает во сколько раз скорость диссоциации больше скорости ассоциации. Чем больше константа диссоциации, тем сильнее электролит. Константа диссоциации зависит от природы электролита и растворителя, температуры и не зависит от концентрации раствора.
Виды электролитов: сильные и слабые электролиты, солевые, кислотные и щелочные электролиты и пр.:
Исходя из степени диссоциации все электролиты делятся на две группы: сильные электролиты и слабые электролиты.
Сильные электролиты – электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как HCl, HBr, HI, HNO3, H2SO4).
Слабые электролиты – электролиты, степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты, такие как HF, HNO2, HCO3, HPO4, почти все органические кислоты), основания p-, d- и f-элементов, почти все малорастворимые в воде соли.
Необходимо иметь в виду, что между двумя указанными группами не существует чёткой границы: одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом – слабого.
В зависимости от вида ионов, на которые распадается вещество при растворении в воде, различаются:
– электролиты без ионов Н + и ОН — (солевые электролиты),
– электролиты с обилием ионов Н + (кислотные электролиты),
– и электролиты с преобладанием ионов ОН — (щелочные электролиты).
В зависимости от вида растворителя электролиты делятся на водные электролиты и неводные электролиты. Отдельно выделяется особый вид электролитов – полиэлектролиты.
В зависимости от того, какое количество ионов образуется при диссоциации молекул электролита, электролиты подразделяются на:
– симметричные электролиты. Симметричные электролиты – электролиты, при диссоциации молекул которого образуется равное число положительных и отрицательных ионов. Симметричными электролитами являются NaCl – 1,1-валентный электролит, HCl – 1,1-валентный электролит и CaSO4 – 2,2-валентный электролит;
– несимметричные электролиты. Несимметричные электролиты – электролиты при диссоциации молекул которого образуется неравное число положительных и отрицательных ионов. Несимметричным электролитом является, например, H2SO4 – 1,2-валентный электролит.
В зависимости от природы электролита выделяются:
– соли. Соли, как электролиты, диссоциируют в водном растворе с образованием иона металла в качестве катиона и иона кислотного остатка в качестве аниона. Соли диссоциируют полностью.
– кислоты. Кислоты, как электролиты, диссоциируют в водном растворе с образованием иона водорода H + в качестве катиона и иона кислотного остатка в качестве аниона. Многоосновные кислоты диссоциируют ступенчато. Причем каждая последующая ступень диссоциирует сложнее, т.к. образующиеся ионы кислотных остатков являются более слабыми электролитами.
Например, фосфорная кислота диссоциирует в три ступени, потому, что имеет 3 атома водорода:
Общая формула диссоциация для фосфорной кислоты будет выглядеть так:
– основания. Основания, как электролиты, диссоциируют в водном растворе с образованием гидроксид-иона ОН — в качестве аниона и иона металла в качестве катиона.
электролиты
ЭЛЕКТРОЛИТЫ
вещества, в которых в заметной концентрации присутствуют ионы, обусловливающие прохождение электрич. тока (ионную проводимость). Э. также наз. проводниками второго рода. В узком смысле слова Э. — вещества, молекулы которых в растворе вследствие электролитической диссоциации распадаются на ионы. Различают электролиты твердые, растворы электролитов и ионные расплавы. Растворы электролитов часто также наз. Э. В зависимости от вида растворителя различают Э. водные и электролиты неводные. Особый класс составляют высокомол. Э. — полиэлектролиты.
В соответствии с природой ионов, образующихся при электролитич. диссоциации водных растворов, выделяют солевые Э. (в них отсутствуют ионы H + и OH − ), кислоты (преобладают ионы H + ) и основания (преобладают ионы OH − ). Если при диссоциации молекул Э. число катионов совпадает с числом анионов, такие Э. наз. симметричными (1,1 — валентными, напр. KCl, 2,2-валентными, напр. CaSO4, и т. д.). В противном случае Э. наз. несимметричными (1,2-валентные Э., напр. H2SO4, 3,1-валентные, напр. А1(OH)3, и т. д.).
По способности к электролитич. диссоциации Э. условно разделяют на сильные и слабые. Сильные Э. практически полностью диссоциированы на ионы в разбавленных растворах. К ним относятся многие неорг. соли, некоторые кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью ( напр., в спиртах, амидах, кетонах). Молекулы слабых Э. лишь частично диссоциированы на ионы, которые находятся в динамич. равновесии с недиссоциир. молекулами. К слабым Э. относятся многие орг. кислоты и основания в водных и неводных растворителях. Степень диссоциации зависит от природы растворителя, концентрации раствора, температуры и др. факторов. Один и тот же Э. при одинаковой концентрации, но в разл. растворителях образует растворы с разл. степенью диссоциации.
Электролитич. диссоциация приводит к увеличению общего числа частиц в растворе, что обусловливает существенное различие между свойствами разбавл. растворов электролитов и неэлектролитов. Этим, в частности, объясняется увеличение осмотич. давления раствора и его отклонение от закона Вант-Гофа ( см. осмос), понижение давления пара растворителя над раствором и его отклонение от Рауля закона, увеличение изменения температуры кипения и замерзания раствора относительно чистого растворителя и др.
Ионы в Э. являются отд. кинетич. единицами и участвуют в химических реакциях и электрохим. процессах часто независимо от природы др. ионов, присутствующих в растворе. При прохождении электрич. тока через Э. на погруженных в него электродах происходят окислительно-восстановит. реакции, в результате чего в своб. виде выделяются вещества, которые становятся компонентами Э. ( см. электролиз).
Э. по своей структуре представляют собой сложные системы, состоящие из ионов, окруженных молекулами растворителя, недиссоциированных молекул растворенного вещества, ионных пар и более крупных агрегатов. Свойства Э. определяются характером ион-ионных и ион-молекулярных взаимод., а также изменением свойств и структуры растворителя под влиянием растворенных частиц Э. В полярных растворителях благодаря интенсивному взаимод. ионов с молекулами растворителя образуются сольватные структуры ( см. сольватация). Роль сольватации с увеличением валентности ионов и уменьшением их кристаллографич. размеров возрастает. Мерой взаимод. ионов с молекулами растворителя является энергия сольватации.
В зависимости от концентрации Э. выделяют область разбавленных растворов, которые по своей структуре близки к структуре чистого растворителя, нарушаемой, однако, присутствием и влиянием ионов; переходную область и область концентрир. растворов. Весьма разбавленные растворы слабых Э. по своим свойствам близки к идеальным растворам и достаточно хорошо описываются классич. теорией электролитич. диссоциации. Разбавленные растворы сильных Э. заметно отклоняются от свойств идеальных растворов, что обусловлено электростатич. межионным взаимод. Их описание проводится в рамках Дебая-Хюккеля теории, которая удовлетворительно объясняет концентрационную зависимость термодинамич. свойств — коэф. активности ионов, осмотич. коэф. и др., а также неравновесных свойств — электропроводности, диффузии, вязкости ( см. электропроводность электролитов). При повышении концентрации растворов сильных Э. возникает необходимость в учете размера ионов, а также влияния сольватационных эффектов на характер межионного взаимодействия.
В ионных расплавах специфика упорядочения характеризуется структурными факторами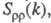
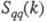
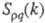
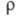
Переход от одной концентрационной области Э. в другую происходит плавно, вследствие чего рассмотренное выше деление является условным. Тем не менее в промежут. области некоторые термодинамич. свойства Э., напр. коэф. растворимости, претерпевают заметные изменения. Описание промежут. и концентрационной областей требует явного рассмотрения как ионов, так и молекул растворителя и учета разл. видов взаимод. между всеми частицами в растворе.
В зависимости от температуры и давления выделяют низкотемепературную и высокотемпературную области свойств Э., а также области нормальных и высоких давлений. Повышение температуры или давления в целом снижают мол. упорядоченность растворителя и ослабляет влияние ассоциативных и сольватационных эффектов на свойства раствора Э. При понижении температуры иже температуры плавления некоторые концентрир. Э. могут находиться стеклообразном состоянии, напр. водные растворы LiCl.
Наряду с Э. как проводниками второго рода существуют вещества, обладающие одновременно электронной и ионной проводимостью. К ним относятся растворы щелочных и щел.-зем. металлов в полярных растворителях (аммиак, амины, эфиры), а также в расплавах солей. В этих системах при изменении концентрации металла происходит фазовый переход в металлич. состояние с существенным (на неск. порядков) изменением электропроводности. При этом в электролитич. области образуется самый легкий анион-сольватированный электрон, придающий раствору характерный синий цвет.
Э. играют важную роль в науке и технике. Они участвуют в электрохим. и многих биол. процессах, являются средой для орг. и неорг. синтеза и электрохим. производств. Изучение свойств Э. важно для выяснения механизмов электролиза, электрокатализа, электрокристаллизации, коррозии металлов и др., для совершенствования механизмов разделения веществ — экстракции и ионного обмена. Исследование свойств Э. стимулируется энергетич. проблемами (создание новых топливных элементов, солнечных батарей, электрохимических преобразователей информации), а также проблемами защиты окружающей среды.
Неэлектролиты и электролиты: характеристика и свойства
Хорошо известно, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят. Это можно наблюдать с помощью простого прибора. Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара, то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия.
Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами.
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
Неэлектролиты
Неэлектролиты находятся в растворе в виде неполярных или малополярных молекул.
Электролиты
Электролиты распадаются в растворе или расплаве на ионы, и именно наличие ионов способствует прохождению электрического тока. Процесс этот — распада на ионы — называют диссоциацией, а теория, описывающая данные процессы — теорией электролитической диссоциации. В растворе распад на ионы происходит по причине разрыва связей вещества, что является результатом взаимодействия с молекулами воды (то есть происходит гидратация электролита).
Ионы (атомы или их группы, обладающие отрицательным или положительным зарядом) под действием электрического тока начинают двигаться по направлению к одному из электродов, что и обуславливает электропроводимость.
Молекула электролита, способная диссоциировать на большее, чем два, количество ионов, будет диссоциировать постадийно. Примером может служить диссоциация многоосновной кислоты.
Подробнее познакомиться с теорией электролитической диссоциацией вы сможете, посмотрев это видео.
Степень диссоциации
Понятие, количественно характеризующее, насколько полно произошёл распад электролита на ионы, называют степенью диссоциации. Этот показатель рассчитывается как отношение количества продиссоциировавших молекул к общему числу молекул вещества в растворе и фактически показывает долю (процент) распавшихся на ионы молекул в общем количестве.
Следующие факторы могут влиять на степень электролитической диссоциации:
Температура
Зависимость от температуры достаточно сложна. Если распад на ионы экзотермический, то повышение температуры степень диссоциации будет уменьшать, а если эндотермический, повышение температуры приведёт к увеличению степени диссоциации. В целом же для каждого электролита есть определённые температурные условия, в которых он в максимальной степени будет распадаться на ионы.
Изменение показателя константы диссоциации (характеризует способность распадаться на ионы) для уксусной кислоты при изменении температуры можно привести в качестве примера:
максимальная ионизация раствора, как видно, наступает при 25 °C, а при температурах выше и ниже этого значения диссоциация происходит в меньшей степени.
Что такое степень диссоциации? Подробный ответ вы найдете в этом видео.
Природа растворителя и электролита
Стадия процесса диссоциации
Если молекула распадается на ионы постадийно, то каждая следующая стадия имеет примерно в 1000−10 000 раз меньший эффект, чем предыдущая.
Экспериментально определить степень диссоциации можно по электропроводности растворов, т. к. она прямо зависит от концентрации движущихся ионов. Истинное значение при этом получить нельзя, такое значение называют кажущимся. Оно меньше истинного, так как при движении к электродам ионы могут сталкиваться, что частично уменьшает их подвижность. При высокой концентрации может возникать притяжение между ионами, обусловленное электростатическими силами, они чаще сталкиваются, теряя свою подвижность, что влияет на показания электропроводности.
Например, в растворе соляной кислоты (1 моль/л) измерения покажут степень распада на ионы равной 0,78 (78%), но фактически раствор не будет содержать 22% недиссоциированных молекул, так как практически все молекулы диссоциированы.
Сильные и слабые проводники
По величине показателя степени диссоциации, выделяют электролиты сильные и слабые. К сильным условно относят вещества, значение степени диссоциации у которых больше 30%, если данный показатель ниже 5%, то к слабым, остальные считаются электролитами средней силы.
Сильные электролиты:
Видео
Из этого видео вы узнаете о свойствах электролитов.