Болезнь сакса что это
Болезнь сакса что это
Этиология и встречаемость болезни Тея-Сакса. Болезнь Тея-Сакса (MIM №272800), раннедетский ганглиозидоз GM2, — панэтническое аутосомно-рецессивное заболевание распада ганглиозидов, вызванное недостаточностью гексозаминидазы А (см. главу 12). Кроме раннедетской тяжелой формы, недостаточность гексозаминидазы А вызывает легкую форму болезни с началом в юношеском или взрослом возрасте.
Встречаемость недостаточности гексозаминидазы А широко варьирует в различных популяциях; встречаемость болезни Тея-Сакса в Северной Америке колеблется от 1 на 3600 новорожденных у евреев ашкенази до 1 на 360 000 среди не ашкенази евреев. Сравнимую с евреями-ашкенази встречаемость болезни Тея-Сакса имеют французские канадцы, каджуны в Луизиане и амиши в Пенсильвании. Повышенная частота носительства в этих четырех популяциях — следствие генетического дрейфа, хотя не исключено преимущество гетерозигот.
Патогенез болезни Тея-Сакса
Ганглиозиды — церамидовые олигосахариды, присутствующие в поверхностных мембранах всех клеток, но больше всего их в клетках мозга. Ганглиозиды концентрируются в поверхностных мембранах нейронов, особенно в аксонах и дендритах. Они функционируют как рецепторы различных гликопротеиновых гормонов и бактериальных токсинов и задействованы в дифференцировке клеток и межклеточном взаимодействии.
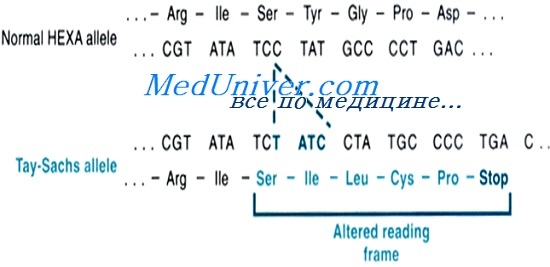
Гексозаминидаза А — лизосомный фермент, состоящий из двух субъединиц. а-Субъединица кодируется геном НЕХА в хромосоме 15, а бета-субъединица — геном НЕХВ в хромосоме 5. В присутствии белка-активатора гексозаминидаза А удаляет концевой N-ацетилгалактозамин из ганглиозида GM2.
Мутации генов а-субъединицы или белка-активизатора вызывают накопление GM2 в лизосомах и, этим самым, раннедетский, позднедетский или взрослый тип болезни Тея-Сакса. [Мутация а-субъединицы вызывает болезнь Сандхоффа (MIM № 268800)].
Пациенты с раннедетской формой ганглиозидоза GM2 имеют два патологических аллеля, приводящих к полному отсутствию активности гексозаминидазы. Пациенты с формами ганглиозидоза GM2 с началом в юношеском или взрослом возрасте — обычно сложные гетерозиготы по аллелю с полным отсутствием функции и аллелю с небольшой остаточной активностью гексозаминидазы А.
Фенотип и развитие болезни Тея-Сакса
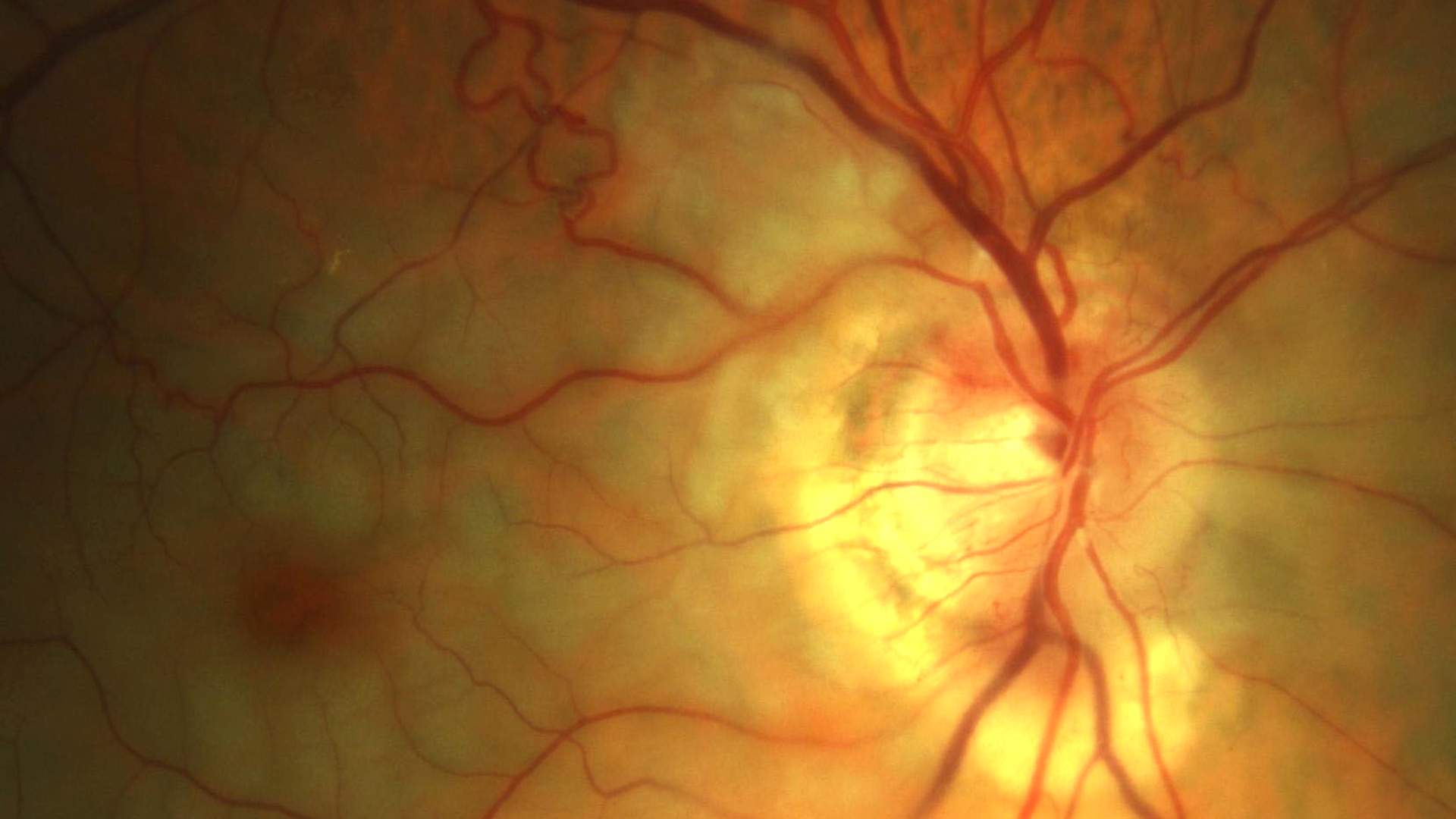
Раннедетский тип ганглиозидоза GM2 характеризуется неврологическим ухудшением, начинающимся в возрасте 3-6 мес и приводящим к смерти к 2-4 года. Обычно моторное развитие останавливается или начинает регрессировать к 8-10 мес жизни, и в течение второго года жизни развивается неспособность к самостоятельному передвижению. Потеря зрения начинается на первом году жизни и быстро прогрессирует; почти всегда это связано с «вишнево-красным» пятном («косточкой») при обследовании глазного дна.
Судороги обычно начинаются в конце первого года жизни и непрерывно становятся все тяжелее. Дальнейшее ухудшение на втором году жизни заканчивается децеребрационной ригидностью, затруднениями глотания, тяжелыми судорогами и, наконец, вегетативным состоянием.
Ганглиозидоз GM2 с позднедетским началом выявляют на 2-4 годах жизни, он характеризуется неврологической симптоматикой, начинающейся с атаксии и дискоординации. К концу первого десятилетия большинство пациентов имеют спастичность и судороги; к 10-15 годам у большинства развивается децеребрационная ригидность и вегетативное состояние со смертью обычно во втором десятилетии жизни. Снижение зрения отмечают, но может не быть «вишневой косточки» на глазном дне; атрофия зрительного нерва и пигментный ретинит часто появляются в конце течения болезни.
Взрослый тип ганглиозидоза GM2 имеет выраженную клиническую изменчивость (прогрессирующая дистония, спиноцеребеллярная дегенерация, патология моторных нейронов или психиатрические нарушения). До 40% больных имеют прогрессирующие психиатрические проявления без психоза. Зрение затрагивается редко, и данные офтальмологического обследования обычно в норме.
Особенности фенотипических проявлений болезни Тея-Сакса:
• Возраст начала: от раннего детства до взрослого возраста
• Нейродегенерация
• «Вишневая косточка»
• Психоз
Лечение болезни Тея-Сакса
Диагноз ганглиозидоза GM2 ставят на основании выявления как отсутствующей или почти отсутствующей активности гексозаминидазы А в сыворотке крови или в лейкоцитах, так и нормальной или повышенной активности гексозаминидазы В. Для диагностики также можно использовать анализ мутаций в гене НЕХА, но обычно его выполняют только для уточнения транспортного носительства и пренатальной диагностики.
Болезнь Тея-Сакса в настоящее время — инкурабельное заболевание; следовательно, лечение направлено на устранение симптомов и паллиативный уход. Почти все больные требуют фармакологического лечения судорог. Психиатрические проявления пациентов с взрослым типом ганглиозидоза GM2 обычно не поддаются стандартным антипсихотическим или противодепрессивным средствам; наиболее эффективны препараты лития и электросудорожная терапия.
Риски наследования болезни Тея-Сакса
Для потенциальных родителей без GM2-ганглиозидоза в семейном анамнезе эмпирический риск родить ребенка, больного СМ2-ганглиозидозом, зависит от частоты заболевания в их этнических группах. Для большинства жителей северной Америки эмпирический риск носительства составляет приблизительно 1 на 250-300, но для евреев-ашкенази эмпирический риск носительства — приблизительно 1 на 30. Для пары, в которой оба родителя носители, риск родить ребенка с ганглиозидозом GM2 равен 1/4.
Пренатальная диагностика основана на идентификации мутаций в гене НЕХА или на определении недостаточности гексозаминидазы А в тканях плода, например, ворсинах хориона или амниоцитах. Для эффективной идентификации пораженного плода с помощью анализа мутации в гене НЕХА обычно необходимо, чтобы мутации, вызывающие ганглиозидоз GM2 в семье, уже были известны.
Скрининг популяций высокого риска на носительство и последующие превентивные мероприятия уменьшили встречаемость болезни Тея-Сакса среди евреев-ашкенази почти на 90%. По традиции такой скрининг выполняют по определению активности гексозаминидазы А сыворотки крови с искусственным субстратом.
Этот чувствительный метод, тем не менее, не способен различить патологические мутации и псевдонедостаточность (снижение распада искусственного субстрата, но нормальный распад естественного субстрата); следовательно, носительство обычно подтверждают молекулярным анализом НЕХА. В гене НЕХА обнаружено два аллеля псевдонедостаточности и более 70 патологических мутаций.
Среди евреев-ашкенази, положительных по результатам ферментного скрининга, 2% — гетерозиготны по аллелю псевдонедостаточности, и 95-98% гетерозиготны по одной из трех патологических мутаций, две вызывают раннедетскую форму, одна — взрослую форму GM2-ганглиозидоза. В отличие от этого, среди остальных североамериканцев, положительных по результатам ферментативного скрининга, 35% — гетерозиготны по аллелям псевдонедостаточности.
Пример болезни Тея-Сакса. Семейная пара, оба евреи ашекенази, направлена в клинику генетики для оценки риска родить ребенка с болезнью Тея-Сакса. Сестра жены умерла от болезни Тея-Сакса в детстве. Дядя мужа по отцу находится в психиатрической лечебнице, но его диагноз неизвестен. Как муж, так и жена отказались от скрининга на носительство болезни Тея-Сакса в подростковом возрасте.
Анализ фермента показал, что как муж, так и жена имеют чрезвычайно низкую активность гексозаминидазы А. Последующий молекулярный анализ мутаций, преобладающих у евреев ашкенази, подтвердил, что у жены имеется патогенная мутация, тогда как у мужа только аллель псевдонедостаточности.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Болезнь Тея – Сакса
Инфантильный
Несовершеннолетний
Позднее начало
Для предотвращения или снижения заболеваемости Тай-Сакса использовались три основных подхода:
По состоянию на 2010 год, даже при самом лучшем уходе, дети с инфантильной болезнью Тея – Сакса обычно умирают к 4 годам. Дети с ювенильной формой, вероятно, умрут в возрасте 5–15 лет, а дети с взрослой формой, вероятно, не умрут. подвержен влиянию. [34]
Евреи-ашкенази часто страдают от болезни Тея – Сакса и других болезней накопления липидов. В Соединенных Штатах от 1 из 27 до 1 из 30 евреев-ашкенази являются рецессивными носителями. Болезнь частота составляет около 1 в каждой 3500 новорожденных среди ашкеназов. [37] Французские канадцы и община каджун в Луизиане имеют сходство с евреями ашкенази. У американцев ирландского происхождения 1 шанс из 50 стать носителем. [38] В общей популяции частота носителей в качестве гетерозигот составляет примерно 1 из 300. [9] Заболеваемость составляет примерно 1 из 320 000 новорожденных в общей популяции в Соединенных Штатах. [39]
Было предложено три основных класса теорий для объяснения высокой частоты носителей Тай-Сакса в еврейском населении ашкенази:
Варен Тай и Бернард Сакс были двумя врачами. Они описали прогрессирование заболевания и предоставили критерии дифференциальной диагностики, позволяющие отличить его от других неврологических расстройств с аналогичными симптомами.
И Тай, и Сакс сообщили о своих первых случаях заболевания среди еврейских семей ашкенази. Тай сообщил о своих наблюдениях в 1881 году в первом томе трудов Британского офтальмологического общества, одним из основателей которого он был. [45] К 1884 году он видел три случая в одной семье. Спустя годы американский невролог Бернард Сакс сообщил о подобных результатах, когда сообщил другим членам Нью-Йоркского неврологического общества о случае «задержки развития мозга». [46] [47]
Пик иммиграции евреев в США пришелся на период 1880–1924 годов, когда иммигранты прибывали из России и стран Восточной Европы ; Это также был период нативизма (враждебности к иммигрантам) в Соединенных Штатах. Противники иммиграции часто сомневались, могут ли иммигранты из южной и восточной Европы ассимилироваться в американское общество. Сообщения о болезни Тея – Сакса способствовали восприятию среди нативистов того, что евреи были низшей расой. [47]
С тех пор, как в 1971 году началось тестирование носителя для Тай-Сакса, миллионы евреев-ашкенази были проверены как носители. Еврейские общины поддержали идею генетического скрининга с 1970-х годов. Успех в лечении болезни Тея – Сакса привел к тому, что Израиль стал первой страной, предлагающей бесплатный генетический скрининг и консультирование для всех пар, и открыл дискуссии о надлежащем объеме генетического тестирования для других заболеваний в Израиле. [52]
Это противоречие среди исследователей отразило три дискуссии среди генетиков в целом:
Заместительная ферментная терапия
Исследователи также пытались напрямую ввести дефицитный фермент гексозаминидазу А в спинномозговую жидкость (CSF), которая омывает мозг. Однако внутримозговые нейроны, по-видимому, не могут эффективно поглощать эту физически большую молекулу, даже если она находится непосредственно рядом с ними. Следовательно, такой подход к лечению болезни Тея – Сакса также пока что неэффективен. [54]
Модель овцы иакова
Субстрат-редукционная терапия
Повышение активности β-гексозаминидазы А
Поскольку болезнь Тея – Сакса представляет собой дефицит β-гексозаминидазы А, ухудшение состояния больных можно замедлить или остановить с помощью вещества, повышающего его активность. Однако, поскольку при детской болезни Тея – Сакса β-гексозаминидаза А отсутствует, лечение будет неэффективным, но для людей, страдающих болезнью Тея – Сакса с поздним началом, присутствует β-гексозаминидаза А, поэтому лечение может быть эффективным. Было показано, что препарат пириметамин увеличивает активность β-гексозаминидазы A. [63] Однако повышенные уровни β-гексозаминидазы A по-прежнему намного ниже желаемых «10% нормального HEXA», выше которого фенотипические симптомы начинают проявляться. пропадать. [63]
Пересадка пуповинной крови
Болезнь Тея-Сакса – это генетическое заболевание, характеризующееся недостаточностью фермента гексозаминидазы А, скоплением липоидных макромолекул в нейронах, нарушением функций головного и спинного мозга. Проявляется деградацией физических навыков и психических функций: распадом глотательного рефлекса, речи и произвольных движений, утратой слуха и зрения, снижением интеллекта. Развиваются судорожные приступы, атрофия мышц, паралич, деменция. Специфические методы диагностики – офтальмоскопия глазного дна, исследование количества гексозаминидазы в крови и нейронах. Лечение паллиативное, нацелено на облегчение симптомов.
МКБ-10
Общие сведения
Синонимы болезни Тея-Сакса (БТС) – ганглиозидоз GM2, идиотия Тея-Сакса, ранняя детская амавротическая идиотия. Является одним из вариантов лизосомных болезней накопления. Названа по фамилиям двух врачей – невропатолога из США Бернарда Сакса и офтальмолога из Великобритании Уоррена Тея. В 80-е годы XIX века они впервые опубликовали независимые описания данной патологии. Ее распространенность крайне низка, в общей популяции средняя частота носителей рецессивного измененного гена составляет около 0,3%. Эпидемиологические показатели наиболее высоки в группе евреев ашкенази (носительство мутации определяется у 3%), а также у франкоканадцев и каджунов. Пик заболеваемости приходится на возраст от полугода до 2 лет, реже симптомы дебютируют у подростков и взрослых.
Причины
Метаболические нарушения, составляющие основу заболевания, вызваны мутацией гена HEXA, который находится на длинном плече 15 хромосомы. Он кодирует альфа-субъединицу фермента лизосом бета-N-ацетилгексозаминидазы А. Болезнь Тея-Сакса наследуется по аутосомно-рецессивному принципу – для возникновения симптоматики необходимо присутствие в хромосоме двух мутированных генов. Риск болезни у ребенка существует, только если оба супруга являются носителями мутации, составляет 25%. Таким образом, патология может проявиться в любом поколении независимо от того, когда произошла мутация. Носительство долгое время может оставаться скрытым – в этом случае доминантный «здоровый» ген в состоянии обеспечить организм производством фермента на 50% и более, что достаточно для нормального протекания биохимических реакций.
К началу 2000-х годов выявлено более 100 различных мутаций в генах HEXA: вставки в пары оснований, делеции пар оснований, сплайс-сайт мутации, точечные мутации и другие варианты изменений структуры гена. Каждая из этих мутаций определенным образом влияет на строение фермента и подавляет его активность. Разнообразие мутаций пары генов – компаундная гетерозиготность – определяет наличие нескольких форм болезни. Одинаково мутировавшие гены в аллели вызывают полную инактивацию катаболизма ганглиозидов. Наследование разных (не одинаковых) мутаций в паре генов чаще проявляется уменьшением активности фермента, а не полной инактивацией.
Патогенез
Основой развития болезни является отсутствие или недостаточная активность гексозаминидазы A – лизосомального фермента, катализирующего биодеградацию макромолекул ганглиозидов, олигосахаридов, гликозаминогликанов и гликолипидов. Ганглиозиды – тип жирных кислот, липидные компоненты мембран нейронов и глиальных клеток. Они обеспечивают активность нервных клеток: влияют на скорость и интенсивность нейропередачи, проведение нервных импульсов, распределение и хранение информации, формирование памяти. В норме ганглиозиды производятся, выполняют свои функции и быстро расщепляются в процессе многоступенчатой реакции с участием ферментов. Для гидролиза этих сложных липидов необходимы три компонента: альфа- и бета-субъединицы гексозаминидазы А, белок-активатор GM2A. При недостаточности альфа-гексозаминидазы А процесс биодеградации замедляется или становится полностью невозможным. Ганглиозиды накапливаются в лизосомах клеток головного, спинного мозга, приводят к их дисфункции и гибели.
Классификация
В зависимости от особенностей генетического дефекта, сохранности функций гексозаминидазы заболевание имеет быстропрогрессирующее или медленно прогрессирующее течение, проявляется в раннем детстве, подростничестве или во взрослом возрасте. Согласно этим характеристикам выделено 3 формы болезни:
Симптомы болезни Тея-Сакса
Клиническая картина болезни отражает процессы поражения ЦНС. При инфантильной форме первые симптомы становятся заметными к 3-5 месяцам, до этого развитие соответствует норме: ребенок держит голову, переворачивается на живот и обратно, агукает, улыбается при виде взрослого, устанавливает визуальный контакт. К 6 месяцам снижается заинтересованность окружающим миром. Малыш подолгу смотрит в сторону, апатичен, малоподвижен, чувствителен к громким звукам, яркому свету. Он перестает узнавать близких людей, с трудом фокусирует взгляд на любимых игрушках.
После полугода задержка психического и физического развития становится еще более заметной. Нарастает мышечная гипотония, утрачиваются ранее приобретенные навыки: удерживание головы и корпуса в вертикальном положении, переворачивание в положении лежа на горизонтальной поверхности, сидение (попытки сидения), захват игрушки и перекладывание ее из руки в руку. К 8-10 месяцам усиливаются старт-рефлексы – реакции на внезапные звуковые, световые, тактильные и обонятельные раздражители. Интерес к происходящим вокруг событиям почти полностью исчезает. К 12 месяцам нарушается способность глотать, заметно снижается слух и зрение, затрудняется цикл дыхания. Мышцы подвергаются атрофии, развивается паралич, судороги в форме тонико-клонических генерализованных и парциальных приступов. На втором году жизни возникают явления децеребрационной ригидности, бульбарно-псевдобульбарного синдрома.
Ювенильная форма дебютирует менее явными симптомами. На начальном этапе несколько усиливается эмоциональная неустойчивость, при выполнении сложных двигательных комплексов – беге, ходьбе, быстром письме – появляется едва заметная дискоординация движений. Через некоторое время неуклюжесть и неловкость нарастают, замечаются окружающими и самим ребенком. К подростковому возрасту походка становится шаткой, неустойчивой. Формируются гиперкинезы – внезапные непроизвольные движения различных групп мышц. Нарушения координации не позволяют продолжать школьное обучение. Параллельно появляются расстройства речи сложного мозжечково-дизартрического характера: теряется плавность и ритмичность, произношение становится медленным, смазанным, невнятным. Поздние стадии болезни характеризуются частыми эпилептическими приступами, стойким снижением интеллектуальных функций (деменцией), утратой произвольности движений, параличом.
Хроническая форма заболевания имеет менее выраженные симптомы, течение сравнительно легкое. У пациентов наблюдаются перепады настроения, неуклюжесть, ухудшается произношение. На протяжении нескольких лет снижаются интеллектуальные функции: утрачивается способность к абстрактному мышлению, сравнению и анализу явлений и предметов, нарастает забывчивость и рассеянность. Спустя несколько лет после начала болезни развиваются психические расстройства: больные неадекватны в поведении, аффективно возбудимы, склонны к состояниям ажитации и глубокой депрессии, подвержены психозам с галлюцинациями и бредом. При длительном течении формируется органическая деменция.
Осложнения
В число симптомов БТС входят эпилептические приступы, представляющие собой результат внезапных вспышек аномальной биоэлектрической активности мозга. При их высокой частоте физическая и психическая деградация происходит быстрее. Во время приступа больные падают, бьются в конвульсиях, что сопровождается высоким риском удушья (западение корня языка), получения смертельных травм. Основным осложнением острой инфантильной формы заболевания являются инфекции: у детей снижены функции иммунной системы, поражение органов дыхания носит рецидивирующий характер, протекает крайне тяжело. Распространенная причина смерти – пневмония.
Диагностика
Обследование проводится детским неврологом, офтальмологом, генетиком, психиатром. Процесс постановки диагноза начинается со сбора клинико-анамнестических данных. Как правило, выявляются случаи БТС у родственников, наличие периода нормального развития пациента, затем деградация – распад приобретенных навыков, сформировавшихся функций. Дифференциальная диагностика направлена на исключение дегенеративных заболеваний ЦНС, ювенильной идиотии, эпилепсии. Для подтверждения диагноза выполняются следующие процедуры:
Лечение болезни Тея-Сакса
В настоящее время эффективные способы терапии отсутствуют. Медицинская помощь больным нацелена на устранение симптомов и поддержание жизнедеятельности. Паллиативное лечение включает переход на зондовое питание, поскольку у пациентов утрачивается глотательный рефлекс, применение антибиотиков, противовирусных и иммуностимулирующих препаратов для борьбы с сопутствующими инфекционными заболеваниями. Терапия противоэпилептическими средствами не приносит положительного результата.
Поиск возможных способов лечения БТС продолжается. Исследования ведутся в трех направлениях: изучаются возможности ферментозаместительной, генной и субстратредуцирующей терапии. Замена отсутствующего фермента оказывается неэффективной из-за большого размера молекул гексозаминидазы, неспособных пройти сквозь гематоэнцефалический барьер и оболочку нейронов. Среди методов генотерапии опробовано введение нового генетического материала в клетки при помощи вирусного вектора и трансплантации стволовых клеток. Но положительных результатов не получено, исследования продолжаются. Наиболее перспективной считается субстратредуцирующая терапия с использованием фермента сиалидазы, который стимулирует катаболизм GM2 ганглиозидов. Ожидается разработка фармакологического препарата, повышающего экспрессию лизосомальных сиалидаз внутри нейронов.
Прогноз и профилактика
Болезнь Тея-Сакса
Болезнь Тея-Сакса – это редкое заболевание, передаваемое от родителей к ребенку. Оно вызвано отсутствием фермента, помогающего расщеплять жировые вещества, называемые ганглиозидами. Они накапливаются в головном мозге ребенка до токсической концентрации и негативно воздействуют на функцию нервных клеток. По мере прогрессирования заболевания ребенок теряет контроль над мышцами. Со временем это приводит к слепоте, параличу и смерти.
При наиболее распространенной форме симптомы у ребенка, как правило, начинают появляться примерно в 6-месячном возрасте. Клинические проявления и симптомы болезни Тея-Сакса могут включать:
Если у ребенка отмечаются какие-либо из вышеперечисленных признаков или симптомов, рекомендуется обратиться за консультацией к врачу.
Болезнь Тея-Сакса – это генетическое заболевание, которое передается от родителей к детям. Это происходит тогда, когда ребенок наследует ген от обоих родителей.
Для подтверждения диагноза обычно назначается анализ крови для установления уровня фермента гексозаминидазы. При болезни Тея-Сакса уровень будет низким или нулевым.
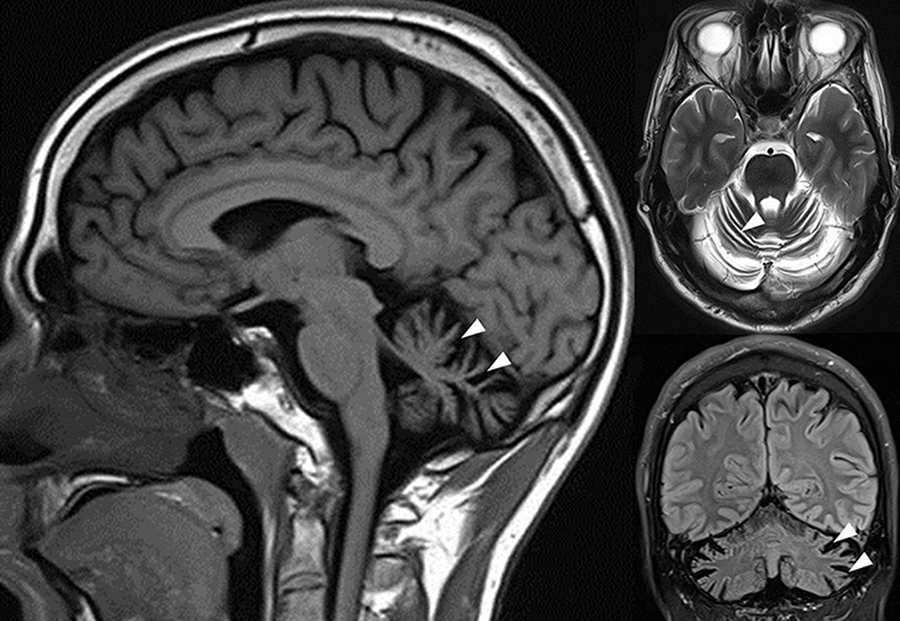
Во время тщательной проверки зрения ребенка врач может увидеть вишнево-красные пятна в задней части глаз ребенка, что является признаком болезни. Возможно, понадобится консультация детских невролога и офтальмолога для обследования нервной системы и глаз.
Излечения от болезни Тея-Сакса не существует, но некоторые методы терапии могут помочь в установлении контроля над симптомами. Поддерживающее лечение включает:
Место спасения: в России найдено лекарство от болезни Тея–Сакса
В России разработан препарат для лечения редкой детской болезни Тея–Сакса, которая сегодня считается смертельной. В его основе измененные стволовые клетки, которые помогают организму вырабатывать фермент гексозаминидаза А, способный остановить прогрессирование заболевания, рассказали «Известиям» казанские ученые. Лекарство испытали на лабораторных животных, оно показало высокую эффективность и безопасность. Клинические исследования начнутся в ближайшее время. И если они окажутся такими же успешными, наша страна станет единственной в мире, где можно будет спасти ребенка с такой патологией.
Преодолеть барьер
Болезнь Тея–Сакса (ранняя детская амавротическая идиотия) — редкое генетическое заболевание, при котором в организме ребенка перестает вырабатываться фермент гексозаминидаза А. Его нехватка приводит к разрушению головного и спинного мозга. Новорожденные в первые месяцы жизни развиваются нормально, однако в возрасте полугода начинают терять навыки, у них возникает регресс в психическом и физическом развитии. Младенцы перестают видеть, слышать, глотать, у них атрофируются мышцы и наступает паралич. Дети с Тея–Сакса редко доживают до четырех лет.
Российские ученые предлагают использовать для лечения этой болезни модифицированные стволовые клетки.
— В ходе работы мы взяли стволовые клетки из жировой ткани и добавили в них специальный ген с помощью вируса-носителя, — рассказал директор Научно-клинического центра прецизионной и регенеративной медицины Казанского федерального университета (вуз — участник проекта повышения конкурентоспособности образования «5-100») Альберт Ризванов. — В результате клетки получили способность вырабатывать фермент гексозаминидазу А, который может остановить прогрессирование болезни Тея–Сакса.
Ребенок с болезнью Тея–Сакса
По словам ученого, применение этого способа — единственно возможный вариант доставки необходимого вещества к пораженным участкам головного мозга. Это объясняется тем, что стволовые клетки способны преодолевать так называемый гематоэнцефалический барьер, который отделяет центральную нервную систему от общего кровотока и блокирует прямое проникновение фермента из крови в мозг. Кроме того, целевой доставке лекарства способствует свойство стволовых клеток мигрировать в те участки организма, которые получают повреждения.
В настоящее время новое лекарство уже прошло необходимые испытания на лабораторных животных, которые доказали его работоспособность и безопасность.
— В эксперименте мы использовали крыс, которым вводили генетически модифицированные (крысиные) стволовые клетки. Затем ученые следили за уровнем необходимого фермента в крови, — отметил Альберт Ризванов. — В результате испытаний было зафиксировано увеличение активности гексозаминидазы при полном отсутствии побочных явлений для организма.
Раз в квартал
По словам разработчиков препарата, пока рано судить о его клинической эффективности, однако предполагается, что воздействие от одной инъекции будет сохраняться в течение трех месяцев после введения лекарства. Это обусловлено относительно низкой способностью клеток к делению, поскольку их планируется брать у взрослых доноров.
Но при этом использование данных биоматериалов не будет нести дополнительных рисков, связанных с возникновением опухолей, в которые могут перерождаться более «ранние», эмбриональные стволовые клетки.
В настоящее время ученые готовятся к проведению клинического исследования, которое должно стартовать на базе Научно-клинического центра прецизионной и регенеративной медицины Казанского федерального университета.
— Это не первая попытка создать лекарство от болезни Тея–Сакса. В частности, ранее для этой цели проводили клинические исследования препарата Zavesca, которые не принесли положительного результата, — отметил заместитель заведующего лабораторией анализа показателей здоровья населения и цифровизации здравоохранения Московского физико-технического института Станислав Отставнов. — Если российская разработка покажет свою эффективность, ее применение действительно может стать единственным шансом для таких больных.
По словам эксперта, работа ученых из КФУ выглядит крайне перспективной и их исследованию необходимо оказывать дальнейшую поддержку.
Четверо на миллион
Существует и осторожный взгляд на создание нового лекарства.
— В своей работе для модификации стволовых клеток ученые использовали лентивирусные векторы, которые в некоторых случаях могут вызывать мутации, приводящие к онкологическим заболеваниям, — предупредил ведущий научный сотрудник сектора геномных механизмов онтогенеза Института цитологии и генетики СО РАН Вениамин Фишман. — В связи с этим стоит уделить особое внимание безопасности применения разработки.