Болезнь мотонейрона что это
Боковой (латеральный) амиотрофический склероз (и синдром БАС)
Боковой (латеральный) амиотрофический склероз (БАС) (также известен как болезнь моторных нейронов, Мотонейронная болезнь, болезнь Шарко, в англоязычных странах — болезнь Лу Герига) — прогрессирующее, неизлечимое дегенеративное заболевание центральной нервной системы, при котором происходит поражение как верхних (моторная кора головного мозга), так и нижних (передние рога спинного мозга и ядра черепно-мозговых нервов) двигательных нейронов, что приводит к параличам и последующей атрофии мышц.
Болезнь известна не так давно. Впервые описана Жан-Мартеном Шарко в 1869г. По статистике выявляется у 2-5 человек на 100 000 населения в год, что говорит о том, что данная патология относительно редко встречается. Всего в мире насчитывается около 70 тысяч больных боковым амиотрофическим склерозом. Обычно заболевание заявляет о себе у людей старше 50 лет.
Совсем недавно было высказано мнение, что случаи бокового амиотрофического склероза чаще регистрируются у высокоинтеллектуальных людей, профессионалов в своем деле, а также у спортсменов-атлетов, которые на протяжении всей жизни отличались крепким здоровьем.
Точная этиология БАС неизвестна.
Сущность болезни заключается в дегенерации двигательных нейронов, т.е. под воздействием ряда причин запускается процесс разрушения нервных клеток, ответственных за сокращения мышц. Этот процесс затрагивает нейроны коры больших полушарий, ядер головного мозга и нейроны передних рогов спинного мозга. Двигательные нейроны погибают, а их функции никто больше не выполняет. Нервные импульсы к мышечным клеткам больше не поступают. И мышцы слабеют, развиваются парезы и параличи, атрофия мышечной ткани.
Если в основе бокового амиотрофического склероза лежит мутация в гене супероксиддисмутазы-1, то процесс выглядит примерно следующим образом. Мутантная супероксиддисмутаза-1 накапливается в митохондриях двигательных нейронов (в энергетических станциях клетки). Это «мешает» нормальному внутриклеточному транспорту белковых образований. Белки соединятся друг с другом, как бы слипаются, и это запускает процесс дегенерации клетки.
Если причиной становится избыток глутамата, то механизм запуска разрушения двигательных нейронов выглядит так: глутамат открывает каналы в мембране нейронов для кальция. Кальций устремляется внутрь клеток. Избыток кальция, в свою очередь, активирует внутриклеточные ферменты. Ферменты как бы «переваривают» структуры нервных клеток, при этом образуется большое количество свободных радикалов. И эти свободные радикалы повреждают нейроны, постепенно приводя к их полному разрушению.
Предполагается, что роль других факторов в развитии БАС также заключается в запуске свободнорадикального окисления.
Классификация БАС, формы:
Общими симптомами, характерными для любой из форм бокового амиотрофического склероза, являются:
Начальные проявления заболевания:
•слабость в дистальных отделах рук, неловкость при выполнении тонких движений пальцами, похудание в кистях и фасцикуляции (мышечные подергивания)
•реже заболевание дебютирует слабостью в проксимальных отделах рук и плечевом поясе, атрофиями в мышцах ног в сочетании с нижним спастическим парапарезом
•возможно также начало заболевания с бульбарных расстройств – дизартрии и дисфагии (25% случаев)
•крампи (болезненные сокращения, спазмы мышц), нередко генерализованные, встречаются практически у всех больных БАС, и нередко являются первым признаком заболевания
Для БАС в большинстве случаев характерна асимметричность симптоматики.
При этой форме заболевания возможно два варианта:
Также может дебютировать двумя способами:
В руках по мере прогрессирования болезни формируется парез с атрофическими изменениями, повышением рефлексов, повышением тонуса и патологическими стопными признаками. Аналогичные изменения возникают и в ногах, но несколько позже.
Это разновидность бокового амиотрофического склероза, когда заболевание протекает с преимущественным поражением центрального мотонейрона. При этом во всех мышцах туловища и конечностей формируются парезы с повышением мышечного тонуса, патологическими симптомами.
Бульбарная и высокая формы БАС являются прогностически неблагоприятными. Больные с таким началом заболевания имеют меньшую продолжительность жизни по сравнению с шейно-грудной и пояснично-крестцовой формами. Какими бы ни были первые проявления заболевания, оно неуклонно прогрессируют.
Парезы в различных конечностях приводят к нарушению способности самостоятельно передвигаться, обслуживать себя. Вовлечение в процесс дыхательной мускулатуры приводит вначале к появлению одышки при физической нагрузке, затем одышка беспокоит уже в покое, появляются эпизоды острой нехватки воздуха. В терминальных стадиях самостоятельное дыхание просто невозможно, больным требуется постоянная искусственная вентиляция легких.
Продолжительность жизни больного БАС составляет по разным данным от 2 до 12 лет, однако более 90% больных умирают в течение 5 лет от момента постановки диагноза. В терминальную стадию болезни больные полностью прикованы к постели, дыхание поддерживается с помощью аппарата искусственной вентиляции легких. Причиной гибели таких больных может стать остановка дыхания, присоединение осложнений в виде пневмонии, тромбоэмболии, инфицирования пролежней с генерализацией инфекции.
Среди параклинических исследований наиболее существенное диагностическое значение имеет электромиография. Выявляется распространенное поражение клеток передних рогов (даже в клинически сохранных мышцах) с фибрилляциями, фасцикуляциями, позитивными волнами, изменениями потенциалов двигательных единиц (увеличивается их амплитуда и длительность) при нормальной скорости проведения возбуждения по волокнам чувствительных нервов. Содержание КФК в плазме может быть незначительно повышено
Боковой амиотрофический склероз нужно заподозрить:
•при развитии слабости и атрофий, а возможно и фасцикуляций (мышечных подергиваний) в мышцах кисти
•при похудания мышц тенара одной из кистей с развитием слабости аддукции (приведения) и оппозиции большого пальца (обычно асимметрично)
•при этом наблюдается затруднение при схватывании большим и указательным пальцами, затруднения при подбирании мелких предметов, при застегивании пуговиц, при письме
•при развитии слабости в проксимальных отделах рук и плечевом поясе, атрофий в мышцах ног в сочетании с нижним спастическим парапарезом
•при развитии у пациента дизартрии (нарушений речи) и дисфагии (нарушений глотания)
•при появлении у пациента крампи (болезненных мышечных сокращений)
Диагностические критерии БАС:
Критерии подтверждения БАС:
Диагноз БАС подьверждается:
Дифференциальный диагноз БАС (синдромы похожие на БАС):
•Спондилогенная шейная миелопатия.
•Опухоли краниовертебральной области и спинного мозга.
•Краниовертебральные аномалии.
•Сирингомиелия.
•Подострая комбинированная дегенерация спинного мозга при недостаточности витамина В12.
•Семейный спастический парапарез Штрюмпеля.
•Прогрессирующие спинальные амиотрофии.
•Постполиомиелитический синдром.
•Интоксикации свинцом, ртутью, марганцем.
•Недостаточность гексозаминидазы типа А у взрослых при ганглиозидозе GM2.
•Диабетическая амиотрофия.
•Мультифокальная моторная невропатия с блоками проведения.
•Болезнь Крейцтфельдта-Якоба.
•Паранеопластический синдром, в частности при лимфогранулематозе и злокачественной лимфоме.
•Синдром БАС при парапротеинемии.
•Аксональная нейропатия при болезни Лайма (Лайм-боррелиозе).
•Синдром Гийена-Барре.
•Миастения.
•Рассеянный склероз
•Эндокринопатии (тиреотоксикоз, гиперпаратиреоз, диабетическая амиотрофия).
•Доброкачественные фасцикуляции, т.е. фасцикуляции, продолжающиеся годами без признаков поражения двигательной системы.
•Нейроинфекции (полиомиелит, бруцеллез, эпидемический энцефалит, клещевой энцефалит, нейросифилис, болезнь Лайма).
•Первичный боковой склероз.
Диагностические исследования при синдроме БАС.
Для уточнения диагноза и проведения дифференциального диагноза при синдроме БАС рекомендутся следующее обследование больного:
Анализ крови (СОЭ, гематологические и биохимические исследования)
Рентгенография органов грудной клетки
Исследование функций щитовидной железы
Определение содержания витамина В12 и фолиевой кислоты в крови
Креатинкиназа в сыворотке
МРТ головного мозга и при необходимости, спинного мозга
Эффективного лечения заболевания не существует. Единственный препарат, ингибитор высвобождения глутамата рилузол (Рилутек), отодвигает летальный исход на 2 – 4 месяца. Его назначают по 50 мг два раза в день.
Основу лечения составляет симптоматическая терапия:
•Физическая активность. Пациент должен по мере своих возможностей поддерживать физическую активность По мере прогрессирования заболевания возникает необходимость в кресле-каталке и других специальных приспособлениях.
•Диета. Дисфагия создаёт опасность попадания пищи в дыхательные пути • Иногда возникает необходимость в питании через зонд или в гастростомии.
•Применение ортопедических приспособлений: шейного воротника, различных шин, устройств для захвата предметов.
•При крампи (болезненным мышечных спазмах): карбамазепин (Финлепсин, Тегретол) и/или витамин Е, а также препараты магния, верапамил (Изоптин).
•При спастичности: баклофен (Баклосан), Сирдалуд, а также клоназепам.
•При слюнотечении атропин, или гиосцин (Бускопан).
•При невозможности приема пищи вследствие нарушения глотания накладывают гастростому или вводят назогастральный зонд. Раннее проведение чрезкожной эндоскопической гастростомии продлевает жизнь пациентов в среднем на 6 месяцев.
•Церебролизин в высоких дозах (10-30 мл в/в капельно 10 дней повторными курсами). Существует ряд небольших исследований, показывающих нейропротективную эффективность церебролизина при БАС.
•Антидепрессанты: Серталин или Паксил или Амитриптилин (часть больных БАС предпочитает именно его как раз из-за побочных действий – он вызывает сухость во рту, соответственно уменьшает гиперсаливацию (слюнотечение), часто мучающую больных БАС).
•При появлении дыхательных нарушений: искусственная вентиляция легких в условиях стационаров, как правило, не проводится, но некоторые больные приобретают портативные приборы ИВЛ и проводят ИВЛ в домашних условиях.
•Ведутся разработки к применению гормона роста, нейротрофических факторов при БАС.
•Последнее время активно ведутся разработки лечения стволовыми клетками. Этот метод обещает быть перспективным, но все же пока находится на стадии научных экспериментов.
•Боковой амиотрофический склероз является фатальным заболеванием. Средняя продолжительность жизни больных БАС 3 – 5 лет, тем не менее, 30% больных живут 5 лет, а около 10 – 20% живут более 10 лет от начала заболевания.
•Неблагоприятные прогностические признаки – пожилой возраст и бульбарные нарушения (после появления последних больные живут не более 1 – 3 лет).
Болезнь двигательного нейрона: причины, виды, симптомы и лечение
Болезнь двигательного нейрона по МКБ-10 относится к классу болезней с системной атрофией элементов центральной нервной системы. Болезнь двигательного нерва (БДН) также называют боковой амиотрофический склероз (БАС) или болезнь моторных нейронов. Это заболевание характеризуется поражением верхних нейронов головного мозга с последующим нарушением их связи со спинным мозгом. В результате заболевания развивается паралич всего тела.
На сегодняшний день БДН относится к неизлечимым заболеваниям. Все терапевтические средства направлены на замедление прогрессирования патологического процесса и улучшение качества жизни пациента. В Юсуповской больнице высококвалифицированные неврологи выполняют поддерживающую терапию пациентов с БДН, которая способствует облегчению их состояния.
Причины
Исходя из того, что болезнь двигательного нейрона по МКБ-10 относят к системным атрофиям с поражением преимущественно центральной нервной системы, основными ее характеристиками являются дегенеративные процессы в центральных извилинах лобных долей.
Разрушительный процесс распространяется на ядра двигательных нейронов ствола головного мозга с изменением в кортикоспинальных путях. В результате происходит медленно прогрессирующая мышечная атрофия.
Исследования показали, что инфекционные заболевания, такие как полиомиелит, не вызывают болезнь двигательного нерва, хотя и характеризуются прогрессирующей мышечной атрофией. Патологии хоть и имеют примерно одинаковый конечный результат, но механизмы их действия разные.
Болезнь двигательного нейрона: виды
первичный боковой склероз;
прогрессирующую мышечную атрофию;
болезнь двигательного нейрона, бульбарная форма;
первичный латеральный склероз.
Болезнь характеризуется дегенерацией двигательных нейронов в коре головного мозга, стволе головного мозга, кортикоспинальных путях и спинном мозге. В результате происходит прогрессирующий мышечный паралич.
Заболевание относится к редким. Его распространенность составляет примерно 2-3 человека на 100 тысяч в год. Наиболее часто болезнь возникает у людей в возрасте 60-70 лет, хотя не исключено развитие патологии и у людей младше 40 лет.
Симптомы
Прогрессирующая мышечная атрофия вызывается дистрофическими процессами в моторных нейронах. Клинические проявления будут зависеть от того, в какой группе клеток произошло нарушение. Например, болезнь двигательного нейрона с боковым амиотрофическим склерозом возникает в результате поражения нейронов в прецентральной мозговой извилине и стволе спинного мозга. Спастическая параплегия развивается при нарушениях в прецентральной мозговой извилине. Прогрессирующий бульбарный паралич происходит на фоне изменений в работе бульбарной группы каудальных нервов с поражением их ядер и корешков.
Боковой амиотрофический склероз (БАС)
Впервые заболевание описано французом Жаном-Мартеном Шарко в 1869 году. Это самая распространенная форма заболевания (около 80-85% всех случаев БДН), когда в патологический процесс вовлечены двигательные нейроны и головного, и спинного мозга.
Болезнь характеризуется неуклонно прогрессирующей мышечной слабостью и атрофиями мышц. В зависимости от уровня локализации первичного поражения двигательных нейронов различают бульбарную форму заболевания, когда первично повреждаются мотонейроны в стволе головного мозга, шейно-грудную форму – при локализации первичного очага поражения на уровне шейного утолщения и пояснично-крестцовую форму заболевания. Наиболее благоприятным вариантом течения считается пояснично-крестцовая форма БАС. Средняя продолжительность жизни таких больных может достигать 7-8 лет. В некоторых случаях длительность заболевания достигает 10 или даже 15 лет. Болезнь развивается, как правило, на 5-6 десятке жизни и в 2 раза чаще встречается у мужчин.
Дебютирует болезнь в большинстве случаев с появления слабости и похудания в мышцах рук или ног, часто сопровождается мышечными подергиваниями (фасцикуляциями), однако следует помнить, что наличие изолированных мышечных подергиваний без появления слабости или гипотрофий не всегда является признаком БАС!
Среди известных людей БАС страдали композитор Дмитрий Шостакович, китайский политический деятель Мао Цзэдун, певец Владимир Мигуля, американский астрофизик Стивен Хокинг, длительность заболевания у которого превышает 50 лет.
Прогрессирующий бульбарный паралич (ПБП)
Первичный латеральный склероз (ПЛС)
Прогрессирующая мышечная атрофия (ПМА), синдром свисающих рук
Это редкий вид БДН, при котором в основном повреждаются двигательные нейроны спинного мозга. Заболевание в большинстве случаев начинается со слабости или неловкости в руках. Большинство людей живут с этим видом БДН более 5 лет.
Здесь приведены наиболее часто встречающиеся симптомы и характеристики разных видов БДН. Однако необходимо помнить, что при одном и том же виде болезни двигательного нейрона симптомы у разных людей могут проявляться по-разному, прогноз также может отличаться.
При появлении таких симптомов, как постепенно нарастающие речевые нарушения, поперхивание при глотании, слабость в руках и ногах, мышечные подергивания, следует, как можно раньше обратиться за медицинской помощью к высококвалифицированным неврологам Юсуповской больницы, которые помогут определить причины и назначить адекватное лечение.
Необходимо понимать, что диагностика БАС весьма затруднительна, так как это достаточно редкое заболевание, и зачастую неврологи в своей практике встречают единичные случаи данного заболевания. Отсутствие определенных специфических симптомов заболевания также затрудняет диагностику БАС. Известно, что диагноз устанавливается в среднем через 1-1,5 года от момента появления первых симптомов, и время для лечения уже упущено.
Диагностика
Существуют несколько методов и показателей диагностики, которые указывают на страдание двигательных нейронов и мышц.
Анализ крови
Основным показателем, который может указать на страдание двигательных нейронов и мышц – это уровень креатинфосфокиназы. Уровень фермента увеличивается при распаде мышечной ткани, и его уровень может быть повышен у людей, страдающих БАС. Однако данный показатель не является специфическим признаком патологии, поскольку может быть индикатором и других заболеваний, связанных с поражением мышц (инфаркт миокарда, миозиты, травмы).
Электронейромиография (ЭНМГ)
Для точной диагностики БАС необходимо проведение как игольчатой электромиографии, с использованием тонких игл, с помощью которых врач оценивает состояние электрической активности поврежденных и неповрежденных мышц, так и стимуляционной электронейромиграфии для исключения нарушения проведения по чувствительным волокнам, которые при БАС практически всегда остаются нетронутыми.
Транскраниальная магнитная стимуляция (ТМС)
Это новый метод, который может быть проведен одновременно с ЭНМГ. Он разработан для оценки состояния двигательных нейронов головного мозга. Результаты ТМС могут помочь в постановке диагноза.
Магнитно-резонансная томография (МРТ)
МРT способна выявить повреждения в головном и спинном мозге, вызванные инсультом, болезнью Альцгеймера, болезнью Паркинсона, рассеянным склерозом, опухолями и травмами спинного и головного мозга. В отдельных случаях при проведении МРТ выявляются признаки, характерные только для БДН/БАС – это свечение пирамидных путей, которые поражаются при этом заболевании.
Другие методы
Для верификации диагноза также необходимо проведение люмбальной пункции, оценки функции внешнего дыхания, проведение кардиореспираторного мониторинга. Данные исследования позволяют выявлять изменения, которые на ранних этапах не беспокоят пациента, однако вносят губительный вклад в прогрессирование заболевания.
Всегда следует помнить, что БАС – это болезнь исключения, и окончательный диагноз ставится только после полноценного качественного обследования пациента под наблюдением опытных неврологов, имеющих большой опыт работы с такими пациентами.
Цели терапии
В настоящее время не существует эффективных методов лечения данного заболевания. Поэтому терапия направлена на то, чтобы:
замедлить прогрессирование болезни и продлить период заболевания, при котором больной не нуждается в постоянном постороннем уходе;
уменьшить выраженность отдельных симптомов болезни и поддерживать стабильный уровень качества жизни.
Лечение
На сегодняшний день к неизлечимым заболеваниям относят и болезнь двигательного нейрона. Случаи выздоровления не были зафиксированы. Все средства современной медицины направлены на замедление развития дегенеративных процессов и улучшение состояния больного.
Единственным препаратом в лечении БДН, эффективность которого была доказана двумя независимыми клиническими исследованиями, является Рилузол (Рилутек). Его действие направлено на снижение уровня глутамата, который освобождается во время передачи нервных импульсов. Также положительное действие имеют препараты, связывающие свободные радикалы, и антиоксиданты.
Есть новые разработки в лечении болезни двигательного нейрона. Многие исследования доказывают иммунологическую природу развития патологии, однако, достоверно эффективные лекарства еще находятся на стадии усовершенствования.
К симптоматической терапии относят средства для улучшения состояния пациента. Применяют миорелаксанты для устранения болезненных спазмов мышц. Обязательно проводят поддержку дыхания с помощью неинвазивной вентиляции легких при помощи специальной маски.
При затруднениях при глотании кормление выполняется через зонд. Для этого составляется специальный рацион, удовлетворяющий все потребности организма в питательных веществах.
Прогноз заболевания неблагоприятный. В редких случаях больные живут до 10 лет. Обычно продолжительность жизни составляет 2-4 года после постановки диагноза.
В Юсуповской больнице предоставляют качественную паллиативную помощь больным с болезнью двигательного нерва. В отделении неврологии работает профессиональный медицинский персонал, который владеет спецификой оказания помощи подобным больным. В Юсуповской больницы созданы все условия для комфортного пребывания пациента с предоставлением ему всех необходимых медицинских услуг.
Болезнь мотонейрона что это
Семейный анамнез в плане других нейродегенеративных заболеваний
Курение – наиболее постоянный негенетический фактор риска
Отдельные виды спорта (американский и английский футбол), изнуряющий физический труд
Эпидемиологические исследования описывают значение различных внешних факторов. Так, например, среди офицеров и солдат армии США, участников активных боевых действий в войне в Ираке, заболеваемость была в 2,5 раза выше, чем в общей популяции. Возможно, это связано с использованием в боеприпасах металлов и химических реагентов, с ранениями, травмами головы, а также с повышенными физическими и психическими перегрузками или перенесенными вирусными заболеваниями в условиях жаркого климата [6].
Британскими и американскими учеными проводилось изучение влияния перенесенных травм головы у профессиональных спортсменов как возможного фактора риска возникновения БДН. Было проведено несколько исследований по данной проблеме. Результаты части исследований были признаны необъективными ввиду небольшой выборки. Также следует учитывать, что у спортсменов, вероятно, могла иметь место хроническая травматическая энцефалопатия – нейродегенеративное заболевание, связанное с множественными и повторными травмами головы.
Генетическая предрасположенность, по мнению многих экспертов, является обязательным условием развития заболевания, однако не все гены, повреждение которых повышает риск БДН, на сегодняшний день известны. В семейных формах болезни генетическую причину выявляют в 68 % случаев, в то время как в спорадических формах – только в 11 % [7].
В развитии семейной БДН участвуют более 20 генов. Наиболее частая причина семейного типа – мутации в C9orf72 (40 %), SOD1 (20 %), FUS (1–5 %) и TARDBP (1–5 %) [8]. Риск развития заболевания у родственников первой степени родства человека с БДН составляет около одного процента.
Болезнь мотонейрона характеризуется олигогенным типом наследования, то есть заболевание возникает только при мутации сразу в двух или более генах.
Гены, приводящие к возникновению БДН, условно можно разделить на основные патологические подтипы: аномальная укладка и агрегация протеинов, повреждение цитоскелета и процессинг РНК с развитием вторичных нарушений белкового обмена [9].
Ввиду мультифакторности и сложности этиологии и патогенеза данного заболевания этиотропная терапия на сегодняшний день не разработана, поэтому важную роль играют препараты, замедляющие прогрессирование болезни, а также снижающие проявления симптоматики [10].
Рилузол – препарат, ингибирующий высвобождение нейромедиатора глутамата (одобрен в 1995 г.). Довольно хорошо переносится, но обладает ограниченной эффективностью: повышает продолжительность жизни приблизительно на три месяца в терминальной стадии, не улучшая при этом ее качества [11].
Эдаравон – поглотитель свободных радикалов (одобрен в США в 2017 г.). Замедляет скорость прогрессирования болезни на 33 %, а также снижает темпы ухудшения качества жизни с БДН в целом [12].
Таким образом, паллиативная медицина играет основную роль в оказании помощи больным с БДН. Для ее эффективного и своевременного проведения необходима надежно функционирующая программа диагностирования этой патологии, а также прогнозирования темпов развития заболевания [13].
Основными инструментами прогнозирования в настоящее время служат:
– клиническая картина и формы заболе- вания;
– шкала функционального дефицита ALS FRS-R и др.;
– модель прогнозирования ENCALS.
Оценка функционального состояния и темпы прогрессирования БДН оцениваются по специализированным оценочным шкалам, одной из которых является ALSFRS-R. Данная шкала используется в диагностике, при оценке прогрессирования заболевания, при определении результатов клинических испытаний. Применение ALSFRS-R ограничено тем, что она не применима для сравнения оценок людей с различной манифестацией заболевания.
Дабы оценить темпы БДН, необходимо сравнить баллы, выставленные при диагностике заболевания, с баллами, рассчитанными во время динамического наблюдения [14].
Скорость прогрессирования определяется по формуле: суммарный балл по ALSFRS-R/длительность заболевания в месяцах.
Модель прогнозирования ENCALS – это компьютеризированная автоматическая система определения вероятной продолжительности жизни. Расчет проводится на основе следующих данных: дата рождения пациента, дата начала заболевания, дата диагностики БДН, ALS FRS-R (c датой), бульбарная/спинальная форма, наличие/отсутствие мутации в гене C9orf72, наличие/отсутствие лобно-височной деменции, форсированная жизненная емкость легких (ФЖЕЛ) [15, 16].
На сегодняшний день разработан ряд методов для стадирования БАС. Наиболее востребованными являются функциональная система Милано – Торино (ALS-MiToS) и система Королевского колледжа Лондона (King’s clinical staging system). Обе системы основаны на стандартных клинических наблюдениях [17].
Стадии БАС по King’s clinical staging system
Оценка состояния двигательной системы больных проводится по количеству пораженных уровней пирамидного тракта:
– руки – изменение тонуса, гипотрофии, слабость, повышение или снижение рефлексов;
– ноги – изменение тонуса, гипотрофии, слабость, повышение или снижение рефлексов;
– бульбарные нарушения – гипотрофия языка, слюнотечение, дизартрия, фасцикуляции мышц языка, повышение подбородочного рефлекса.
При исследовании оцениваются симптомы поражения всех трех регионов (критерием вовлечения уровня является наличие хотя бы одного симптома).
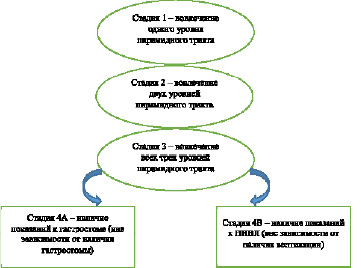
Система состоит из четырех стадий (рисунок), летальный исход считается последней, пятой стадией.
Стадии БАС по системе Королевского колледжа Лондона
Таким образом, на четвертую стадию больной переводится в том случае, если у него выявляются показания для гастростомы или для вспомогательной вентиляции легких, независимо от стадии, на которой появились данные показания. Четвертая стадия характеризуется критическим состоянием пациента: выраженная дисфагия, дыхательная недостаточность [18, 19].
Показанием для гастростомии является выраженная дисфагия. Заброс частиц еды в дыхательные пути вызывает аспирационную пневмонию, что отличается тяжелым течением и высокой степенью резистентности к проводимой терапии. Постоянный дефицит питательных веществ, в свою очередь, вызывает резкое похудение вплоть до кахексии. Таким образом критерии для проведения гастростомы: снижение массы тела на 10 % и/или невозможность полноценно есть ртом [20–22].
Наиболее предпочтительным видом гастростомы для данных больных является чрескожная эндоскопическая гастростомия (ЧЭГ), так как ее проведение возможно у пациентов с высоким операционным риском и не требует общего наркоза с возможностью проведения у постели больного [23, 24].
Учитывая, что БАС неизбежно приводит к терминальной дыхательной недостаточности (ДН), чрезвычайно важную роль играет НИВЛ (неинвазивная вентиляция легких) как основной метод ее лечения.
Критерии для вспомогательной вентиляции легких: жизненная емкость легких ниже 50 % или 80 % в сочетании с симптомами гиповентиляции: ортопноэ, одышка при нагрузке, избыточная дневная сонливость. Первоначально назначается НИВЛ. Если удается контролировать симптоматику, то пациент остается на НИВЛ с регулярной оценкой эффективности (раз в 3 месяца). НИВЛ не может полностью взять на себя функцию дыхания: со временем человек с БДН вновь начинает испытывать прежнюю симптоматику из-за прогрессирования заболевания. В таком случае назначается искусственная вентиляция легких, которая способна полностью заместить собственное дыхание больного независимо от слабости дыхательной мускулатуры и стадии заболевания [25–27].
Результаты исследования и их обсуждение
– Несмотря на то, что данное заболевание было впервые описано более 100 лет назад, вопрос этиологии до сих пор остается открытым.
– Специфического лечения БДН в настоящее время не существует. Эдаравон, рилузол и паллиативная медицина способны продлить жизнь пациента лишь на несколько месяцев.
– В вопросе прогнозирования медицина далеко шагнула вперед, но остается нерешенной проблема сравнения течения БДН у больных с различным началом заболевания.
Заключение
Клинические и экспериментальные исследования в области генетики являются перспективным направлением в изучении данной патологии. Это позволит не только установить этиологию заболевания, но и создать новые подходы к лечению, что продлит жизнь больных и улучшит ее качество.