Болезнь кавасаки что это такое
Что такое синдром Кавасаки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Похлебкиной А. А., педиатра со стажем в 5 лет.
Определение болезни. Причины заболевания
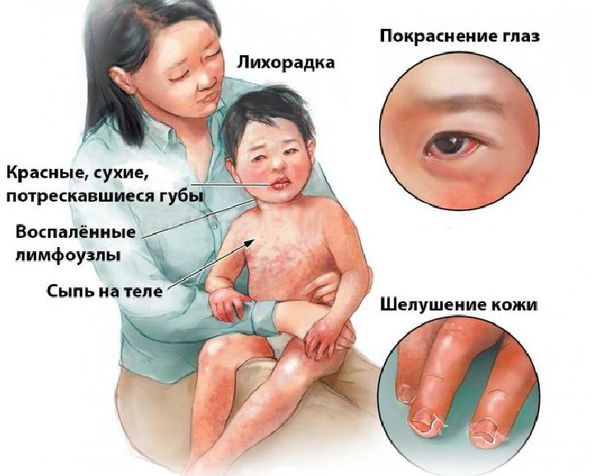
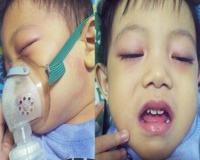
Болезнь или синдром Кавасаки — это острое воспаление сосудов, которое встречается в основном у младенцев и детей в возрасте до пяти лет. Сопровождается лихорадкой, шелушением кожи и симптомами острого воспаления: гиперемией слизистой оболочки глазного яблока, покраснением слизистой оболочки полости рта, сыпью, увеличением шейных лимфатических узлов, покраснением и отёками кистей и стоп.
Симптомы синдрома Кавасаки
Большинство детей с болезнью Кавасаки нуждаются в медицинской помощи из-за продолжительной лихорадки. Основные симптомы заболевания [3] :
Раздражительность (беспокойство, плаксивость) является важным признаком, который почти всегда присутствует, хотя и не входит в диагностические критерии. Точный механизм раздражительности неясен, но это может быть связано с наличием неинфекционного менингита. Другие относительно распространённые состояния при болезни Кавасаки: артрит, пневмония, увеит, гастроэнтерит (заболевание желудочно-кишечного тракта), дизурия (расстройство мочеиспускания), отит (воспаление среднего уха).
Патогенез синдрома Кавасаки
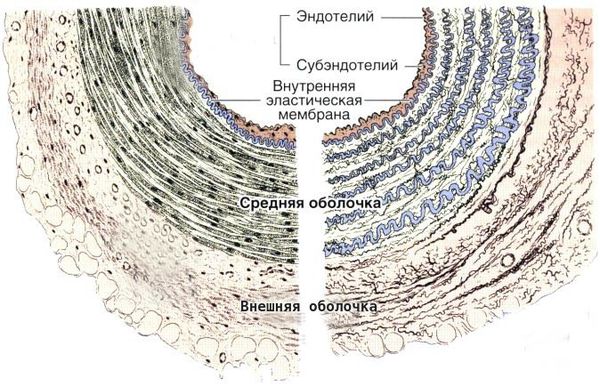
Болезнь Кавасаки — это генерализованный системный васкулит, вовлекающий кровеносные сосуды по всему организму. Сосудистое воспаление наиболее выражено в коронарных артериях, но также может возникать в венах, капиллярах, мелких артериолах и крупных артериях. На ранних стадиях заболевания наблюдаются отёк эндотелия и субэндотелия сосуда. Отёки возникают из-за выраженной стимуляции цитокинового каскада и активацией эндотелиальных клеток, но внутренняя эластическая мембрана остается неповреждённой.
Цитокины — это белковые молекулы, вырабатываемые клетками для регуляции иммунного ответа. Они работают по принципу эстафеты: воздействие цитокина на клетку вызывает образование ею других цитокинов, этот процесс называется цитокиновым каскадом.
Воспалённые клетки вырабатывают различные цитокины и матриксные металлопротеиназы (ферменты, способные разрушать компоненты внеклеточного матрикса соединительных тканей), которые нацелены на эндотелиальные клетки. В результате происходит фрагментация внутренней эластической мембраны и повреждение сосудов.
Активное воспаление в течение нескольких недель или месяцев сменяется прогрессирующим фиброзом (разрастанием соединительной ткани) с образованием рубцов. В результате активного изменения сосудистой стенки и появления новых сосудов развивается стеноз (сужение просвета сосудов).
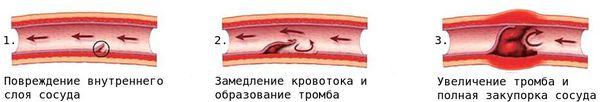
При повреждении мелких кровеносных сосудов к месту повреждения устремляются тромбоциты и образуют сгусток — тромб, закрывающий место дефекта сосуда.
Вследствие стеноза либо тромбоза просвет сосуда со временем сужается или закупоривается, что создаёт риск смерти от сердечно-сосудистых заболеваний, например от инфаркта миокарда.
Классификация и стадии развития синдрома Кавасаки
Существует две формы болезни Кавасаки:
Острая стадия начинается с внезапного повышения температуры и длится примерно 7–14 дней. Лихорадка обычно сопровождается сильным всплеском и периодическими пиковыми температурами 39-40 °С и выше. Если лихорадка сохраняется, это может быть признаком рецидивирующей болезни Кавасаки. При таком течении заболевания высокая температура не снижается от приёма жаропонижающих препаратов и может сохраняться до 3–4 недель. После введения ВВИГ (внутривенного иммуноглобулина) лихорадка обычно проходит в течение 36 часов.
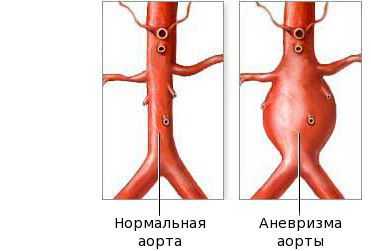
Подострая стадия начинается, когда лихорадка утихла, и продолжается до 4–6 недель. Отличительные признаки этой стадии: шелушение кожи пальцев, тромбоцитоз (количество тромбоцитов может превышать 1 млн/мкл) и развитие аневризмы. Если лихорадка держится более 2–3 недель возрастает риск сердечных осложнений. На этой стадии наиболее высок риск внезапной смерти.
Фаза выздоровления характеризуется полным исчезновением клинических признаков болезни, как правило, в течение трёх месяцев после начала заболевания. Эта стадия начинается с возврата к исходному уровню показателей: снижению количества тромбоцитов, лейкоцитов, СОЭ. На стадии выздоровления сердечные аномалии всё ещё могут быть выражены. Небольшие аневризмы в 60 % случаев разрешаются самостоятельно, но крупные могут расширяться, что создаёт риск инфаркта миокарда.
Хроническая стадия имеет клиническое значение только у тех пациентов, у которых развились сердечные осложнения. Она продолжается всю жизнь. В некоторых случаях недиагностированные разрывы аневризм во взрослом возрасте и эпизоды лихорадок неясного происхождения в детстве могут быть нераспознанными случаями болезни Кавасаки.
Осложнения синдрома Кавасаки
За последние пятьдесят лет болезнь Кавасаки стала одним из самых распространённых приобретённых пороков сердца у детей в мире.
Осложнения заболевания [11] :
После болезни Кавасаки из-за длительного стеноза коронарной артерии может развиться ишемическая болезнь сердца. Тяжёлый локализованный стеноз из-за утолщения коронарной стенки после болезни Кавасаки может вызвать ишемию миокарда. Возникновение гигантской аневризмы часто свидетельствует о многососудистом поражении. Инфаркт миокарда у пациентов с гигантскими двусторонними аневризмами сильно влияет на исходы выживания на ранних и поздних стадиях после начала болезни Кавасаки.
Диагностика синдрома Кавасаки
Типичная первоначальная лабораторная оценка может включать:
При острой стадии заболевания на ОАК часто выявляется анемия лёгкой и средней степени тяжести.
Во время подострой стадии распространён тромбоцитоз — повышение уровня тромбоцитов. Количество тромбоцитов начинает расти на второй неделе от начала заболевания и продолжает увеличиваться на третьей неделе. Повышение уровня маркеров воспаления, таких как СОЭ и СРБ, ― частое явление, но иногда они лишь незначительно возрастают.
Повышенные или умеренно высокие уровни сывороточных трансаминаз или гамма-глутамилтранспептидаз встречаются у 40–60 % пациентов, а лёгкая гипербилирубинемия (увеличение количества билирубина в крови) ― у 10 %. Гипоальбуминемия связана с более тяжёлым и длительным острым заболеванием. Анализ мочи может показывать пиурию (выделение гноя с мочой) у 80 % детей.
Для острой фазы болезни Кавасаки характерно нарушение липидного обмена, которое в конечном итоге приводит к снижению общего холестерина в сыворотке, особенно ЛПВП (липопротеинов высокой плотности), и увеличению триглицеридов.
При подозрении на болезнь Кавасаки выполняют эхокардиографию (ЭхоКГ). В дальнейшем исследование повторяют через 1–2 недели и через 5–6 недель после начала заболевания.
На электрокардиографии (ЭКГ) может определяться тахикардия, удлинённый интервал PR, изменение волны ST-T и снижение напряжения R-волн, указывающие на миокардит. Изменения волн Q или ST-T могут указывать на инфаркт миокарда.
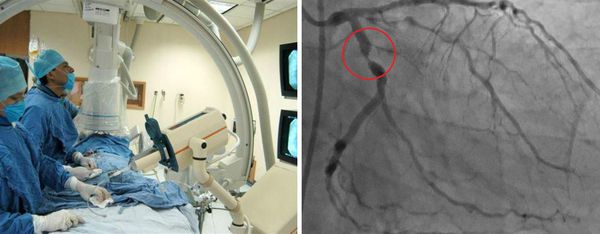
Отдельной группе пациентов может потребоваться катетеризация сердца и ангиография. Ангиография сосудов позволяет детально исследовать артерии, но это может быть связано с большим риском осложнения во время манипуляции, особенно при выполнении в острой фазе заболевания. Коронарная компьютерная томографическая ангиография и магнитно-резонансная ангиография также будут полезны при оценке состояния и наблюдении за коронарными артериями.
Ультразвуковое исследование показано при дисфункции того или иного органа. Пациентам с клиническими признаками менингита проводят люмбальную пункцию (взятие пробы спинномозговой жидкости).
Лечение синдрома Кавасаки
Основные цели лечения — подавить воспалительную реакцию и минимизировать риски развития аневризм коронарных артерий и других сердечных осложнений.
В качестве «первой линии» лечения детей с болезнью Кавасаки применяют ВВИГ (внутривенные иммуноглобулины). Препараты наиболее эффективны, если назначены в течение первых 10 дней после начала лихорадки. В современной практике доза составляет 2 г/кг внутривенно в течение 10–12 часов.
Если после введения ВВИГ лихорадка сохраняется или возникает в течение 36 часов и позднее, то во многих из этих случаев рекомендуется повторное лечение ВВИГ в исходной дозе. Некоторые пациенты могут быть резистентными к действию ВВИГ, в таких случаях Американская кардиологическая ассоциация рекомендует пульс-терапию метилпреднизолоном, приём инфликсимаба, циклоспорина А, метотрексата и плазмаферез.
Большинство врачей используют аспирин в средних и высоких дозах в течение всего периода лихорадки, затем лекарство применяется в более низких дозах. Высокие дозировки требуются в острой фазе болезни для достижения противовоспалительного эффекта, в то время как более низкие дозировки препятствуют тромбообразованию в подостром периоде, когда существует риск развития аневризмы.
Прогноз. Профилактика
При отсутствии ишемической болезни сердца прогноз для полного выздоровления хороший. Примерно две трети коронарных аневризм подвергаются регрессу в течение первого года. Гигантские аневризмы исчезают реже и требуют более интенсивного наблюдения и лечения.
Пациентам с тяжёлыми сердечными осложнениями может потребоваться катетеризация, шунтирование коронарной артерии или даже пересадка сердца. Успешное лечение требует эффективной совместной работы педиатров и кардиологов. Частота посещения доктора и приём лекарств зависят от тяжести заболевания. Поскольку дети, перенёсшие болезнь Кавасаки, имеют высокий риск развития осложнений со стороны сердечно-сосудистой системы, им может потребоваться наблюдение в течение жизни.
Болезнь Кавасаки
Болезнь Кавасаки — редкое иммунокомплексное воспалительное поражение артерий различного калибра, возникающее преимущественно у детей первых лет жизни. Болезнь Кавасаки проявляется лихорадкой, полиморфной диффузной сыпью, конъюнктивитом, поражением слизистой рта, кожи и суставов дистальных отделов конечностей, шейной аденопатией. Диагностика болезни Кавасаки основана на клинических критериях, результатах лабораторных исследований крови и мочи, данных ЭКГ, УЗИ сердца и коронарографии. Основу лечения болезни Кавасаки составляет внутривенное введение иммуноглобулина и прием ацетилсалициловой кислоты, по показаниям применяются антикоагулянты.
Общие сведения
Болезнь Кавасаки получила свое название благодаря открывшему ее в 1961 году японскому педиатру по фамилии Кавасаки. Первоначально предполагалось, что заболевание имеет легкое течение. Лишь в 1965 году был выявлен случай тяжелой сердечной патологии, связанный с перенесенной болезнью Кавасаки. В России первый клинический случай болезни Кавасаки был диагностирован в 1980 году.
Сегодня болезнь Кавасаки является одной из самых распространенных причин приобретенной патологии сердца в детском возрасте. Наиболее часто заболевание встречается среди представителей желтой расы, особенно японцев. В Японии болезнь Кавасаки диагностируется в 30 раз чаще, чем в Австралии или Великобритании и в 10 раз чаще, чем в Америке.
Причины возникновения болезни Кавасаки
В настоящее время ревматология не имеет однозначных данных о причинах развития болезни Кавасаки. Наиболее признанной теорией является предположение о том, что болезнь Кавасаки развивается на фоне наследственной предрасположенности под влиянием инфекционных агентов бактериальной (стрептококк, стафилококк, риккетсии) или вирусной (вирус Эпштейна-Барра, простого герпеса, парвовирусы, ретровирусы) природы. В пользу наследственно обусловленной предрасположенности к болезни Кавасаки свидетельствует связь заболевания с расовой принадлежностью, его распространение в других странах преимущественно среди японских эмигрантов, развитие заболевания у 8-9% потомков переболевших лиц.
Симптомы болезни Кавасаки
Как правило, болезнь Кавасаки возникает в первые 5 лет жизни, отдельные случаи заболевания отмечались у детей до 8-ми лет. Пик заболеваемости болезнью Кавасаки приходится по одним данным на возраст 9-11 мес., по другим — 1,5-2 года. В течении болезни Кавасаки выделяют три периода: острый — 7-10 дней, подострый — 14-21 день и период выздоровления, который может занимать от нескольких месяцев до 1-2 лет.
Болезнь Кавасаки начинается с подъема температуры тела. Без лечения лихорадка сохраняется в течение 2-х недель. Увеличение лихорадочного периода считается прогностически неблагоприятным симптомом.
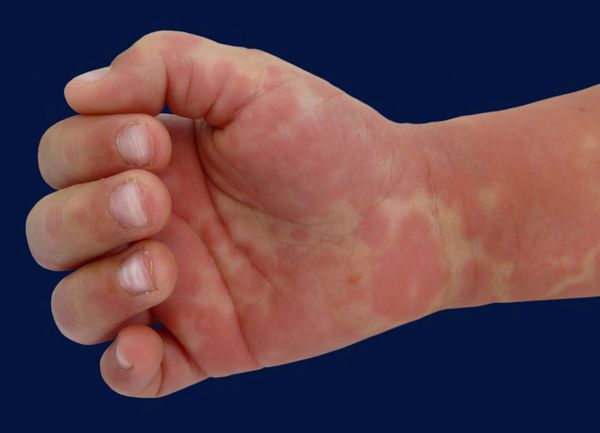
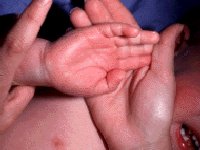
Кожные проявления болезни Кавасаки могут возникнуть в течение 5 недель от начала заболевания. Они характеризуются полиморфными диффузными элементами в виде мелких плоских пятен красного цвета (макулярная сыпь), волдырей, скарлатиноподобных или похожих на корь высыпаний. Элементы сыпи располагаются в основном на коже туловища, паховой области и проксимальных отделов конечностей. Со временем возникают эритематозные участки, отмечается болезненное уплотнение кожи ладоней и подошв, обуславливающее ограничение движений в пальцах. Разрешение элементов сыпи при болезни Кавасаки начинается примерно через неделю после их появления. Эритематозные пятна сохраняются 2-3 недели, после чего их поверхность начинает шелушиться.
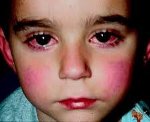
Поражения слизистых оболочек глаз и ротовой полости. У большинства заболевших болезнью Кавасаки в течение первых 7 дней отмечается появление конъюнктивита обоих глаз, обычно не сопровождающегося выделениями. В некоторых случаях ему сопутствует передний увеит. Наблюдается также сухость и покраснение слизистой оболочки ротовой полости, кровоточащие трещины на губах, малиновая окраска языка и увеличение миндалин. Болезнь Кавасаки в 50% случаев сопровождается увеличением шейных групп лимфатических узлов, чаще односторонним.
Поражение сердца и сосудов при болезни Кавасаки может носить характер миокардита, проявляющегося тахикардией, болями в сердце, аритмией и часто приводящего к острой сердечной недостаточности. У 25% пациентов с болезнью Кавасаки через 5-7 недель от начала заболевания выявляются аневризматические расширения коронарных сосудов сердца, которые могут приводить к развитию инфаркта миокарда. В редких случаях появляется перикардит, аортальная или митральная недостаточность. Возможно возникновение аневризм по ходу крупных артерий: локтевых, подключичных, бедренных.
Суставной синдром наблюдается в 35% случаев болезни Кавасаки и длится обычно до 1 месяца. Типичны артралгии и артриты голеностопных и коленных суставов, поражения мелких суставов кистей и стоп.
Возможно поражение органов ЖКТ с возникновением болей в животе, рвоты, поноса. В отдельных случаях наблюдается менингит, уретрит.
Диагностика болезни Кавасаки
Общепринятыми клиническими диагностическими критериями болезни Кавасаки является наличие на фоне продолжающейся более 5 дней лихорадки как минимум 4 из ниже приведенных признаков.
При выявлении аневризмы коронарных артерий достаточным считается наличие 3 из указанных диагностических признаков.
Лабораторная диагностика не дает специфических признаков болезни Кавасаки, однако совокупность выявленных изменений может стать дополнительным подтверждением правильности диагноза. В клиническом анализе крови определяется анемия, лейкоцитоз со сдвигом лейкоцитарной формулы влево, тромбоцитоз, значительное ускорение СОЭ. Биохимический анализ крови выявляет повышение иммуноглобулинов, серомукоида и трансаминаз, появление ЦИК. В анализе мочи может наблюдаться протеинурия и лейкоцитурия.
С целью диагностики сердечной патологии проводится ЭКГ, рентгенография органов грудной клетки, УЗИ сердца, ангиография коронарных артерий. По показаниям проводят люмбальную пункцию и исследование ликвора.
Лечение болезни Кавасаки
Иммуноглобулин. Для купирования происходящих в сосудах воспалительных изменений производится внутривенное введение иммуноглобулина. Оно осуществляется в стационарных условиях в течение 8-12 часов. Если после введения иммуноглобулина не отмечается снижение температуры и уменьшение воспалительных явлений, показано его повторное введение. Наилучшие результаты лечения иммуноглобулином получены при его проведении в первые 10 дней развития болезни Кавасаки.
Ацетилсалициловая кислота. В современной медицине этот препарат назначается только при наличие строгих показаний. Однако в лечении болезни Кавасаки он входит в перечень необходимых медикаментов. Цель его применения — снижение риска образования тромбов и противовоспалительная терапия. После снижения температуры тела дозу ацетилсалициловой кислоты понижают до профилактической.
Антикоагулянты (варфарин, клопидогрел) назначаются для профилактики тромбообразования детям с диагностированными аневризмами сосудов. Кортикостероидная терапия при болезни Кавасаки не проводится, так как исследования показали, что она повышает риск коронарного тромбоза.
Прогноз болезни Кавасаки
Болезнь Кавасаки в большинстве случаев имеет благоприятный прогноз, особенно при своевременно начатой терапии. Однако существует риск летального исхода заболевания (0,8-3%) в связи с тромбозом коронарных артерий и развитием инфаркта миокарда. Более редкой причиной смерти является тяжелый миокардит с выраженной сердечной недостаточностью.
Примерно в 20% случаев у перенесших болезнь Кавасаки детей сохраняются изменения стенок коронарных артерий, которые в отдаленном будущем могут привести к раннему появлению атеросклероза или кальциноза с последующей ишемией сердца, угрожающей развитием острого инфаркта миокарда. Факторами риска, ускоряющими развитие изменений со стороны коронарных артерий, являются артериальная гипертензия, гиперлипидемия, курение. В связи с этим пациенты с болезнью Кавасаки после выздоровления должны находиться под постоянным наблюдением кардиолога или ревматолога, раз в 3-5 лет проходить полное обследование сердца, включая ЭХО-ЭГ.
Слизисто-кожный лимфонодулярный синдром [Кавасаки] (синдром/болезнь Кавасаки) у детей
Общая информация
Краткое описание
Союз педиатров России
Слизисто-кожный лимфонодулярный синдром [Кавасаки] (синдром/болезнь Кавасаки) у детей
МКБ 10: М30.3
Год утверждения (частота пересмотра): 2016 (пересмотр каждые 3 года)
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
• Болезнь Кавасаки, неполная форма от 05.2013 года. Окклюзия правой коронарной артерии. ХСН I, ФК I по NYHA.
• Гипокомплементемический уртикарный васкулит
Этиология и патогенез
Этиология синдрома Кавасаки до настоящего времени окончательно не установлена. Авторы большинства многочисленных эпидемиологических и иммунологических исследований склоняются к тому, что наиболее вероятным причинным фактором может служить инфекционный агент (предположительно вирус) [1]. Кроме того, немаловажными факторами в развитии синдрома Кавасаки могут быть аутоиммунные механизмы и генетическая предрасположенность [2,3,4]. На сегодняшний момент имеются данные о 6 генетических локусах, связанных с этим заболеванием [5].
Эпидемиология
Клиническая картина
Cимптомы, течение
Наиболее характерные проявления синдрома Кавасаки представлены в табл. 1.
Необычно начало СК с картины заглоточного абсцесса (лихорадка, болезненность при поворотах головы, тризм) с гипоэхогенным (нативная КТ плотность 20-30 ед) линзообразным, не накапливающим контраст скоплением в заглоточной области на КТ. Отсутствие гноя при вскрытии припухлости на задней стенке глотки и сохранение температуры несмотря на антибактериальную терапию, легкий склерит и эффект от введения 2 г/кг ВВИГ, а также шелушение кожи ладонной поверхности пальцев позволяют подтвердить диагноз СК [22].
Мультисистемный воспалительный синдром у детей
Мультисистемный воспалительный синдром у детей – это ассоциированный с COVID-19 симптомокомплекс, встречающийся у детей и подростков, включающий признаки болезни Кавасаки и токсического шока. Клиническая картина представлена лихорадкой, нарушениями функции ЖКТ, менингеальными симптомами, кожной сыпью, конъюнктивитом, гипотонией, миокардитом. Лабораторная диагностика требует подтверждения инфицирования SARS-CoV-2, оценки маркеров воспаления, системы гемостаза; инструментальная – проведения ЭхоКС, КТ грудной клетки, УЗИ. В лечении используются оксигенотерапия, ГКС, антикоагулянты, иммуноглобулины, антибиотики.
МКБ-10
Общие сведения
Общая доля детей в структуре заболеваемости COVID-19 составляет 1-1,7%. 90% из них переносит новую коронавирусную инфекцию бессимптомно, в легкой или среднетяжелой форме. Вместе с тем, у отдельных пациентов младше 18 лет на фоне ковид-инфекции развивается выраженная гипервоспалительная реакция и полиорганные нарушения. Этот феномен получил название «детского мультисистемного воспалительного синдрома» (ДМВС, МВС у детей). Всего описано свыше 600 случаев ДМВС. Большинство наблюдений зафиксировано в Великобритании, Франции и США.
Причины
Этиологически заболевание связано с перенесенной инфекцией COVID-19. Предполагается, что мультисистемный воспалительный синдром является постинфекционным осложнением, а не проявлением острой коронавирусной болезни. Как правило, ДМВС развивается через 1-6 недель после острой фазы. К этому времени у 2/3 детей ПЦР-тесты на SARS-CoV-2 становятся отрицательными, но при этом обнаруживаются антитела к коронавирусу.
Факторы риска
Условия, на фоне которых детский мультисистемный синдром воспаления развивается чаще, включают:
Патогенез
Патофизиология мультисистемного воспалительного синдрома во многом остается неясной. По всей видимости, в его основе лежит вирус-индуцированная гипериммунная реакция. ДМВС рассматривается как аналог цитокинового шторма у взрослых. В его патогенезе прослеживаются механизмы, присущие синдрому Кавасаки, синдрому активации макрофагов и синдрому высвобождения цитокинов.
Важнейшую роль в патогенезе играет активация Т-лимфоцитов, гиперпродукция провоспалительных цитокинов (ФНО-α, интерлейкинов 1, 2, 6, 8, 10, ГМ-КСФ), отложение иммунных комплексов в сосудистой стенке. Эти механизмы обусловливают развитие мультисистемного воспалительного ответа и объясняют большинство клинико-лабораторных признаков синдрома: лихорадку, гиперферритинемию, коагулопатию, повышение маркеров воспаления.
Патологоанатомическая картина ДМВС характеризуется развитием иммунного некротизирующего васкулита, гиперкоагуляционного синдрома с гемофагоцитозом, поражением ЦНС, ССС, ЖКТ, кожи и слизистых.
Симптомы
Развитию мультисистемного воспалительного синдрома у детей предшествует ОРВИ или подтвержденный COVID-19. Главным клиническим симптомом является фебрильная лихорадка (присутствует у 100% заболевших), которая не купируется в течение 1-2 недель или возобновляется после кажущегося выздоровления. Типичен абдоминальный болевой синдром, сопровождающийся диареей или рвотой. Об этом сообщают от 60 до 97% пациентов. Клиническая картина имитирует вирусный гастроэнтерит, а в некоторых случаях ‒ острый аппендицит.
Другими патогномоничными признаками служат полиморфная (макулезная, макулопапулезная) сыпь (50-76%). У 30 до 50% детей с мультисистемным воспалительным синдромом отмечаются признаки угнетения ЦНС: вялость, цефалгия, судороги, спутанное сознание. Могут возникать загрудинные боли, артериальная гипотензия, вазодилататорный шок. Респираторные нарушения – одышка, тахипноэ – наблюдаются у 20-65% детей.
Часто развивается двусторонний конъюнктивит, склерит, хейлит, лимфаденопатия. Менее распространенными проявлениями выступают отечность кистей и стоп, боль в горле.
Осложнения
Почти у половины больных с мультисистемным воспалительным синдромом развивается дыхательная недостаточность, в т.ч. респираторный дистресс-синдром, требующие кислородной поддержки. Тревожным признаком служит нарастание цианоза, одышки, втяжение межреберных промежутков. Кардиоваскулярные осложнения включают коронарит, перикардит, миокардит, вальвулит. В отдельных случаях МВС сопровождается аритмией, СН, острым коронарным синдромом. Опасным отдаленным осложнением служат аневризмы коронарных артерий.
Поражение ЦНС может отягощаться цереброваскулитом, инсультом. Иногда выявляются выпоты в серозных полостях: перикардиты, плевриты, асциты. Имеются сообщения о развитии острой почечной и печеночной недостаточности. При неконтролируемом развитии событий гибель детей происходит по причине сепсиса, шока, полиорганной недостаточности.
Диагностика
Диагностика ДМВС складывается из клинических критериев, дополненных данными лабораторных и инструментальных методов. Обследование проводится стационарно с привлечением детских неврологов, кардиологов, пульмонологов, реаниматологов. На наличие мультисистемного воспалительного синдрома указывает:
Для дальнейшей оценки функции органов проводятся:
Дифференциальная диагностика
Детский МВС по своим клиническим проявлениям сходен с другими воспалительными и инфекционными процессами. В рамках лабораторно-инструментального обследования дифдиагностика проводится со следующими состояниями:
Лечение мультисистемного воспалительного синдрома
Терапия МВС проводится в отделении детском ОРИТ. Решение по тактике ведения таких пациентов принимается коллегиально с обязательным участием врача-ревматолога. Основные принципы терапии мультисистемного воспалительного синдрома изложены в «Методических рекомендациях по лечению COVID-19 у детей» от 03.07.2020 г. Они включают:
Прогноз и профилактика
Мультисистемный воспалительный синдром, ассоциированный с SARS-CoV-2, следует рассматривать как тяжелое проявление или осложнение COVID-19 у детей. Он требует проведения интенсивной терапии, может сопровождаться тяжелыми и смертельно опасными ближайшими и отдаленными последствиями. Летальность составляет 0,5-1%. Профилактике МВС способствует катамнестическое наблюдение детей, больных и контактных по COVID-19. Особенного внимания и более тщательного обследования заслуживают пациенты, входящие в группы риска. Вопрос о назначении профилактической антикоагулянтной терапии детям с COVID-19 остается дискутабельным.