Болезнь хантера что это у детей
Синдром Хантера
Общие сведения
Причины синдрома Хантера
Развитие синдрома Хантера связано с мутацией гена идуронатсульфатазы (IDS), кодирующего лизосомный фермент идуронат-2-сульфатазу. Ген IDS картирован в локусе Xq28 на длинном плече Х-хромосомы; в настоящее время известно более 150 различных его мутаций (точечные мутации, мелкие и крупные делеции, вставки, перестройки и пр.).
В силу сцепленности наследования с Х-хромосомой, синдромом Хантера, как правило, страдают исключительно мальчики (XY). Гетерозиготные женщины в подавляющем большинстве случаев являются носителями мукополисахаридоза II типа без клинических проявлений, однако описаны несколько случаев синдрома Хантера у девочек, связанных с новой мутацией или инактивацией второй, нормальной Х-хромосомы.
Классификация синдрома Хантера
Степень выраженности клинических проявлений синдрома Хантера (среднетяжелая, тяжелая) зависит от типа мутации в гене IDS. Так, крупные делеции и сложные перестройки, как правило, обусловливают развитие тяжелых форм синдрома Хантера. Для тяжелой степени (мукополисахаридоза типа IIА) характерно ранее развитие клинических симптомов (преимущественно в возрасте 18-36 месяцев), быстро прогрессирующее течение, выраженная умственная отсталость, полиорганное поражение. Пациенты с тяжелой формой синдрома Хантера погибают на втором десятилетии жизни.
Среднетяжелая форма (мукополисахаридоз типа IIВ) составляет примерно 1/3 всех случаев патологии. Клинические проявления синдрома Хантера обычно возникают у детей в 3-8 (иногда 10-13) лет; интеллект обычно сохранен; продолжительность жизни при благоприятных условиях может достигать 50-60 лет. Пациенты с легкой формой синдрома Хантера могут успешно реализовать себя в профессиональной сфере и иметь здоровое потомство.
Симптомы синдрома Хантера
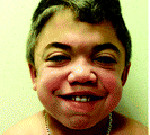
На момент рождения дети с синдромом Хантера выглядят клинически здоровыми. Основная симптоматика развивается в среднем в 2-4 года. До этого возраста проявления заболевания неспецифичны: у детей могут отмечаться повторные риниты, шумное дыхание, пупочные и паховые грыжи, гидроцеле.
Ранним характерным признаком синдрома Хантера служит постепенное изменение внешности ребенка: черты лица становятся грубыми (гаргоилизм); язык, губы и ноздри – большими; кожа – толстой. Облик больного с синдромом Хантера дополняется низкорослостью, увеличением размеров головы (макроцефалией), короткой шеей, аномалиями зубных рядов (редкими зубами). Дети с синдромом Хантера внешне очень похожи друг на друга и напоминают братьев.
Другие ранние признаки мукополисахаридоза II типа включают хриплый низкий голос, увеличение живота, гепатоспленомегалию. Дети с синдромом Хантера склонны к частой заболеваемости ОРВИ, отитами, ларингитом, трахеитом, пневмониями; нередко у них отмечается обструктивное апноэ сна, хроническая диарея. Следствием отложения гликозаминогликанов и липидов в дерме служит возникновение узелково-папулезных высыпаний на коже плеч, бедер, лопаток. Возможно появление «монгольских пятен» в пояснично-крестцовой области, гипертрихоза.
Уже в дошкольном возрасте у детей с синдромом Хантера появляются признаки поражения опорно-двигательного аппарата, выражающиеся в тугоподвижности суставов, развитии кифосколиоза, деформации кистей по типу «когтистой лапы». Движения становятся затруднительными, походка неуклюжей; к юношескому возрасту больные с синдромом Хантера нередко делаются беспомощными инвалидами, прикованными к постели.
Неврологические нарушения, возникающие при синдроме Хантера, включают синдром гипервозбудимости, судороги, сообщающуюся гидроцефалию, спастическую параплегию, задержку речевого развития, прогрессирующую тугоухость. Со стороны зрительной системы обнаруживается помутнение роговицы, атипичный пигментный ретинит. К наиболее поздним признакам мукополисахаридоза II типа относятся кардиологические нарушения: появление шумов в сердце, приобретенные пороки сердца (чаще митральная недостаточность), кардиомиопатия и др.
У ребенка могут наблюдаться изменения психики: обидчивость, агрессивность. В зависимости от типа синдрома Хантера интеллектуальный дефект может быть небольшим или значительно выраженным. Летальный исход у больных с синдромом Хантера обычно наступает от прогрессирующей сердечной или легочной недостаточности.
Диагностика синдрома Хантера
В практике педиатра синдром Хантера встречается исключительно редко. Тем не менее, мукополисахаридоз II типа может быть заподозрен на основании клинических признаков (внешних изменений, манифестации заболевания на 2-4 году жизни, прогредиентного течения и др.). Для подтверждения диагноза дети нуждаются в консультации генетика, анализе клинико-генеалогических данных, проведении молекулярно-генетических исследований.
Важным биохимическим маркером синдрома Хантера служит повышение экскреции мукополисахаридов (дерматансульфата, гепарансульфата) с мочой, дефицит фермента идуронат-2-сульфатазы. Рентгенологические исследования костей черепа, суставов, трубчатых костей, позвоночника демонстрируют дизостоз, остеоартрит, множественные изменения позвонков.
В семьях с известным генотипом и высоким риском рождения ребенка с синдромом Хантера может проводиться инвазивная пренатальная диагностика – биопсия ворсин хориона, амниоцентез или кордоцентез с определением активности идуронат-2-сульфатазы в полученном материале.
Дифференциальную диагностику синдрома Хантера следует проводить с другими формами мукополисахаридозов (прежде всего, синдромом Гурлера), а также с другими лизосомными болезнями накопления.
Лечение синдрома Хантера
Детям с синдрома Хантера необходимо пожизненное проведение ферментозаместительной терапии. На сегодняшний день единственным препаратом, зарегистрированным в США, Европе и России для лечения больных с синдромом Хантера, является идурсульфаза. Пациенты с мукополисахаридозом II типа должны получать идурсульфазу еженедельно путем внутривенного капельного введения в дозе 0,5 мг/кг массы тела.
Кроме патогенетического лечения, детям с синдромом Хантера проводятся регулярные медикаментозные курсы симптоматической и корригирующей терапии гепатопротекторами, витаминами, антиоксидантами, цитопротекторами. В комплексную терапию синдрома Хантера целесообразно включать ЛФК, физиотерапию (электрофорез лидазы на суставы, парафиновые аппликации, магнитотерапию, лазеропунктуру), занятия с дефектологом и логопедом.
Прогноз и профилактика синдрома Хантера
Синдром Хантера типа В имеет более благоприятное течение и прогноз; при своевременном и регулярном лечении продолжительность жизни больных может достигать 50-60 лет. При тяжелых формах мукополисахаридоза II типа пациенты обычно погибают до 20 лет от сердечно-сосудистой недостаточности. На сегодняшний день серьезную проблему для больных с синдромом Хантера представляет своевременное получение жизненно необходимого препарата идурсульфазы из-за его высокой стоимости.
Дети с синдромом Хантера нуждаются в наблюдении различных специалистов: детского генетика, педиатра, детского кардиолога, детского невролога, эпилептолога, детского офтальмолога, детского отоларинголога, детского хирурга, детского ортопеда.
Основным методом профилактики синдрома Хантера является медико-генетическое консультирование супружеских пар, имеющих вероятность рождения больного ребенка, а также проведение дородовой диагностики. Следует знать, что у больных с синдромом Хантера рождаются здоровые сыновья, а дочери выступают облигантыми носителями мутантного гена.
МУКОПОЛИСАХАРИДОЗ II ТИПА (синдром Хантера): Новые возможности терапии.

Накопление гликозаминогликанов в лизосомах вызывает тяжелые нарушения функций клеток, органов и систем, определяя широкий диапазон клинических проявлений. Клиническая гетерогенность вызвана, в том числе, и многообразием происходящих мутаций патологического гена.
Обычно фенотипический «манифест» наступает в 2-4 года, до этого периода никаких признаков болезни не прослеживается. Первые признаки заболевания проявляются в виде дисморфических черт лица (утолщение губ, ноздрей, широкая переносица, увеличение лобных бугров, густые брови). Затем появляется макроглоссия, аномалии зубов, макроцефалия, скафоцефалия, изменения скелета, короткая шея, низкий рост, толстая кожа с узелками, папулами, гирсутизмом, паховые, пупочные грыжи, тугоподвижность и деформации мелких и средних суставов, увеличенный живот за счёт спленомегалии. Изменения со стороны центральной и периферической нервной систем включают задержку психоречевого развития, нарушение поведения (упрямство, агрессию, гиперактивность), нарушение сна, псевдобульбарный синдром, симптоматическую эпилепсию, спастический тетрапарез, атрофическую гидроцефалию, нейросенсорную тугоухость, поражение зрительных нервов. Со стороны сердечно-сосудистой системы отмечаются аритмии, лёгочная гипертензия, гипертрофическая или рестриктивная кардиомиопатии, поражения клапанного аппарата сердца, вторичная застойная сердечная недостаточность. С раннего возраста отмечается увеличение глоточных и небных миндалин, хроническая ринорея, обструкции верхних дыхательных путей, трахеобронхомаляции, происходит утолщение голосовых связок с изменением тембра голоса. Возможны жизнеугрожающие апноэ. Ребенок часто болеет респираторными инфекциями, отитами, пневмониями.
Поражения глаз представлены атипичным пигментным ретинитом, разрушением сетчатки, атрофией зрительного нерва. Прогрессирующая потеря слуха обуславливает поведенческие нарушения, трудности в обучении. С возрастом эти изменения становятся более выраженными. Молекулярной основой дефекта соединительной ткани является нарушенный обмен гликозамингликанов.
Диагностика СХ основана на совокупности клинических, инструментальных и лабораторных данных. Постановка диагноза СХ базируется на определении активности идуронат-2-сульфотазы в лейкоцитах крови, сыворотке крови, культуре фибробластов кожи, уровня гликозаминогликанов в моче, ДНК-тестировании. Пренатальная диагностика основана на измерении активности фермента I2S в амниотической жидкости, амниоцитах, тканях, ворсинках хориона.
Реальные возможности помощи детям с СХ в нашей стране появились с момента регистрации в РФ в 2008 году рекомбинантной человеческой идуронат-2-сульфатазы, препарата «элапраза» (Idursulfatase), Shire (США), основного патогенетического лекарственного средства в лечении такой категории пациентов. Необходимы еженедельные инфузии препарата в дозе 0,5 мг/кг.
Поскольку в прогрессирующий патологический процесс вовлекаются все органы и системы оказание медицинской помощи пациентам с МПС должно строится с позиций междисциплинарного, комплексного подхода.
Однако, на сегодняшний день, организацию медицинской помощи детям с МПС в целом в РФ нельзя оценивать положительно. Отсутствие опыта и знаний у врачей по данному разделу патологии, стандартов лечения данной болезни диктуют необходимость организации системы мероприятий по информированию «узкопрофильных» специалистов и педиатров общей практики об особенностях дебюта и течения МПС.
Проблемы большинства пациентов с редкими заболеваниями схожи – это поздние сроки диагностики, а следовательно — и начала лечения, трудности в получении дорогостоящих лекарственных препаратов, стоимость которых в год составляет около 400 тысяч евро для одного пациента, В РФ средний возраст начала единственно необходимой ферментозаместительной терапии среди детей с МПС – 6,8 года, когда патологические изменения приобретают уже необратимый характер.
Требуют решения вопросы социальной, юридической, паллиативной помощи, в чём не просто нуждаются, а остро нуждаются эти пациенты и семьи, в которых они воспитываются.
Прогноз: При быстром прогрессировании болезни с вовлечением ЦНС больные обычно погибают в возрасте 10-15 лет, при «мягких» формах МПС 11 типа – продолжительность жизни может составить 50 лет и более при соответствующем лечении [3].
Приводим собственное клиническое наблюдение мальчика П. с синдромом Хантера.
Ребенок родился у молодых здоровых родителей, от 1-ой беременности, протекавшей на фоне анемии легкой степени, гестоза отечной формы. Роды первые, срочные. Масса тела при рождении 3430,0, длина 52 см, окружность груди 34 см. Оценка по шкале Апгар 8/9 баллов, ранняя неонатальная желтуха. Темпы физического и психомоторного развития на первом году жизни соответствовали эпикризным срокам. Профилактические прививки осуществлялись в соответствии с национальным календарём прививок, осложнений не отмечалось. В раннем возрасте переносил частые респираторные инфекции, бронхиты, пневмонию. В 3-х летнем возрасте диагностированы аденоиды III степени. С 3,5 лет появилась тугоподвижность и ограничение объёма движений в суставах, тугоухость, задержка роста, с 5 лет – лицевые дисморфии и другие фенотипические особенности: широкая переносица, толстые губы, редкие зубы, короткие и толстые пальцы, короткая шея, шумное дыхание, увеличение живота за счет гепатоспленомегалии.
В 5 лет выполнена аденотомия, в 5,5 лет — оперативное вмешательство по поводу паховой и пупочной грыжи. При ультразвуковом исследовании выявлена единственная, правая почка.
В 6 лет 4 месяца госпитализирован в кардиоревматологическое отделение ДОКБ г. Орла с жалобами на боли и скованность в лучезапястных, коленных, голеностопных, межфаланговых суставах. По результатам клинико-лабораторно-инструментальных исследований, консультаций специалистов выставлен диагноз: Вторичная артропатия. Двухстворчатый аортальный клапан с недостаточностью 2-3 степени.
Нейросенсорная тугоухость. гиперметропический астигматизм. Мукополисахаридоз VI тип?
При дообследовани в медико-генетическом центре г. Москвы, выявлена повышенная экскреция дерматансульфата и гепарансульфата с мочой, значительное снижение идуронатсульфатазы в плазме, до 3,18 nmol/4h/ml (норма 297-705), что позволило уточнить тип мукополисахаридоза –II тип (синдром Хантера).
В 6 лет 11 месяцев – лечение в психоневротическом отделении НЦЗД г. Москвы с клиническим диагнозом: Мукополисахаридоз II типа (синдром Хантера). Вторичная кардиомиопатия. Темповая задержка психо-речевого развития. Рецидивирующий бронхит. Контрактуры крупных и мелких суставов конечностей 1-2 степени. Гиперметропический астигматизм. Единственная правая почка. Нейросенсорная тугоухость 2 степени.
С сентября 2011 года в возрасте 7 лет 11 месяцев в условиях педиатрического отделения ДОКБ г. Орла ребёнку проводится ферментозаместительная терапии – еженедельные инфузии препаратом «Элапраза» » (Idursulfatase), Shire (США). Пропусков введений не было. Осложнений не отмечалось. На 01.06.2012 года мальчик вырос на 4см (рост 125см), 1,5 кг прибавил в весе (масса 28,5кг), улучшилась переносимость физических нагрузок, сократились размеры печени, селезёнки, увеличился объем движений в суставах.
Таким образом, представленный клинический случай имеет большой практический интерес для врачей-педиатров, генетиков и других специалистов в связи с редкостью данного наследственного заболевания. Заслуживает внимания появление новых возможностей в терапии таких пациентов, а именно, внедрение единственно эффективного патогенетического средства идуронат-2-сульфатазы (элапраза), открывающего новые реалии в прогнозе данного заболевания.
Своевременная диагностика мукополисахаридозов, правильное ведение данного контингента больных, раннее назначение ферментозаместительной терапии, будут способствовать уменьшению тяжести заболевания, снижению инвалидизации детей, более адекватной интеграции их в общество.
Мукополисахаридоз II типа у детей
Общая информация
Краткое описание
Союз педиатров России
Клинические рекомендации: Мукополисахаридоз II типа у детей
Год утверждения (частота пересмотра): 2016 (пересмотр каждые 3 года)
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Этиология и патогенез
Эпидемиология
Клиническая картина
Cимптомы, течение
Диагностика
Диагноз МПС II устанавливается на основании совокупности клинических данных, результатов лабораторного исследования и молекулярно-генетического анализа 1.
— нарушения со стороны желудочно-кишечного тракта
Основные физикальные проявления в зависимости от возраста дебюта МПСII может варьировать (Приложение Г1).
• Рекомендован контроль общего клинического анализа крови, мочи.
• Рекомендовано проведение компьютерной томографии (КТ) головного мозга.
Лечение
Комментарии: целесообразность обусловлена частыми респираторными инфекциями.
Медицинская реабилитация
Проводится в комплексе реабилитационных мероприятий. Коррекционно-педагогическое воздействие определяется в зависимости от тяжести и длительности течения болезни, структуры нарушений здоровья, степени недоразвития познавательной деятельности, типа эмоционального реагирования, особенностей поведения ребенка. Включение коррекционно-педагогического сопровождения в комплекс восстановительных мероприятий обеспечивает дополнительную оценку динамики психического развития как одного из важных показателей состояния здоровья, повышает эффективность терапевтических вмешательств, снижает экономическое бремя данной патологии за счет социализации пациентов и сохранения психологического потенциала трудоспособных членов семьи.
Прогноз
Продолжительность жизни составляет примерно от 10 до 15 лет. Как правило, причиной смерти являются сердечные и респираторные осложнения. При этом у ряда пациентов описаны случаи более продолжительной жизни: до 50-60 лет.
| Вид медицинской помощи | Специализированная медицинская помощь |
| Условия оказания медицинской помощи | Стационарно / в дневном стационаре |
| Форма оказания медицинской помощи | Плановая |
Профилактика
Мукополисахаридоз: орфанное заболевание в практике педиатра
Т. А. Бокова, д. м. н., профессор кафедры педиатрии факультета усовершенствования врачей Московского областного научно-исследовательского клинического института имени М. Ф. Владимирского.
Ключевые слова: орфанные заболевания, лизосомные болезни накопления, мукополисахаридоз, дети.
Редкие (орфанные) заболевания – это встречающиеся с определенной частотой жизнеугрожающие или хронические прогрессирующие заболевания, приводящие без лечения к смерти или пожизненной инвалидизации пациентов. Сегодня в мире насчитывается около 7 тыс. редких заболеваний. Примерно половина из них обусловлена генетическими отклонениями. Симптомы могут быть очевидны с рождения или проявляться в детском и более старшем возрасте.
В разных странах определение и перечень орфанных болезней принимаются на государственном уровне, единого определения для них не существует, так же как нет единого критерия отнесения заболеваний к этой группе.
В нашей стране к орфанным относятся заболевания, которые имеют распространенность не более 10 случаев заболевания на 100000 населения. С 1 января 2012 года в силу вступил новый Федеральный закон от 21.11.2011 №323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», в котором впервые на государственном уровне введено понятие редких (орфанных) заболеваний. В список орфанных болезней внесено 230 наименований. Постановление Правительства РФ от 26 апреля 2012 г. № 403 определило перечень из 24 из них, согласно которому пациенты должны быть обеспечены за сч ет государства необходимыми лекарственными препаратами и лечебным питанием. Одним из заболеваний, включ енным в группу орфанных, является мукополисаха-ридоз (код по МКБ-10 Е76.1 – «нарушение обмена гликозаминогликанов»).
Мукополисахаридозы (МПС) – это группа наследственных болезней соединительной ткани, обусловленных нарушением обмена гликозаминогликанов (ГАГ) (кислых мукопо-лисахаридов) в результате генетически обусловленной неполноценности 1 из 11 известных ферментов, участвующих в их расщеплении. МПС относится к лизосомным болезням накопления (табл. 1). Таблица 1. Типы мукополисахаридозов
Тип МПС
Название
Дефицит фермента
Синдром Гурлер (Hurler)
Синдром Шейе (Scheie)
Синдром Гурлер-Шейе (Hurler-Scheie)
Синдром Хантера (Hunter)
Синдром Санфилиппо (Sanfilippo)
ацетил-КоA альфа-глюкозаминидин ацетилтрансфераза
Синдром Моркио (Morquio)
Синдром Марото-Лами (Maroteaux-Lamy)
Синдром дефицита гиалуронидазы (Natowicz)
Подавляющее большинство МПС наследуются по аутосомно-рецессивному типу. Исключение составляет болезнь Хантера (МПС II типа), которая наследуется по X-сцепленному рецессивному механизму.
Для МПС характерно полисистемное поражение. Формируются множественные деформации скелета и задержка физического развития. При некоторых формах наблюдается умственная отсталость. Выявляются нарушения сердечной деятельности и функции бронхол егочной системы, патология органов зрения и слуха, образование грыж, неврологические расстройства, увеличение печени и селезенки [1–3].
Представляется клиническая и лабораторная характеристика заболевания на примере МПС II типа. На сегодняшний день в Московской области наблюдается 9 детей с МПС, из них 7 – с МПС II типа.
Мукополисахаридоз II типа (синонимы: недостаточность фермента лизосом-ной идуронат-2-сульфатазы (a-L-идуро-носульфатсульфатазы), синдром Гунтера (Хантера) – сцепленное с Х-хромосомой рецессивное заболевание, возникающее в результате снижения активности лизосомной идуронат-2-сульфатазы, участвующей в метаболизме ГАГ. Возникает почти исключительно у мальчиков (XY). У гетерозиготных женщин клинических проявлений синдрома Хантера, как правило, не наблюдается («носители»). К настоящему моменту описано лишь 2 случая заболевания у девочек, связанных с инактивацией второй, нормальной, Х-хромосомы [2].
Это панэтническое заболевание, частота встречаемости в мире – около 1 на 75 000 живых новорожд енных мальчиков. Частота заболевания в популяции варьирует от 1 на 165 000 (Австралия) до 1 на 34 000 (Израиль). Развитие МПС II типа обусловлено мутациями в структурном гене лизосомной идуронат-2-сульфатазы – IDS, расположенном на длинном плече Х-хромосомы в локусе Xq28. В настоящее время описано более трехсот различных мутаций в гене IDS. Более 50% мутаций составляют точечные мутации, около 26% – мелкие делеции и вставки, 11% – крупные де-леции и перестройки гена IDS. У пациентов из России ДНК-анализ гена IDS показал, что крупные делеции и перестройки гена IDS составляют только 5,4% числа найденных мутаций [2].
Клинический фенотип гетерогенен и довольно условно подразделяется на тяж елую и л егкую формы, различающиеся по тяжести клинических фенотипов. У пациентов с тяж елой формой наблюдают сходные с МПС I типа (синдромом Гурлер) клинические симптомы, но заболевание прогрессирует медленнее (рис. 1).
Рис. 1. У девочки (слева) диагноз МПС I типа (синдром Гурлер-Шейе). У мальчика (справа) диагноз МПС II типа (синдром Хантера).
(Фото из личного архива автора и Межрегиональной Благотворительной Общественной Организации «Хантер-синдром»)
Заболевание манифестирует в возрасте от 1 до 3 лет. Отмечается изменение черт лица по типу гарголоилизма, задержка роста, признаки множественного костного дизостоза, огрубление и утолщение кожи, прогрессирующее снижение интеллекта. Специфичными для данного типа МПС являются изменения на коже спины, груди, шеи цвета слоновой кости, «монголоидные пятна» в пояснично-крестцовой области. Нарушения функции органов пищеварения проявляются в виде гепатомегалии, хронической диареи. Среди неврологических нарушений преобладают симптомы прогрессирующей сообщающейся гидроцефалии, спастическая параплегия в результате компрессии спинного мозга и прогрессирующая тугоухость. У детей с синдромом Хантера отмечается тугоподвижность крупных и мелких суставов. Прогрессируют сердечно-легочные расстройства. Летальный исход обычно наступает на втором десятилетии жизни.
Для подтверждения МПС II типа проводится определение уровня экскреции ГАГ с мочой и измерение активности лизосомной идуронат-2-сульфатазы в лейкоцитах или культуре кожных фибробластов. В случае заболевания в моче возрастает суммарная экскреция ГАГ.
Проведение ДНК-анализа – длительная и сложная диагностическая процедура, позволяющая определить молекулярные дефекты, приводящие к болезни Хантера, наиболее часто используется для определения носительства и пренатальной диагностике в семьях, имеющих больного ребенка. Применяются методы косвенной ДНК-диагностики, основанной на исследовании локусов Х-хромосомы, расположенных близко к гену IDS. Кроме того, пренатальная диагностика проводится пут ем измерения активности идуронат-2-сульфатазы в биоптате ворсин хориона на 9-11-й неделе беременности или определения спектра ГАГ в амниотической жидкости на 20-22-й неделе беременности.
Наиболее часто дифференциальная диагностика проводится внутри группы МПС, а также с другими лизосомными болезнями накопления (муколипидозами, галактосиалидозом, ганглиозидозом и др.).
Основным подходом к лечению больных с МПС является проведение пожизненной ферментозаместительной терапии. При МПС II типа используется препарат идурсульфазы Элапраза («Шайер», США), зарегистрированный в странах Европы, США, России для лечения мукополисахаридоза II типа (болезнь Хантера). Препарат вводится пожизненно еженедельно, внутривенно, капельно, медленно в дозе 0,5 мг/кг.
В качестве клинического примера приводится выписка из истории болезни Никиты Б., 11.12. 2011 г.р.
Анамнез жизни. Ребенок от II беременности (I беременность окончилась выкидышем на раннем сроке), протекавшей на фоне маловодия, гипоксии плода, угрозы прерывания, отеков. Роды срочные, самостоятельные. Вес при рождении 4040 г, рост 58 см. С рождения на грудном вскармливании. Формула развития: голову держит с 2 мес., переворачивается с 5 мес., сидит с 9 мес., ходит с 1 г. 1 мес. К году – 5 слов. Перенесенные заболевания – ОРВИ 2 раза, трахеит.
Анамнез заболевания. С рождения – водянка оболочек яичек, с 5 мес. – пахово-мошоночная грыжа, в 7 мес. диагностирован кифоз поясничного отдела позвоночника, в 12 мес. по данным ЭКГ – синдром ранней реполяри-зации желудочков НБПНГ, в 1 г. 3 мес. проведена Эхо КГ, выявлена аневризма МПП. В 1 г. 4 мес. ребенок обследован в МГНЦ РАМН, заподозрен и подтвержден биохимическим и молекулярно-генетическим методами МПС II типа.
При поступлении в клинику МОНИКИ (2013 г.) состояние реб енка средней тяжести. Вес 15 кг. Рост 93 см. Волосы жесткие, тусклые, макростомия, макроглоссия, короткая шея, легкие черты гарголоидизма, камподактилия 4 и 5 пальцев справа, широкое пупочное кольцо, кифоз поясничного отдела позвоночника, ки-левидная деформация грудной клетки, пахо-во-мошоночная грыжа слева, кожа плотная на ощупь. Гипертрофия миндалин 2-3 ст. Дыхание через нос не затруднено. Дыхание везикулярное. Тоны сердца ритмичные, акцент второго тона. ЧСС 120 уд/мин. Живот увеличен в объеме, печень +3,5см, +4, см верхняя треть. Селезенка не пальпируется. Стул оформленный. Дизурических явлений нет.
Неврологический статус: в сознании, гиперактивен, быстро возбудим, говорит отдельные слова. Общемозговых, менингеальных знаков нет. ОГ=50 см. глазные щели OD=OS. Зрачки OD=OS. Движение глазных яблок в полном объеме. Низкий тембр голоса. Быстро истощается, ходит самостоятельно, легкая атаксия. Мышечная гипотония. Сухожильные рефлексы живые.
Общий анализ крови и мочи без патологических изменений.
Биохимический анализ крови – умеренное повышение уровня АЛТ (42 Ед/л), АСТ (49 Ед/л).
ЭКГ: вертикальное положение ЭОС, выраженная синусовая тахикардия 182-200 на фоне беспокойства. В ортостазе ЧСС 111-166 уд/мин.
УЗИ брюшной полости: печень увеличена, правая доля 100 мм, левая – 45 мм. Структура однородная, стенки сосудов и протоков уплотнены. Эхогенность повышена. Поджелудочная железа 14×8×15 мм, структура неоднородная, эхогенность не изменена. Желчный пузырь – форма обычная, просвет чистый, стенки не утолщены. Селезенка не увеличена 62×32 мм. Структура однородная. Почки без патологических изменений. Яички в мошонке, вагинальный отросток брюшины расширен с обеих сторон до 3 мм.
ЭЭГ: диффузные общемозговые изменения биоэлектрической активности по органическому типу в виде доминирования дельта-активности частотой 3-4 Гц по всем отделам конвекса безградиентно в сочетании с отдельными группами низкочастотных тета-колебаний. Эпилептиформная активность, фотопа-роксизмальная реакция не выявлены.
На основании комплексного исследования установлен диагноз: мукополисахаридоз II типа (синдром Хантера). Дегенеративное заболевание нервной системы. Задержка речевого развития. Синдром гипервозбудимости. Множественный костный дизостоз. Порок развития L1-L2 позвонков, врожденный кифоз. 2-х стороннее гидроцеле. Пупочная грыжа.
По жизненным показания ребенку назначено внутривенное введение «Элапразы» в дозе 0,5 мг/кг еженедельно (15 кг×0,5=7,5 мг на введение). В комплексную терапию включены занятия с логопедом, дефектологом, курсы физиотерапии, ЛФК, L-карнитин (Элькар), Кудесан, Глицин, Церебролизин, МагнеВ6. В настоящее время ферментнозаместительную терапию ребенок получает по месту жительства.
Список литературы:
1. Neufeld E. F., Muenzer J. The mucopolysaccharidoses. In: Scriver CR, Beaudet AL, Sly WS, et al (eds). The Metabolic and Molecular Bases of Inherited Disease. New York: McGraw-Hill; 2001: 3421-3452.