Болезнь аддисона бирмера что это
Болезнь Аддисона
Болезнь Аддисона (гипокортицизм, хроническая надпочечниковая недостаточность) — это редкое заболевание, характеризующееся недостаточной выработкой надпочечниками глюкокортикоидного гормона кортизола и минералокортикоидного гормона альдостерона.
Чаще всего гипокортизицм, которому подвержены как мужчины, так и женщины, возникает в 30-50 лет, однако дебют (первое клиническое проявление) заболевания может наблюдаться в любом возрасте.
Распространенность болезни Аддисона во всем мире составляет 40-60 пациентов с установленным диагнозом БА на 1 миллион человек.
Причины возникновения
Как правило, болезнь Аддисона возникает из-за повреждения или разрушения коры надпочечников в результате развития аутоиммунного процесса (иммунная система воспринимает кору надпочечников как чужеродную, атакует и разрушает ее) или другого аутоиммунного заболевания, имеющегося у пациента.
К другим причинам возникновения заболевания относятся:
Дефицит глюкокортикоидных и минералокортикоидных гормонов, вызванный снижением функции коры надпочечников, называют первичной надпочечниковой недостаточностью. Если надпочечники не способны продуцировать эти гормоны по другим причинам (например, из-за аномалий гипофиза или его дисфункции), речь идет о вторичной надпочечниковой недостаточности.
Симптомы
Болезнь Аддисона прогрессирует медленно, в течение нескольких месяцев. Симптомы могут варьироваться от человека к человеку. Первые клинические проявления часто неспецифичны, то есть сходны с симптомами других — распространенных — заболеваний.
Обычно на начальных стадиях заболевания пациент не ощущает никаких симптомов. К сожалению, дебют БА ассоциирован с 90% повреждения коры надпочечников.
К симптомам болезни Аддисона относятся:
Иногда болезнь Аддисона, не проявлявшая себя ранее, может возникнуть внезапно и остро — например, при отсутствии необходимого лечения или в результате воздействия стрессовых факторов (несчастный случай, травма, хирургическое вмешательство), инфекции, другого заболевания. В этом случае речь идет о жизнеугрожающем состоянии — т. н. аддисоническом кризе или острой надпочечниковой недостаточности. Характерные признаки: сильная слабость, спутанность сознания, боли в спине, ногах и животе, рвота и диарея, низкое артериальное давление, гиперкалиемия, гипонатриемия.
Диагностика
Диагноз устанавливается на основании анамнеза, жалоб и симптомов пациента, результатов лабораторной и инструментальной диагностики (КТ, МРТ).
Анализы крови направлены на определение уровня натрия, калия, кортизола и адренокортикотропного гормона (АКТГ), который стимулирует выработку гормонов корой надпочечников, а также на выявление специфических антител, ассоциированных с болезнью Аддисона.
Пациенту может быть назначена стимуляционная проба АКТГ, во время которой (для стимуляции выработки кортизола) вводится адренокортикотропный гормон. Если стимуляция не приводит к выработке нормального уровня кортизола, это указывает на повреждение надпочечников или нарушение их функции.
Также проводится инсулин-индуцированная гипогликемическая проба, которая помогает установить взаимосвязь характерных симптомов болезни Аддисона с аномалиями гипофиза или нарушениями его функции. Во время этого теста пациенту вводится быстродействующий инсулин, уровень сахара в крови замеряется до и после инъекции.
Для оценки функции надпочечников и их структурных особенностей дополнительно проводится визуализация с помощью КТ и МРТ. Эти исследования помогают уточнить характерные изменения, наблюдаемые при развитии болезни Аддисона.
Дифференциальный диагноз
Чаще всего болезнь Аддисона дифференцируют (различают) со следующими заболеваниями:
Лечение болезни Аддисона
Лечение болезни Аддисона основано на применении медикаментозной терапии, направленной на замещение глюкокортикоидного и минералокортикоидного гормонов. Рекомендуется пероральный прием гидрокортизона и флудрокортизона, дозировка препаратов подбирается индивидуально. Терапия проводится на протяжении всей жизни.
Некоторым пациентам может быть предложена андроген-заместительная терапия (тестостерон или андростендион). Больные, получающие такое лечение, сообщают о снижении проявлений усталости, улучшении настроения и психоэмоционального состояния в целом, повышении либидо (у женщин), однако эти подходы к лечению пока исследуются.
Лечение аддисонического криза включает внутривенное введение гидрокортизона, жидкостей, электролитов и препаратов, нормализующих артериальное давление.
Особенности и преимущества лечения болезни Аддисона в клинике Рассвет
Своевременная диагностика и эффективное лечение редких синдромов и болезней входят в область интересов всех врачей клиники Рассвет.
Наши эндокринологи — врачи высокой квалификации, прекрасно подготовлены и имеют большой практический опыт.
Пациентам с подозрением на болезнь Аддисона проводятся все необходимые диагностические исследования для подтверждения или исключения диагноза. При необходимости индивидуально подбирается адекватная схема терапии.
Рекомендации врача-эндокринолога клиники Рассвет пациентам с болезнью Аддисона
Помимо приема препаратов заместительной терапии, пациенту необходимо следить за тем, чтобы получать достаточное количество соли (натрия) из рациона, особенно во время физических нагрузок, при жаре или желудочно-кишечных расстройствах.
Дозировка принимаемых лекарств может быть временно увеличена, если пациент испытывает стресс, связанный с проведением операции, инфекционными и другими заболеваниями. Если из-за тошноты и рвоты пациент не может принимать необходимые препараты перорально, ему назначаются инъекции.
Пациентам с болезнью Аддисона важно знать, что прием стероидов в их случае не связан с серьезными побочными эффектами, поскольку осуществляется восполнение недостатка выработки гормонов. При правильном подборе дозировки лекарств побочные эффекты практически не наблюдаются.
Пациентам с болезнью Аддисона необходимо постоянно иметь при себе медицинский документ, свидетельствующий о наличии заболевания, для случаев оказания экстренной медицинской помощи.
Болезнь Аддисона нельзя предотвратить, но для нее существует эффективное лечение. При своевременной диагностике, правильном подборе терапии, соблюдении мер профилактики острой надпочечниковой недостаточности, ожидаемая продолжительность жизни у пациентов с этим заболеванием не снижается.
Болезнь аддисона бирмера что это
Болезнь Бирмера (Аддиссона-Бирмера) или «злокачественная анемия» наиболее частая и лучше изученная форма дефицита витамина В12.
История болезни начинается описанием Аддиссоном (1885) «генуинной» анемии у хорошо питающихся лиц; о желудочных дегенеративных поражениях высказывал предположение Флинт (1860), что, в дальнейшем было подтверждено Fenwick (1870) на секционном материале, в то время как бескислотность, доказанная Cohn и Mehring уже в 1886 г. лишь спустя несколько десятков лет была признана в качестве обязательного симптома болезни.
Бирмеру мы обязаны анатомоклиническим описанием «злокачественной анемии» (1868—1872), хотя большинство рассмотренных им случаев видимо в действительности, составляли виды анемии за счет недостатка фолиевой кислоты (Castle, 1970).
Описание мегалобласта Эрлихом в 1908 г. заложило основу морфологического диагноза, увенчавшегося в дальнейшем практикой костномозговых пункций.
Начало патофизиологического этапа отмечено успешным применением пероральной гепатотерапии (Minot и Murphy), после чего, постепенно, путем очистки печеночных экстрактов, удалось выделить витамин В12 и синтезировать его. В 1938 г. Castle доказал роль внутреннего фактора в патогенезе этого заболевания. На последующих этапах были достигнуты большие успехи в изучении метаболизма витамина В12 и его взаимосвязь с другими метаболическими процессами, к тому же был приведен ряд аргументов, в пользу высказывания об аутоиммунном патогенезе с описанием нескольких генетических болезней, касающихся ферментов, которые зависят от витамина В12.
На основе современных знаний болезнь Бирмера можно определить как болезненное состояние, характеризующееся изменениями мегалобластического вида клеток периферической крови и костного мозга и дегенеративными поражениями слизистых оболочек пищеварительного тракта и нервной системы в связи с недостаточным поглощением витамина В12 по причине отсутствия внутреннего фактора, что, видимо создается каким-то аутоиммунным механизмом на наследственном фоне.
Частота заболевания значительно колеблется в зависимости от географической области при этом болезнь чаще в странах, населенных «северными расами» (Голландия, Скандинавский полуостров, Англия, США, Канада), чем на востоке и юге Европы и совсем редко встречается на Дальнем Востоке и среди негроз (Gummert). Более высокий показатель частоты у женского пола (5:2) не подтвержден всеми авторами.
По возрастным группам наиболее высокий показатель приходится на группу 45—55 лет, однако процент заболевших растет неуклонно в последующих группах.
Экономические и трудовые (профессиональные) условия не оказывают существенного влияния на показатель частоты этого заболевания «эндогенного детерминизма» (в отличие от мегалобластической анемии за счет недостатка фолиевой кислоты).
В болезни Бирмера роль строения и наследственности была выявлена при описании первых случаев (Аддисон). В дальнейшем высказывалось предположение о взаимосвязи с определенными соматическими, нервными или эндокринными строениями, была отмечена частота отдельных соматических черт (широкое лицо, отдаленные глаза, белесный цвет волос, раннее появление седины и пр.), которые, в, настоящее время, не считаются показательными.
Более важным представляется рост частоты полностью развившегося заболевания или его частичного проявления в семье больного.
По материалам Вернера (цит. Бегеманном), проводившего исследования в ряде семей страдающих, у 9% обследованных были отмечены иные явные случаи заболевания, а в 15% — частичные проявления [скрытые или исходные признаки болезни]. Среди близких родственников больного наиболее часто наблюдались заниженность или отсутствие кислотности (19%), желудочно-кишечные расстройства (33%), холе-цистопатия (15%) (реже — 8%—изменения языка), парестезия (25%) (в некоторых семьях наблюдалось развитие заболевания в сопровождении невропатии); из числа гематологических сдвигов отмечены мокроцитоз, овалицотоз, гиперсегментирование (примерно в 23% случаев).
Болезнь Бирмера описана и у одножелточных близнецов (Arbo и Mohr).
Другими аргументами, выступающими за генетический детерминизм болезни являются значительная частота антител против пристеночных клеток и сокращение ВФ у родственников больного (Ардеман и сотр.), также возможно, существенно увеличенная частота кровяной группы А (II) у страдающих бирмеровской анемией. К тому же выявлены (Асталди и сотр.,) количественные и качественныз изменения хромосом (непостоянные, нехарактерные).
По одному из предложенных генетических объяснений болезнь передается посредством гена, вовлеченного в процесс образования внутреннего фактора, при этом дефицит передается доминантным способом, но с небольшой проницаемостью; гомозитотное состояние видимо обусловливает ювенильную форму заболевания (при врожденном отсутствии внутреннего фактора), в то время как для проявления болезни в гетерозиготных условиях (обычной у взрослых) предполагается необходимым образование, во времени, атрофических поражений слизистой оболочки желудка (под воздействием каких-то эпигенетических факторов).
Вероятность наличия полигенетического механизма подсказывается относительно большой частотой случаев «конституционной гипохромной анемии» (с заниженным выделением желудочного сока, воспалением слизистой оболочки языка и пр.) среди родственников больного.
Второй основной вопрос патогенеза болезни Бирмера связан с нали чием аутоиммунных антител у большинства больных.
В сыворотке примерно 40% страдающих имеются антитела против ВФ, в то время как у примерно 90% — антитела против пристеночных клеток. Последние (примерно в размере 30% случаев) выявляются и при других заболеваниях аутоиммунного патогенеза, таких как тиреоз Хашимото, тиреотоксикоз, генуинная недостаточность надпочечной железы (Ирвине и сотр.). С другой стороны у 40—50% страдающих отмечается наличие противощитовидных антител.
Однако антитела против пристеночных клеток встречаются и при простом атрофическом гастрите (60%) или даже у лиц, страдающих невыявимыми заболеваниями (5—8%), особенно у женщин старше 60 лет (Ирвине и сотр.). Поставлен вопрос о том, не составляет ли развитие этих аутоантител вторичное явление изменению антител клеточных структур.
Антитела против внутреннего фактора находятся в разной пропорции в слюне и желудочном соке страдающих бирмеровской болезнью; их роль в сокращении поглощения витамина В1а доказана. Что касается роли антител против пристеночных клеток в патогенезе поражения слизистой оболочки желудка вопрос остается еще невыясненным (участвуют иммунологические механизмы гуморального и клеточного видов в обстановке разных эндо- и экзогенных факторов).
С диагностической точки зрения в случае мегалобластической анемии присутствие антител против пристеночных клеток указывает, с большой вероятностью, на наличие болезни Бирмера, в то время как выявление антител против внутреннего фактора свидетельствует о развитии этого заболевания почти с достоверностью (Williams).
Другим аргументом в пользу аутоиммунного патогенеза болезни Бирмера служит способность глюкокортикостероидов обусловливать (временно) регрессию поражений слизистой желудка и понижение коэффициента антител против внутреннего фактора (Robro и сотр.).
На сонове этих аргументов, выступающих, с одной стороны, за наследственный характер болезни, а с другой, за аутоиммунный фактор патогенеза в настоящее время многие авторы склонны рассматривать болезнь Бирмера как результат генетического недостатка, вызывающего иммунологическое нарушение, которое заключается в низкой иммуной переносимости в отношении клеток желудочного эпителия (и других клеток одинакового эмбриологического происхождения), в связи с чем проявляются аутоантитела (под воздействием добавочных факторов).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Публикации в СМИ
Анемия пернициозная и другие В12-дефицитные анемии
Анемии этой группы развивается вследствие дефицита витамина B12 (суточная потребность 1–5 мкг). Пернициозная анемия — аутоиммунное заболевание с образованием АТ к париетальным клеткам желудка или внутреннему фактору Касла. В большинстве случаев сочетается с фундальным гастритом и ахлоргидрией. Существуют также B12-дефицитные анемии алиментарного генеза. Пернициозная анемия может быть врождённой или приобретённой. Преобладающий возраст — старше 60 лет.
Этиология • Пернициозная анемия •• Фундальный гастрит (тип А) ••• АТ к париетальным клеткам желудка ••• Иммунные нарушения (выработка АТ к внутреннему фактору Касла) • Другие B12-дефицитные анемии •• Вегетарианская диета без дополнительного приёма витамина B12 •• Гастрэктомия •• Синдром приводящей петли •• Инвазия лентецом широким •• Синдром мальабсорбции •• Хронический панкреатит •• Хронический алкоголизм •• ЛС (бигуаниды, фенилбутазон, аминосалициловая кислота, пероральные контрацептивы).
Генетические аспекты. Существует ряд генетически разнородных форм пернициозной анемии • Классическая пернициозная анемия взрослых (170900, предположительно Â ) с нарушением всасывания витамина В12 • Пернициозная анемия у подростков с полигландулярным аутоиммунным синдромом (*240300, 21q22.3, r ) • Пернициозная анемия ювенильная с относительной недостаточностью всасывания витамина B12 и протеинурией (*261100, синдром Иммурслунд–Грасбека, 10p12.1, MGA1, r ). При этой мегалобластной анемии возможны мальформации мочевыделительного тракта и протеинурия • Врождённая пернициозная анемия (*261000, хр. 11, мутация гена GIF, r ) вследствие отсутствия секреции гастромукопротеина при нормальных кислотности желудочного сока и морфологии слизистой оболочки. Характерна экспрессия HLA-DR2, HLA-DR4.
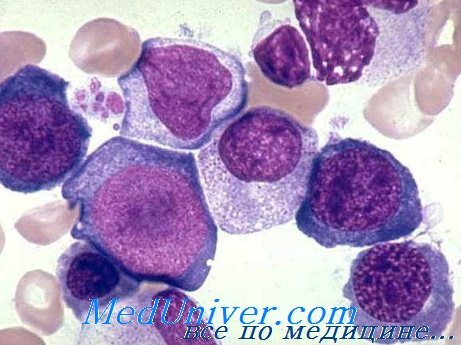
Патоморфология • Костный мозг — мегалобластный тип кроветворения, повышенное содержание железа, гиперсегментированные нейтрофилы • Желудок — фундальный гастрит, гипертрофия бокаловидных клеток, атрофия париетальных клеток, атрофия главных клеток, характерен клеточный атипизм • Спинной мозг — дегенерация миелина задних и боковых столбов, дегенеративные изменения ганглиев задних корешков (фуникулярный миелоз) • Дегенерация периферических нервов.
Клиническая картина определяется дефицитом витамина B12 • Общие признаки анемии (слабость, одышка, тахикардия, бледность, шум в ушах и др.) • Фуникулярный миелоз (парестезии, снижение вибрационной чувствительности, атрофии мышц, полиневрит, патологические рефлексы) • Нарушение координации (положительные проба Ромберга и пальценосовая проба) • Психические нарушения (спутанность сознания, депрессия, деменция) • Со стороны ЖКТ — атрофический глоссит (малиновый «лакированный» язык), гепатоспленомегалия, анорексия • Кожа — гиперпигментация, пурпура, витилиго.
Возрастные особенности • Ювенильная пернициозная анемия часто возникает у подростков и в целом аналогична анемии у взрослых • Врождённая пернициозная анемия обычно проявляется до 3 лет • У пожилых пернициозная анемия возникает наиболее часто в сочетании с другими аутоиммунными нарушениями, депрессией и деменцией.
Сопутствующая патология • Аутоиммунные заболевания (ревматоидный артрит, болезнь Грейвса, гипотиреоз, гипопаратиреоз, тиреоидит Хашимото, СД) • Идиопатическая надпочечниковая недостаточность • ЖДА • Агаммаглобулинемия • Спру тропическая • Болезнь Крона • Инфильтративные заболевания подвздошной и тонкой кишки.
Лабораторные исследования • Панцитопения (анемия, лейкопения, тромбоцитопения) • Мазок периферической крови: макроцитоз (средний эритроцитарный объём >115 мкм 3 ), эллиптоцитоз, анизоцитоз, пойкилоцитоз; тельца Хауэлла–Жолли (сферические или овоидные эксцентрично расположенные гранулы; встречаются в циркулирующих эритроцитах, чаще и в большем количестве после спленэктомии) и кольца Кэбота, гиперсегментированные нейтрофилы, количество ретикулоцитов нормально или несколько снижено • Концентрация витамина B12 в плазме крови 6 • АТ к внутреннему фактору Касла • АТ к париетальным клеткам • Гипербилирубинемия за счёт прямой фракции • Уменьшение содержания гаптоглобина • Увеличение активности ЛДГ.
Состояния, влияющие на результаты исследований • Ложное повышение среднего эритроцитарного объёма обусловливают следующие факторы: •• холодовые агглютинины •• гипергликемия •• выраженный лейкоцитоз • Ложное нормальное содержание витамина B12 в плазме крови обусловливают следующие состояния: •• миелопролиферативные заболевания •• заболевания печени • Ложное снижение содержания B12 в плазме крови обнаруживают при наличии следующих факторов: •• множественная миелома •• приём пероральных контрацептивов •• беременность •• недостаточность фолиевой кислоты •• недостаточность транскобаламина II.
Специальные исследования • Проба Шиллинга — уменьшенное поглощение витамина B12 • Пункция костного мозга.
ЛЕЧЕНИЕ
Тактика ведения • При пернициозной анемии лечение необходимо проводить пожизненно • Режим амбулаторный • Ежемесячное введение цианокобаламина • Эндоскопическое обследование каждые 5 лет для исключения рака желудка или по показаниям • Диета с повышенным содержанием белка.
Лекарственная терапия. Цианокобаламин — по 100 мкг п/к ежедневно в течение 1 нед, затем 1 раз в неделю в течение 1 мес и далее 1 р/мес в течение всей жизни.
Осложнение лечения — гипокалиемия (может появиться на 1-й неделе лечения).
Течение и прогноз благоприятные при своевременном и адекватном лечении витамином цианокобаламином. Признаки поражения ЦНС могут сохраняться, если лечение пациента было начато через 6 мес и более от начала заболевания.
Синонимы • Злокачественная анемия • Аддисона–Бирмера болезнь • Бирмера болезнь
МКБ-10 • D51 Витамин-B12-дефицитная анемия
Код вставки на сайт
Анемия пернициозная и другие В12-дефицитные анемии
Анемии этой группы развивается вследствие дефицита витамина B12 (суточная потребность 1–5 мкг). Пернициозная анемия — аутоиммунное заболевание с образованием АТ к париетальным клеткам желудка или внутреннему фактору Касла. В большинстве случаев сочетается с фундальным гастритом и ахлоргидрией. Существуют также B12-дефицитные анемии алиментарного генеза. Пернициозная анемия может быть врождённой или приобретённой. Преобладающий возраст — старше 60 лет.
Этиология • Пернициозная анемия •• Фундальный гастрит (тип А) ••• АТ к париетальным клеткам желудка ••• Иммунные нарушения (выработка АТ к внутреннему фактору Касла) • Другие B12-дефицитные анемии •• Вегетарианская диета без дополнительного приёма витамина B12 •• Гастрэктомия •• Синдром приводящей петли •• Инвазия лентецом широким •• Синдром мальабсорбции •• Хронический панкреатит •• Хронический алкоголизм •• ЛС (бигуаниды, фенилбутазон, аминосалициловая кислота, пероральные контрацептивы).
Генетические аспекты. Существует ряд генетически разнородных форм пернициозной анемии • Классическая пернициозная анемия взрослых (170900, предположительно Â ) с нарушением всасывания витамина В12 • Пернициозная анемия у подростков с полигландулярным аутоиммунным синдромом (*240300, 21q22.3, r ) • Пернициозная анемия ювенильная с относительной недостаточностью всасывания витамина B12 и протеинурией (*261100, синдром Иммурслунд–Грасбека, 10p12.1, MGA1, r ). При этой мегалобластной анемии возможны мальформации мочевыделительного тракта и протеинурия • Врождённая пернициозная анемия (*261000, хр. 11, мутация гена GIF, r ) вследствие отсутствия секреции гастромукопротеина при нормальных кислотности желудочного сока и морфологии слизистой оболочки. Характерна экспрессия HLA-DR2, HLA-DR4.
Патоморфология • Костный мозг — мегалобластный тип кроветворения, повышенное содержание железа, гиперсегментированные нейтрофилы • Желудок — фундальный гастрит, гипертрофия бокаловидных клеток, атрофия париетальных клеток, атрофия главных клеток, характерен клеточный атипизм • Спинной мозг — дегенерация миелина задних и боковых столбов, дегенеративные изменения ганглиев задних корешков (фуникулярный миелоз) • Дегенерация периферических нервов.
Клиническая картина определяется дефицитом витамина B12 • Общие признаки анемии (слабость, одышка, тахикардия, бледность, шум в ушах и др.) • Фуникулярный миелоз (парестезии, снижение вибрационной чувствительности, атрофии мышц, полиневрит, патологические рефлексы) • Нарушение координации (положительные проба Ромберга и пальценосовая проба) • Психические нарушения (спутанность сознания, депрессия, деменция) • Со стороны ЖКТ — атрофический глоссит (малиновый «лакированный» язык), гепатоспленомегалия, анорексия • Кожа — гиперпигментация, пурпура, витилиго.
Возрастные особенности • Ювенильная пернициозная анемия часто возникает у подростков и в целом аналогична анемии у взрослых • Врождённая пернициозная анемия обычно проявляется до 3 лет • У пожилых пернициозная анемия возникает наиболее часто в сочетании с другими аутоиммунными нарушениями, депрессией и деменцией.
Сопутствующая патология • Аутоиммунные заболевания (ревматоидный артрит, болезнь Грейвса, гипотиреоз, гипопаратиреоз, тиреоидит Хашимото, СД) • Идиопатическая надпочечниковая недостаточность • ЖДА • Агаммаглобулинемия • Спру тропическая • Болезнь Крона • Инфильтративные заболевания подвздошной и тонкой кишки.
Лабораторные исследования • Панцитопения (анемия, лейкопения, тромбоцитопения) • Мазок периферической крови: макроцитоз (средний эритроцитарный объём >115 мкм 3 ), эллиптоцитоз, анизоцитоз, пойкилоцитоз; тельца Хауэлла–Жолли (сферические или овоидные эксцентрично расположенные гранулы; встречаются в циркулирующих эритроцитах, чаще и в большем количестве после спленэктомии) и кольца Кэбота, гиперсегментированные нейтрофилы, количество ретикулоцитов нормально или несколько снижено • Концентрация витамина B12 в плазме крови 6 • АТ к внутреннему фактору Касла • АТ к париетальным клеткам • Гипербилирубинемия за счёт прямой фракции • Уменьшение содержания гаптоглобина • Увеличение активности ЛДГ.
Состояния, влияющие на результаты исследований • Ложное повышение среднего эритроцитарного объёма обусловливают следующие факторы: •• холодовые агглютинины •• гипергликемия •• выраженный лейкоцитоз • Ложное нормальное содержание витамина B12 в плазме крови обусловливают следующие состояния: •• миелопролиферативные заболевания •• заболевания печени • Ложное снижение содержания B12 в плазме крови обнаруживают при наличии следующих факторов: •• множественная миелома •• приём пероральных контрацептивов •• беременность •• недостаточность фолиевой кислоты •• недостаточность транскобаламина II.
Специальные исследования • Проба Шиллинга — уменьшенное поглощение витамина B12 • Пункция костного мозга.
ЛЕЧЕНИЕ
Тактика ведения • При пернициозной анемии лечение необходимо проводить пожизненно • Режим амбулаторный • Ежемесячное введение цианокобаламина • Эндоскопическое обследование каждые 5 лет для исключения рака желудка или по показаниям • Диета с повышенным содержанием белка.
Лекарственная терапия. Цианокобаламин — по 100 мкг п/к ежедневно в течение 1 нед, затем 1 раз в неделю в течение 1 мес и далее 1 р/мес в течение всей жизни.
Осложнение лечения — гипокалиемия (может появиться на 1-й неделе лечения).
Течение и прогноз благоприятные при своевременном и адекватном лечении витамином цианокобаламином. Признаки поражения ЦНС могут сохраняться, если лечение пациента было начато через 6 мес и более от начала заболевания.
Синонимы • Злокачественная анемия • Аддисона–Бирмера болезнь • Бирмера болезнь
МКБ-10 • D51 Витамин-B12-дефицитная анемия