Болевой синдром что это такое
Абдоминальный болевой синдром: этиология, патогенез и вопросы терапии
По механизму возникновения боли в брюшной полости подразделяются на висцеральные, паристальные (соматические), отраженные (иррадиирующие) и психогенные Каковы причины абдоминального болевого синдрома? В чем заключается терапия абдоминального болевог
По механизму возникновения боли в брюшной полости подразделяются на висцеральные, паристальные (соматические), отраженные (иррадиирующие) и психогенные
Каковы причины абдоминального болевого синдрома?
В чем заключается терапия абдоминального болевого синдрома?
Абдоминальный болевой синдром является ведущим в клинике большинства заболеваний органов пищеварения. Боль — это спонтанное субъективное ощущение, возникающее вследствие поступления в центральную нервную систему патологических импульсов с периферии (в отличие от болезненности, которая определяется при обследовании, например, при пальпации). Тип боли, ее характер не всегда зависят от интенсивности инициальных стимулов. Органы брюшной полости обычно нечувствительны ко многим патологическим стимулам, которые при воздействии на кожу вызывают сильную боль. Разрыв, разрез или раздавливание внутренних органов не сопровождаются заметными ощущениями. В то же время растяжение и напряжение стенки полого органа раздражают болевые рецепторы. Так, натяжение брюшины (опухоли), растяжение полого органа (например, желчная колика) или чрезмерное сокращение мышц вызывают абдоминальные боли. Болевые рецепторы полых органов брюшной полости (пищевод, желудок, кишечник, желчный пузырь, желчные и панкреатические протоки) локализуются в мышечной оболочке их стенок. Аналогичные рецепторы имеются в капсуле паренхиматозных органов, таких как печень, почки, селезенка, и их растяжение также сопровождается болью. Брыжейка и париетальная брюшина чувствительны к болевым стимулам, в то время как висцеральная брюшина и большой сальник лишены болевой чувствительности.
Абдоминальные боли подразделяются на острые, которые развиваются, как правило, быстро или, реже, постепенно и имеют небольшую продолжительность (минуты, редко несколько часов), а также хронические, для которых характерно постепенное нарастание. Эти боли сохраняются или рецидивируют на протяжении недель и месяцев. Этиологическая классификация абдоминальных болей представлена в табл. 1.
По механизму возникновения боли в брюшной полости подразделяются на висцеральные, париетальные (соматические), отраженные (иррадиирующие) и психогенные.
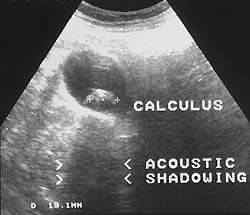 |
| Рисунок 1. Причиной абдоминальной боли может быть калькулезный холецистит (УЗИ) |
Висцеральная боль возникает при наличии патологических стимулов во внутренних органах и проводится симпатическими волокнами. Основными импульсами для ее возникновения являются внезапное повышение давления в полом органе и растяжение его стенки (наиболее частая причина), растяжение капсулы паренхиматозных органов, натяжение брыжейки, сосудистые нарушения.
Соматическая боль обусловлена наличием патологических процессов в париетальной брюшине и тканях, имеющих окончания чувствительных спинномозговых нервов.
Основными импульсами для ее возникновения являются повреждение брюшной стенки и брюшины.
Дифференциально-диагностические признаки висцеральной и соматической боли представлены в табл. 2.
Иррадиирующая боль локализуется в различных областях, удаленных от патологического очага. Она возникает в тех случаях, если импульс висцеральной боли чрезмерно интенсивен (например, прохождение камня) или при анатомическом повреждении органа (например, ущемление кишки). Иррадиирующая боль передается на участки поверхности тела, которые имеют общую корешковую иннервацию с пораженным органом брюшной области. Так, например, при повышении давления в кишечнике вначале возникает висцеральная боль, которая затем иррадиируют в спину, при билиарной колике — в спину, в правую лопатку или плечо.
Психогенная боль возникает при отсутствии периферического воздействия либо когда последнее играет роль пускового или предрасполагающего фактора. Особая роль в ее возникновении принадлежит депрессии. Последняя часто протекает скрыто и не осознается самими пациентами. Тесная связь депрессии с хронической абдоминальной болью объясняется общими биохимическими процессами и, в первую очередь, недостаточностью моноаминергических (серотонинергических) механизмов. Это подтверждается высокой эффективностью антидепрессантов, особенно ингибиторов обратного захвата серотонина, в лечении болевого синдрома. Характер психогенных болей определяется особенностями личности, влиянием эмоциональных, когнитивных, социальных факторов, психологической стабильностью больного и его прошлым «болевым опытом». Основными признаками данных болей являются их длительность, монотонность, диффузный характер и сочетание с другими локализациями (головная боль, боль в спине, во всем теле). Нередко психогенные боли могут сочетаться с другими, указанными выше типами болей и оставаться после их купирования, существенно трансформируя их характер, что необходимо учитывать при терапии.
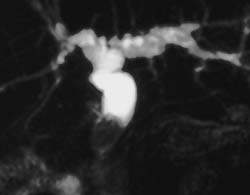 |
| Рисунок 2. Камень в общем желчном протоке у пациента после холецистэктомии (МРТ) |
Одной из разновидностей болей центрального генеза является абдоминальная мигрень. Последняя чаще встречается в молодом возрасте, носит интенсивный разлитой характер, но может быть локальной в параумбиликальной области. Характерны сопутствующие тошнота, рвота, понос и вегетативные расстройства (побледнение и похолодание конечностей, нарушения ритма сердца, артериального давления и др.), а также мигренозная цефалгия и характерные для нее провоцирующие и сопровождающие факторы. Во время пароксизма отмечается увеличение скорости линейного кровотока в брюшной аорте. Наиболее важными механизмами контроля болевого синдрома являются эндогенные опиатные системы. Опиатные рецепторы локализуются в окончаниях чувствительных нервов, в нейронах спинного мозга, в стволовых ядрах, в таламусе и лимбических структурах головного мозга. Связь данных рецепторов с рядом нейропептидов, таких как эндорфины и энкефалины, обусловливает морфиноподобный эффект. Опиатная система работает по следующей схеме: активация чувствительных окончаний приводит к выделению субстанции Р, что вызывает появление периферических восходящих и центральных нисходящих ноцицептивных (болевых) импульсов. Последние активизируют выработку эндорфинов и энкефалинов, которые блокируют выделение субстанции Р и снижают болевые ощущения.
Существенное значение в формировании болевого синдрома имеют серотонин и норадреналин. В структурах мозга находится большое количество серотонинергических и норадренергических рецепторов, а в состав нисходящих антиноцицептивных (противоболевых) структур входят серотонинергические и норадренергические волокна. Уменьшение уровня серотонина приводит к снижению болевого порога и усилению болей. Норадреналин опосредует увеличение активности антиноцицептивных систем.
Наличие болевого абдоминального синдрома требует углубленного обследования больного для уточнения механизмов его развития и выбора тактики лечения. Подавляющему большинству больных с наличием соматических болей, как правило, необходимо хирургическое лечение. Висцеральные боли, возникающие у больных как с наличием органических поражений органов пищеварения, так и без них, являются следствием нарушения, в первую очередь, моторной функции последних. В результате в полых органах повышается давление и/или наблюдается растяжение его стенки, и возникают условия для формирования восходящих ноцицептивных импульсов.
В регуляции транспорта ионов кальция участвуют ряд нейрогенных медиаторов: ацетилхолин, катехоламины (норадреналин), серотонин, холецистокинин, мотилин и др. Связывание ацетилхолина с М-холинорецепторами способствует открытию натриевых каналов и вхождению ионов натрия в клетку. Последнее снижает электрический потенциал клеточной мембраны (фаза деполяризации) и приводит к открытию кальциевых каналов, через которые ионы кальция поступают в клетку, вызывая мышечное сокращение.
Серотонин оказывает существенное влияние на моторику желудочно-кишечного тракта, активируя ряд рецепторов, локализирующихся на эффекторных клетках. Выделяют несколько подтипов рецепторов (5-МТ1-4), однако наиболее изучены 5-МТ3 и 5-МТ4. Связывание серотонина с 5-МТ3 способствует расслаблению, а с 5-МТ4 — сокращению мышечного волокна. В то же время механизмы действия серотонина на мышечные волокна желудочно-кишечного тракта до конца не установлены. Имеются лишь предположения о вовлечении в эти процессы ацетилхолина.
Тахикинины, в состав которых входят три типа пептидов (субстанция Р, нейрокинин А и В), связываясь с соответствующими рецепторами миоцитов, повышают их моторную активность не только в результате прямой активации, но и вследствие выделения ацетилхолина. Определенную роль в регуляции моторной функции кишечника играют эндогенные опиаты. При связывании их с μ- и δ-опиоидными рецепторами миоцитов происходит стимуляция, а с κ-рецепторами — замедление моторики пищеварительного тракта.
Основные направления купирования болевого абдоминального синдрома включают: а) этиологическое и патогенетическое лечение основного заболевания; б) нормализацию моторных расстройств; в) снижение висцеральной чувствительности; г) коррекцию механизмов восприятия болей.
Нарушения двигательной функции органов желудочно-кишечного тракта играют значительную роль в формировании не только болевого синдрома, но и большинства диспепсических расстройств (чувство переполнения в желудке, отрыжка, изжога, тошнота, рвота, метеоризм, поносы, запоры). Большинство из указанных выше симптомов могут иметь место как при гипокинетическом, так и при гиперкинетическом типе дискинезии, и только углубленное исследование позволяет уточнить их характер и выбрать адекватную терапию.
Одним из наиболее частых функциональных нарушений, в том числе и с наличием органической патологии органов пищеварения, является спастическая (гиперкинетическая) дискинезия. Так, при спастической дискинезии любого отдела пищеварительного тракта наблюдается повышение внутрипросветного давления и нарушение продвижения содержимого по полому органу, что создает предпосылки для возникновения боли. При этом скорость нарастания давления в органе пропорциональна интенсивности боли.
Спастическая дискинезия мышечной оболочки стенки полого органа или сфинктеров представляет собой наиболее частый механизм развития болевого синдрома при эзофагоспазме, дисфункции сфинктера Одди и пузырного протока, синдроме раздраженного кишечника.
В настоящее время для купирования болевого синдрома в комплексном лечении вышеуказанных заболеваний используются релаксанты гладкой мускулатуры, которые включают несколько групп препаратов. Антихолинергические средства снижают концентрацию интрацеллюлярных ионов кальция, что приводит к мышечной релаксации. Важно отметить, что степень релаксации находится в прямой зависимости от предшествующего тонуса парасимпатической нервной системы. Последнее обстоятельство определяет существенные различия индивидуальной эффективности препаратов данной группы. В качестве спазмолитиков используют как неселективные (препараты красавки, метацин, платифиллин, бускопан и др.), так и селективные М1-холиноблокаторы (гастроцепин и др.). Однако довольно низкая эффективность и широкий спектр побочных эффектов ограничивают их применение для купирования болевого синдрома у значительной части больных.
Механизм действия миотропных спазмолитиков в конечном итоге сводится к накоплению в клетке цАМФ и уменьшению концентрации ионов кальция, что тормозит соединение актина с миозином. Эти эффекты могут достигаться ингибированием фосфодиэстеразы, или активацией аденилатциклазы, или блокадой аденозиновых рецепторов, либо их комбинацией. Основными представителями данной группы препаратов являются дротаверин (но-шпа, но-шпа форте, спазмол), бенциклан (галидор), отилония бромида (спазмомен), метеоспазмил и др. При использовании миогенных спазмолитиков, так же как и М-холиноблокаторов, необходимо учитывать существенные индивидуальные различия их эффективности, отсутствие селективности эффектов (действуют практически на всю гладкую мускулатуру, включая мочевыделительную систему, кровеносные сосуды и др.), развитие гипомоторной дискинезии и гипотонии сфинктерного аппарата пищеварительного тракта, особенно при длительном применении. Данные препараты используются кратковременно (от однократного приема до двух-трех недель) для купирования спазма, а следовательно, болевого синдрома.
В ряду миотропных спазмолитиков следует отметить препарат мебеверин (дюспатолин), механизм действия которого сводится к блокаде быстрых натриевых каналов клеточной мембраны миоцита, что нарушает поступление натрия в клетку, замедляет процессы деполяризации и блокирует вход кальция в клетку через медленные каналы. В результате прекращается фосфорилирование миозина и отсутствует сокращение мышечного волокна. Известно также, что выход ионов кальция из внутриклеточных депо в результате активации α1-адренорецепторов приводит к открытию калиевых каналов, выходу ионов калия из клетки, гиперполяризации и отсутствию мышечного сокращения, что может становиться в течение длительного времени причиной мышечной гипотонии. В отличие от других миотропных спазмолитиков мебеверин препятствует пополнению внутриклеточных кальциевых депо, что в конечном итоге приводит лишь к кратковременному выходу ионов калия из клетки и ее гипополяризации. Последняя предупреждает развитие постоянного расслабления или гипотонии мышечной клетки. Следовательно, назначение мебеверина (дюспатолина) приводит только к снятию спазма без развития гипотонии гладкой мускулатуры, т. е. не нарушает моторики желудочно-кишечного тракта. Препарат оказался эффективным для купирования абдоминальных болей и дискомфорта, нарушений стула, обусловленных синдромом раздраженного кишечника, а также возникающих на фоне органических заболеваний.
Среди миотропных спазмолитиков также обращает на себя внимание препарат гимекромон (одестон). Одестон (7-гидрокси-4-метилкумарин) оказывает избирательное спазмолитическое действие на сфинктер Одди и сфинктер желчного пузыря, обеспечивает отток желчи в двенадцатиперстную кишку, снижает давление в билиарной системе и, как следствие, купирует билиарный болевой синдром. Одестон не обладает прямым желчегонным действием, но облегчает приток желчи в пищеварительный тракт, тем самым усиливая энтерогепатическую рециркуляцию желчных кислот, которые участвуют в первой фазе образования желчи. Преимущество одестона по сравнению с другими спазмолитиками заключается в том, что он практически не оказывает влияния на другие гладкие мышцы, в частности, кровеносной системы и кишечной мускулатуры.
Чрезвычайно перспективным направлением в лечении моторных расстройств является использование селективных блокаторов кальциевых каналов. В настоящее время из этой группы широкое распространение получил пинавериум бромид (дицетел). Дицетел блокирует потенциалзависимые кальциевые каналы миоцитов кишечника, резко снижает поступление в клетку экстрацеллюлярных ионов кальция и тем самым предотвращает мышечное сокращение. К числу достоинств дицетела относятся местное (внутрикишечное) действие препарата, тканевая селективность, отсутствие побочных, в т. ч. и кардиоваскулярных эффектов. Препарат можно применять в течение длительного времени, не опасаясь развития гипотонии кишечника. Клинические исследования показали высокую эффективность дицетела в лечении синдрома раздраженного кишечника и других заболеваний, при которых наблюдается спастическая дискинезия толстой кишки.
В купировании болевого синдрома особая роль отводится препаратам, влияющим на висцеральную чувствительность и механизмы восприятия болей. Это касается, в первую очередь, больных с функциональными заболеваниями желудочно-кишечного тракта (функциональная диспепсия, синдром раздраженного кишечника, функциональные абдоминальные боли и др.) и психогенными абдоминальными болями.
В настоящее время широко обсуждается возможность использования антидепрессантов, антагонистов 5-НТ3, агонистов κ-опиоидных рецепторов, аналогов соматостатина (октреотида). Из них лучше всего изучены антидепрессанты, реализующие противоболевой эффект двумя путями: 1) за счет уменьшения депрессивной симптоматики, учитывая тот факт, что хроническая боль может быть маской депрессии; 2) за счет активации антиноцицептивных серотонинергических и норадренергических систем. Антидепрессанты назначаются в терапевтических (но не в низких) дозах (амитриптилин 50-75 мг/сут., миансерин 30-60 мг/сут. и т. д.), продолжительность их приема должна составлять не менее 4-6 недель. Препараты эффективны в комплексной терапии.
Таким образом, генез абдоминальных болей является полиэтиологическим и полипатогенетическим. Лечение болевого синдрома должно быть направлено на нормализацию структурных и функциональных нарушений пораженного органа, а также на нормализацию функций нервной системы, отвечающих за восприятие болей.
Литература.
1. Вегетативные расстройства. Руководство для врачей. Под ред. проф. А.М. Вейна. М., 1998.
2. Вейн А. М., Данилова А. Б. Кардиалгии и абдоминалгии // РМЖ, 1999. 7, № 9. С. 428-32.
3. Григорьев П. Я., Яковенко А. В. Клиническая гастроэнтерология. М.: Медицинское информационное агентство, 2001. С. 704.
4. Ивашкин В. Т. Синдром раздраженной кишки // Рос. журн. гастроэнтерол., гепатол., колопроктол. 1993, т. 2, № 3. С. 27-31.
5. Яковенко Э. П. Григорьев П. Я. Хронические заболевания внепеченочных желчевыводящих путей. Диагностика и лечение. Метод. пособие для врачей. М.: Медпрактика, 2000. С. 31.
Таблица 1. Этиология абдоминальных болей
Интраабдоминальные причины
Экстраабдоминальные причины
Примечание. Частота заболеваний в рубриках указана в убывающем порядке.
Лечение хронического болевого синдрома
Следует различать боли, обусловленные непосредственно болезнью, и хронический болевой синдром, представляющий собой комплексное расстройство работы ряда органов и систем. «Нормальная», физиологическая боль носит защитный характер. Она стихает одновременно с патологическим процессом, ставшим причиной боли, в то время как симптомы ХБС проявляются независимо от основного заболевания.
Хронический болевой синдром (ХБС) — это самостоятельное неврологическое заболевание, характеризующееся длительными болями. Как правило, ХБС возникает вследствие болезни или травмы.
Следует различать боли, обусловленные непосредственно болезнью, и хронический болевой синдром, представляющий собой комплексное расстройство работы ряда органов и систем. «Нормальная», физиологическая боль носит защитный характер. Она стихает одновременно с патологическим процессом, ставшим причиной боли, в то время как симптомы ХБС проявляются независимо от основного заболевания. Именно поэтому современная неврология рассматривает хронический болевой синдром как отдельную проблему, успешное решение которой возможно только при участии специалистов по лечению ХБС, использующих комплексный подход к болезни.
Причины развития
Чаще всего хронический болевой синдром развивается как осложнение заболеваний опорно-двигательного аппарата. Наиболее распространенные причины возникновения ХБС — болезни суставов (остеоартроз, ревматоидный артрит) и фибромиалгия. От хронических болей часто страдают пациенты с туберкулезом позвоночника и различными опухолями.
Считается, что для развития хронического болевого синдрома наличия одного диагноза недостаточно — необходим еще особый тип организации нервной системы. Как правило, ХБС развивается у людей, склонных к депрессиям, ипохондрии, тяжелому пережирванию стрессов.
Важно понимать, что у таких пациентов хронический болевой синдром является проявлением депрессии, ее «маской», а не наоборот, хотя сами больные и их близкие обычно считают именно подавленное настроение и апатию следствием болезненных ощущений.
Не следует, однако, считать хронический болевой синдром проблемой исключительно психологического характера. Психогенная боль, о которой шла речь выше, действительно играет огромную роль в развитии ХБС, но также не менее важны и воспалительный, нейрогенный (обусловленный нарушениями работы нервов, ответственных за передачу болевых импульсов) и сосудистый механизмы формирования хронических болей. Даже такие, казалось бы, далекие от медицины проблемы, как социальная изоляция больных, способны ухудшить течение ХБС. Формируется замкнутый круг: пациент не может встретиться с друзьями, потому что боли в колене или спине не дают выйти из дома, а дефицит неформального общения приводит к еще большему усилению болевых ощущений.
Отдельную проблему представляет собой хронический болевой синдром у онкологических больных. Как правило, он развивается на поздних стадиях онкологических заболеваний, однако сроки появления болей и их интенсивность зависят не только от локализации новообразования и степени распространенности опухолевого процесса, но и от индивидуальной чувствительности пациента к боли, особенностей его психики и конституции.
Диагностика хронического болевого синдрома
Для оценки интенсивности болевых ощущений пациенту может быть предложена шкала вербальных оценок (ШВО) или визуально-аналоговая шкала (ВАШ). Использование этих шкал позволяет врачу понять, насколько серьезна проблема боли для конкретного пациента, и подобрать наиболее подходящий вариант терапии.
Важный этап диагностики хронического болевого синдрома — определение механизма, играющего ключевую роль в формировании ХБС. От того, окажется ли он психогенным, нейрогенным или каким-либо другим, зависит стратегия лечения.
Боль у онкологических больных
У пациентов онкологического профиля болевой синдром может быть связан не только с самим заболеванием, но и с процессом его лечения. Так, хирургические вмешательства нередко приводят к развитию фантомных болей и спаек, химиотерапия повреждает нервную систему и провоцирует развитие болей в суставах. Кроме того, само по себе тяжелое состояние и необходимость соблюдения постельного режима являются факторами риска развития ХБС: у прикованных к кровати больных часто развиваются пролежни. Определение причины усиления болей у тяжелого онкологического пациента является первым шагом на пути к облегчению его состояния и повышению качества жизни.
Лечение хронического болевого синдрома
ХБС — это комплексное заболевание, в основе которого лежит сразу несколько механизмов.
Эффективность традиционных обезболивающих (прежде всего, нестероидных противовоспалительных препаратов, НПВП) при лечении хронического болевого синдрома невелика: они лишь незначительно снижают интенсивность болевых ощущений или не помогают вовсе. Дело в том, что НПВП способны воздействовать лишь на некоторые механизмы развития хронического болевого синдрома, например, на воспаление.
Чтобы повлиять на процессы, идущие непосредственно в центральной нервной системе, пациентам назначают препараты других групп, прежде всего антидепрессанты.
Медикаментозная терапия является лишь одним из направлений комплексного лечения ХБС. Для борьбы с хронической болью активно применяется физио- и психотерапия, техники аутотренига и релаксации. Борьба с основным заболеванием, например, остеоартрозом, играет важную, но не решающую роль в лечении ХБС.
Стратегия лечения хронического болевого синдрома у онкологических больных несколько отличается. Помимо медикаментозных и психотерапевтических методов борьбы с болью им также показано паллиативное лечение: комплекс мер, направленных на повышение качества жизни и минимизацию ущерба, который опухолевый процесс наносит организму. Например, очистка крови от опухолевых токсинов или хирургическое удаление части опухолевой массы могут улучшить самочувствие и, как следствие, стабилизировать эмоциональное состояние, что естественным образом приведет к уменьшению выраженности болей.
Кроме того, для онкологических больных разработаны специальные схемы медикаментозного обезболивания, позволяющие эффективно купировать болевой синдром и повысить, насколько это возможно, качество жизни.
Хронический болевой синдром
По своему биологическому происхождению боль является сигналом опасности и неблагополучия в организме, и в медицинской практике такая боль часто рассматривается в качестве симптома какой-либо болезни, возникающей при повреждении тканей, вследствие травмы,
По своему биологическому происхождению боль является сигналом опасности и неблагополучия в организме, и в медицинской практике такая боль часто рассматривается в качестве симптома какой-либо болезни, возникающей при повреждении тканей, вследствие травмы, воспаления или ишемии. Формирование болевого ощущения опосредуется структурами ноцицептивной системы [7, 9, 28]. Без нормального функционирования систем, обеспечивающих восприятие боли, существование человека и животных невозможно. Ощущение боли формирует целый комплекс защитных реакций, направленных на устранение повреждения.
Боль является наиболее частой и сложной по субъективному восприятию жалобой пациентов. Она причиняет страдания многим миллионам людей во всем мире, значительно ухудшая условия существования человека. На сегодняшний день доказано, что характер, длительность и интенсивность болевых ощущений зависят не только от самого повреждения, но и во многом определяются неблагоприятными жизненными ситуациями, социальными и экономическими проблемами. В рамках биопсихосоциальной модели боль рассматривается как результат двустороннего динамического взаимодействия биологических (нейрофизиологических), психологических, социальных, религиозных и других факторов. Итогом такого взаимодействия будет индивидуальный характер болевого ощущения и форма реагирования пациента на боль. В соответствии с этой моделью, поведение, эмоции и даже простые физиологические реакции меняются в зависимости от отношения человека к происходящим событиям. Боль является результатом одновременной динамической обработки импульсов от ноцицепторов и большого числа других входящих экстероцептивных (слуховых, зрительных, обонятельных) и интероцептивных (висцеральных) сигналов. Поэтому боль всегда субъективна и каждый человек испытывает ее по-своему. Одно и то же раздражение может восприниматься нашим сознанием по-разному. Восприятие боли зависит не только от места и характера повреждения, но и от условий или обстоятельств, при которых произошло повреждение, от психологического состояния человека, его индивидуального жизненного опыта, культуры, национальных традиций.
Среди хронических болевых синдромов наибольшее распространение получили боли при заболевании суставов, боли в спине, головные боли, скелетно-мышечные боли, невропатические боли. Врачи столкнулись с ситуацией, при которой идентификация и устранение повреждения не сопровождается исчезновением болевого синдрома [26]. В условиях хронического болевого синдрома, как правило, не прослеживается прямая связь с органической патологией либо эта связь имеет неясный, неопределенный характер [15]. Согласно определению экспертов Международной ассоциации по изучению боли к хронической боли относят боль длительностью более трех месяцев и продолжающуюся сверх нормального периода заживления тканей [15]. Хроническую боль стали рассматривать не как симптом какого-либо заболевания, а как самостоятельную болезнь, требующую особого внимания и комплексного этиопатогенетического лечения. Проблема хронической боли из-за большой распространенности и многообразия форм является настолько важной и значимой, что во многих странах для лечения больных с болевыми синдромами созданы специализированные противоболевые центры и клиники.
Что же лежит в основе хронизации боли и почему хроническая боль устойчива к действию классических анальгетиков? Поиск ответов на эти вопросы представляет чрезвычайный интерес для исследователей и врачей и во многом определяет современные направления по изучению проблемы боли.
Все болевые синдромы в зависимости от этиопатогенеза можно условно разделить на три основные группы: ноцицептивные, невропатические и психогенные (боли психологической природы) [7, 15]. В реальной жизни эти патофизиологические варианты болевых синдромов часто сосуществуют.
Ноцицептивные болевые синдромы
Ноцицептивными считают боли, возникающие вследствие поражения тканей с последующей активацией ноцицепторов — свободных нервных окончаний, активирующихся различными повреждающими стимулами. Примерами таких болей является послеоперационная боль, боль при травме, стенокардия у больных с ишемической болезнью сердца, боли в эпигастрии при язвенной болезни желудка, боли у больных с артритами и миозитами. В клинической картине ноцицептивных болевых синдромов всегда обнаруживаются зоны первичной и вторичной гиперальгезии (участки с повышенной болевой чувствительностью).
Первичная гипералгезия развивается в области повреждения тканей, зона вторичной гипералгезии распространяется на здоровые (неповрежденные) участки тела. В основе развития первичной гиперальгезии лежит феномен сенситизации ноцицепторов (повышение чувствительности ноцицепторов к действию повреждающих стимулов) [7, 28]. Сенситизация ноцицепторов возникает вследствие действия веществ, обладающих провоспалительным эффектом (простагландинов, цитокинов, биогенных аминов, нейрокининов и др.) и поступающих из плазмы крови, выделяющихся из поврежденной ткани, а также секретирующихся из периферических терминалей С-ноцицепторов. Эти химические соединения, взаимодействуя с соответствующими рецепторами, расположенными на мембране ноцицепторов, делают нервное волокно более возбудимым и более чувствительным к внешним раздражителям. Представленные механизмы сенситизации характерны для всех типов ноцицепторов, локализованных в любой ткани, и развитие первичной гиперальгезии отмечается не только в коже, но и в мышцах, суставах, костях и внутренних органах [28].
Вторичная гиперальгезия возникает в результате центральной сенситизации (повышения возбудимости ноцицептивных нейронов в структурах ЦНС). Патофизиологической основой сенситизации центральных ноцицептивных нейронов является длительное деполяризующее влияние глутамата и нейрокининов, выделяющихся из центральных терминалей ноцицептивных афферентов вследствие интенсивной постоянной импульсации, идущей из зоны поврежденных тканей [28]. Возникающая вследствие этого повышенная возбудимость ноцицептивных нейронов может сохраняться в течение длительного времени, способствуя расширению площади гипералгезии и ее распространению на здоровые ткани. Выраженность и продолжительность сенситизации периферических и центральных ноцицептивных нейронов напрямую зависят от характера повреждения тканей, и в случае заживления ткани исчезает феномен периферической и центральной сенситизации. Иными словами, ноцицептивная боль представляет собой симптом, возникающий при повреждении ткани.
Невропатические болевые синдромы
Невропатические боли по определению экспертов Международной ассоциации по изучению боли являются следствием первичного повреждения или дисфункции нервной системы [15], однако на 2-м Международном конгрессе по невропатической боли (2007) в определение были внесены изменения. Согласно новому определению, к невропатической боли относят боль, возникающую вследствие прямого повреждения или болезни соматосенсорной системы [10, 25]. Клинически невропатическая боль проявляется комбинацией негативных и позитивных симптомов в виде частичной или полной потери чувствительности (в том числе и болевой) с одновременным возникновением в зоне поражения неприятных, зачастую ярко выраженных болевых ощущений в виде аллодинии, гиперальгезии, дизестезии, гиперпатии [3, 11]. Невропатическая боль может возникнуть как при повреждении периферической нервной системы, так и центральных структур соматосенсорного анализатора.
Патофизиологической основой невропатических болевых синдромов являются нарушения механизмов генерации и проведения ноцицептивного сигнала в нервных волокнах и процессов контроля возбудимости ноцицептивных нейронов в структурах спинного и головного мозга [7]. Повреждение нервов приводит к структурно-функциональным преобразованиям в нервном волокне: увеличивается количество натриевых каналов на мембране нервного волокна, появляются новые нетипичные рецепторы и зоны генерации эктопической импульсации, возникает механочувствительность, создаются условия для перекрестного возбуждения нейронов дорсального ганглия. Все перечисленное формирует неадекватную реакцию нервного волокна на раздражение, способствуя существенному изменению паттерна передаваемого сигнала. Усиленная импульсация с периферии дезорганизует работу и центральных структур: происходит сенситизация ноцицептивных нейронов, гибель тормозных интернейронов, инициируются нейропластические процессы, приводящие к новым межнейронным контактам тактильных и ноцицептивных афферентов, повышается эффективность синаптической передачи [4]. В этих условиях облегчается формирование болевого ощущения.
Однако повреждение периферических и центральных структур соматосенсорной системы, на наш взгляд, не может рассматриваться в качестве непосредственной самостоятельной причины возникновения невропатической боли, а является лишь предрасполагающим фактором. Основанием для подобных рассуждений служат данные, свидетельствующие о том, что невропатическая боль возникает далеко не всегда, даже при наличии клинически подтвержденного повреждения структур соматосенсорного анализатора. Так, перерезка седалищного нерва приводит к появлению болевого поведения только у 40–70% крыс [7]. Повреждение спинного мозга с симптомами гипалгезии и температурной гипестезии сопровождается центральными болями у 30% пациентов [3]. Не более 8% больных, перенесших мозговой инсульт с дефицитом соматосенсорной чувствительности, испытывают невропатические боли [7]. Постгерпетическая невралгия в зависимости от возраста пациентов развивается у 27–70% больных, перенесших опоясывающий лишай [17, 20].
Невропатическая боль у пациентов с клинически верифицированной сенсорной диабетической полиневропатией отмечается в 18–35% случаев [2, 16]. И, наоборот, в 8% случаев у пациентов с сахарным диабетом присутствует клиническая симптоматика невропатической боли при отсутствии признаков сенсорной полиневропатии. Учитывая также, что выраженность болевой симптоматики и степень нарушений чувствительности у подавляющего большинства пациентов с невропатиями не взаимосвязаны [24], можно полагать, что для развития невропатической боли недостаточно наличия повреждения соматосенсорной нервной системы, а требуется ряд условий, приводящих к нарушению интегративных процессов в сфере системной регуляции болевой чувствительности. Именно поэтому в определении невропатической боли, наряду с указанием первопричины (повреждения соматосенсорной нервной системы), должен присутствовать либо термин «дисфункция», либо «дизрегуляция», отражающий важность нейропластических реакций, влияющих на устойчивость системы регуляции болевой чувствительности к действию повреждающих факторов. Иными словами, у ряда индивидуумов изначально существует предрасположенность к развитию устойчивых патологических состояний, в том числе в виде хронической и невропатической боли.
На это указывают данные о существовании у крыс различных генетических линий высокой и низкой устойчивости к развитию невропатического болевого синдрома после перерезки седалищного нерва [8]. Кроме этого, анализ заболеваний, коморбидных невропатической боли, также свидетельствует о первоначальной несостоятельности регуляторных систем организма у этих пациентов. У пациентов с невропатической болью заболеваемость мигренью, фибромиалгией, тревожно-депрессивными расстройствами значительно выше по сравнению с пациентами без невропатической боли [19]. В свою очередь у пациентов с мигренью коморбидными являются следующие заболевания: эпилепсия, синдром раздраженного кишечника, язвенная болезнь желудка, бронхиальная астма, аллергия, тревожные и депрессивные расстройства [21, 26]. Пациенты с фибромиалгией чаще болеют гипертонической болезнью, синдромом раздраженного кишечника, остеоартритами, тревожными и депрессивными расстройствами [12, 23]. Перечисленные заболевания, несмотря на разнообразие клинической симптоматики, могут быть отнесены к так называемым «болезням регуляции», сущность которых во многом определяется дисфункцией нейроиммуногуморальных систем организма, неспособных обеспечить адекватное приспособление к нагрузкам [1, 4].
Изучение особенностей биоэлектрической активности мозга у пациентов с невропатическими, хроническими и идиопатическими болевыми синдромами свидетельствует о наличии схожих изменений в фоновой ритмике ЭЭГ, отражающих дисфункцию корково-подкорковых отношений [5, 6, 13, 18, 22]. Представленные факты позволяют считать, что для возникновения невропатической боли необходимо драматическое соединение двух основных событий — повреждения структур соматосенсорной нервной системы и дисфункции в корково-подкорковых отношениях головного мозга. Именно наличие дисфункции стволовых структур головного мозга во многом будет предопределять реакцию мозга на повреждение, способствовать существованию долго длящейся гипервозбудимости ноцицептивной системы и персистированию болевой симптоматики.
Психогенные болевые синдромы
К психогенным болевым синдромам согласно классификации Международной ассоциации по изучению боли относятся:
В клинике психогенные болевые синдромы характеризуются наличием у пациентов боли, не объяснимой никакими известными соматическими заболеваниями или поражением структур нервной системы. Локализация этой боли обычно не соответствует анатомическим особенностям тканей или зонам иннервации, поражение которых можно было бы подозревать в качестве причины боли. Возможны ситуации, при которых соматические повреждения, включая и нарушения структур соматосенсорной нервной системы, могут обнаруживаться, однако интенсивность боли при этом в значительной мере превышает степень повреждения [7, 28]. Иными словами, ведущим, пусковым фактором в генезе психогенной боли является психологический конфликт, а не повреждение соматических или висцеральных органов или структур соматосенсорной нервной системы.
Выявление психогенной боли является достаточно трудной задачей. Психогенные болевые синдромы часто протекают в виде соматоформного болевого расстройства, при котором болевые симптомы нельзя объяснить имеющейся соматической патологией и они не являются преднамеренными. Для пациентов, склонных к соматоформным расстройствам, характерно наличие в анамнезе множественных соматических жалоб, появившихся в возрасте до 30 лет и продолжающихся много лет. Согласно МКБ-10 для хронического соматоформного болевого расстройства характерно сочетание боли с эмоциональным конфликтом или психосоциальными проблемами, поэтому необходима идентификация психогенного этиологического фактора, о котором можно судить по наличию временных связей между болевой симптоматикой и психологическими проблемами. Для правильной диагностики соматоформного болевого расстройства необходима консультация психиатра для дифференцирования данного состояния с депрессией, шизофренией и другими психическими расстройствами, в структуре которых также могут отмечаться болевые синдромы. Понятие соматоформного болевого расстройства было введено в классификацию психических расстройств относительно недавно, и до настоящего времени оно вызывает много дискуссий.
Вместе с тем необходимо помнить, что возникновение боли, в том числе и психогенной, возможно только в случае активации ноцицептивной системы [7]. Если при возникновении ноцицептивной или невропатической боли происходит прямая активация структур ноцицептивной системы (вследствие травмы тканей или повреждения структур соматосенсорной нервной системы), то у больных с психогенной болью возможно опосредованное возбуждение ноцицепторов — или по механизму ретроградной активации симпатическими эфферентами и/или посредством рефлекторного напряжения мышц. Длительное напряжение мышц при психоэмоциональных нарушениях сопровождается усилением синтеза альгогенов в мышечной ткани и сенситизацией терминалей ноцицепторов, локализованных в мышцах.
Психологический конфликт практически всегда также сопровождается активацией симпатической нервной системы и гипоталамо-гипофизарно-надпочечниковой оси, что может посредством альфа2-адренорецепторов, локализованных на мембране ноцицепторов, способствовать ретроградному возбуждению ноцицепторов и их последующей сенситизации при помощи механизмов нейрогенного воспаления [28]. В условиях нейрогенного воспаления из периферических терминалей ноцицепторов в ткани секретируются нейрокинины (субстанция Р, нейрокинин А и др.), которые обладают провоспалительным эффектом, вызывая увеличение проницаемости сосудов и высвобождение из тучных клеток и лейкоцитов простагландинов, цитокинов и биогенных аминов. В свою очередь, медиаторы воспаления, воздействуя на мембрану ноцицепторов, повышают их возбудимость. Клиническим проявлением сенситизации ноцицепторов при психоэмоциональных расстройствах будут зоны гипералгезии, которые легко диагностируются, например, у пациентов с фибромиалгией или головными болями напряжения.
Заключение
Представленные данные свидетельствуют о том, что болевой синдром независимо от этиологии его возникновения является результатом не только функциональных, но и структурных изменений, затрагивающих всю ноцицептивную систему — от тканевых рецепторов до корковых нейронов. При ноцицептивной и психогенной боли функционально-структурные изменения в системе болевой чувствительности проявляются сенситизацией периферических и центральных ноцицептивных нейронов, в результате которой повышается эффективность синаптической передачи и возникает стойкая гипервозбудимость ноцицептивных нейронов. У больных с невропатической болью структурные преобразования в ноцицептивной системе более значительны и включают формирование локусов эктопической активности в поврежденных нервах и выраженные изменения в интеграции ноцицептивных, температурных и тактильных сигналов в ЦНС. Необходимо также подчеркнуть, что патологические процессы, наблюдаемые в ноцицептивных структурах периферической и центральной нервной системы, в динамике развития любого болевого синдрома тесно взаимосвязаны. Повреждение тканей или периферических нервов, усиливая поток ноцицептивных сигналов, приводит к развитию центральной сенситизации (долговременному повышению эффективности синаптической передачи и гиперактивности ноцицептивных нейронов спинного и головного мозга).
В свою очередь, повышение активности центральных ноцицептивных структур отражается на возбудимости ноцицепторов, например, посредством механизмов нейрогенного воспаления, вследствие чего формируется порочный круг, поддерживающий долго длящуюся гипервозбудимость ноцицептивной системы. Очевидно, что устойчивость такого порочного круга и, следовательно, продолжительность боли будет зависеть либо от длительности воспалительного процесса в поврежденных тканях, обеспечивающих постоянный приток ноцицептивных сигналов в структуры ЦНС, либо от изначально существующей корково-подкорковой дисфункции в ЦНС, благодаря которой будет поддерживаться центральная сенситизация и ретроградная активация ноцицепторов. На это указывает также и анализ зависимости возникновения длительной боли от возраста. Доказано, что появление в пожилом возрасте хронического болевого синдрома чаще всего обусловлено дегенеративными заболеваниями суставов (ноцицептивные боли), в то время как идиопатические хронические болевые синдромы (фибромиалгия, синдром раздраженной кишки) и невропатические боли редко начинаются в пожилом возрасте [26, 27].
Таким образом, в формировании хронического болевого синдрома определяющим является генетически детерминированная реактивность организма (в первую очередь структур ЦНС), которая является, как правило, чрезмерной, не адекватной повреждению, вследствие чего возникает порочный круг, поддерживающий долго длящуюся гипервозбудимость ноцицептивной системы.