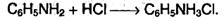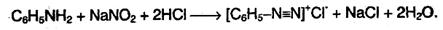Более слабые основания чем анилин
Анилин. Свойства анилина.
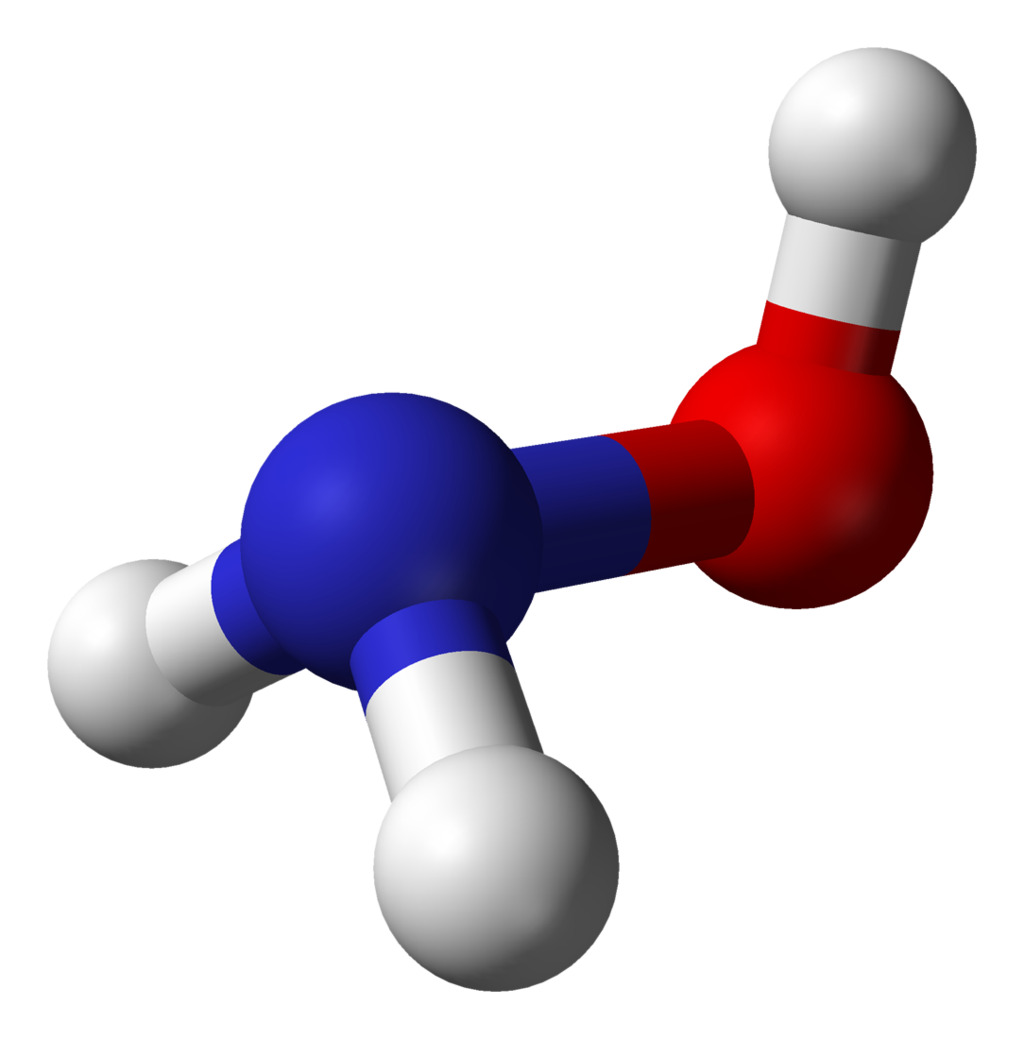
Анилин (фениламин) C5H5NH2 – представитель класса ароматических аминов, в которых аминогруппа связана напрямую с бензольным кольцом.
Строение анилина.
Неподеленная пара атома азота реагирует с π-системой бензольного кольца. Взаимодействие можно представить так:
На атоме азота появляется частично положительный заряд, и основные свойства понижаются. А в бензольном кольце, наоборот, электронная плототность повышается, и наиболее сильно в орто- и пара- положениях:
Физические свойства анилина.
Анилин – бесцветная маслянистая жидкость, немного тяжелее воды, мало растворимы в воде, но хорошо – в этиловом спирте и в бензоле.
Получение анилина.
1. Основным способом получения анилина является процесс восстановления нитробензола. Для этого используют никелевый или медный катализатор при 250-350 °С:
В лаборатории используют восстановления цинка в кислой среде или алюминия в щелочной:
Химические свойства анилина.
Анилин является более слабым основанием, чем алифатические амины, т.к. электронная пара азота частично смещена в бензольное кольцо.
Анилин вступает в реакцию с сильными кислотами, образуя соли фениламмония, которые растворимы в воде, но нерастворимы в неполярных органических растворителях:
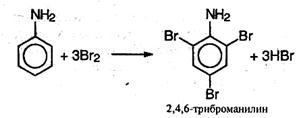
2. Анилин вступает в реакции электрофильного замещения в безольном кольце. Аминогруппа направляет замещение в орто- и пара- положения. Анилин легко бромируется, при этом выпадает белый осадок:
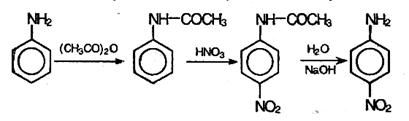
3. С концентрированной азотной кислотой анилин взаимодействует со взрывом. На время реакции можно защитить аминогруппу (превратить ее в амидную перед нитрованием), а после нитрования гидролизовать амид с образованием исходной аминогруппы:
3. При взаимодействии с азотистой кислотой образуются соли диазония:
4. Анилин легко подвергается окислению, темнее при хранении. Если на анилин действовать хлорной известью, то водный раствор анилин окрашивается в интенсивный фиолетовый цвет. Это реакция является качественной.
Применение анилина.
Анилин используют преимущественно для синтеза лекарственных средств и красителей:
13 лучших примеров слабых оснований и их использование
Конъюгированная кислота слабого основания всегда является слабой кислотой, а сопряженное основание слабой кислоты всегда является слабым основанием.
Как определить слабое основание?
Кроме того, слабые основания имеют более низкую константу диссоциации основания (K b). Она аналогична константе диссоциации кислоты и представляет собой относительную силу основания. По мере того как основания становятся слабее, их значения Kb становятся меньше.
В этой статье мы использовали значения pK b для обозначения основности соединения. Это просто отрицательный десятичный логарифм Kb раствора.
Теперь, когда у вас есть общее представление о значениях pH и K b, давайте рассмотрим некоторые из наиболее распространенных примеров слабого основания и их важность.
13. Гидроксиламин
Формула: NH2OH
Основность (pK b): 8.05
Гидроксиламин также является промежуточным продуктом в процессе биологической нитрификации микробами, например, бактериями. В полупроводниковой промышленности он часто используется для удаления фоторезистов после литографии.
Поскольку гидроксиламин представляет опасность возгорания при воздействии сильного тепла, его потенциальное использование должно быть тщательно оценено. Природа взрывоопасности до сих пор недостаточно хорошо изучена.
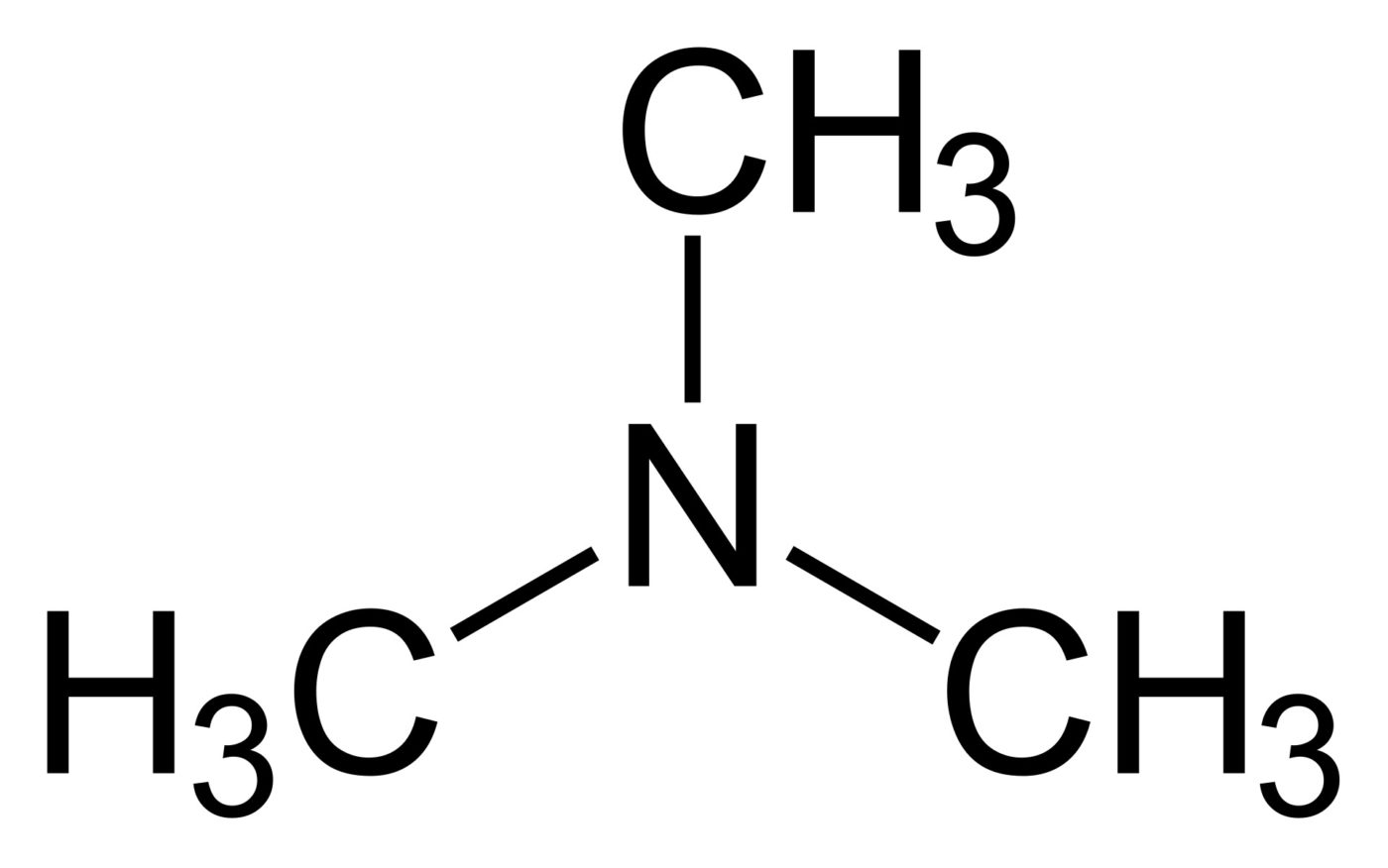
12. Триметиламин
Формула: N(CH3)3
Основность (pK b): 4,20
Триметиламин является газом при комнатной температуре, но хорошо растворяется в воде. Обычно он продается в виде 40% раствора в воде. При более низких концентрациях пахнет гниющей рыбой. При более высоких концентрациях пахнет аммиаком. Кратковременное вдыхание высоких концентраций или длительное вдыхание низких концентраций может вызвать серьезные проблемы со здоровьем.
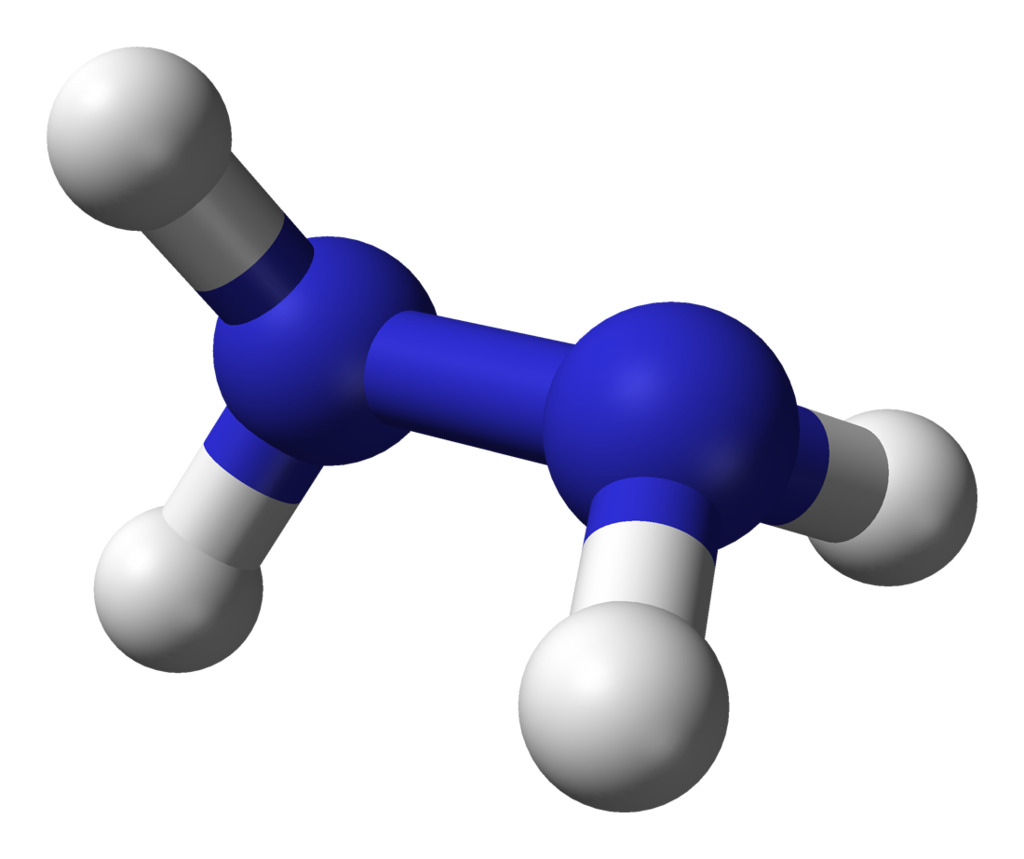
11. Гидразин
Формула: N2H4
Основность (pK b): 8.1
Гидразин представляет собой соединение, содержащее два атома азота с одинарной связью и четыре периферийных атома водорода. Его водный раствор (концентрация более 37%) бесцветен, вызывает коррозию и токсичен при проглатывании и абсорбции через кожу.
Когда гидразин смешивается с водой, он образует более плотный моногидрат (1,032 г/см3), чем безводное вещество.
Как и аммиак, гидразин обладает основными (щелочными) химическими свойствами. Это высокореакционная основа и восстановитель, используемый в широком спектре медицинских и промышленных применений.
Ежегодно во всем мире производится около 100,00 метрических тонн гидразина. В основном он используется как пенообразователь для производства пенопласта.
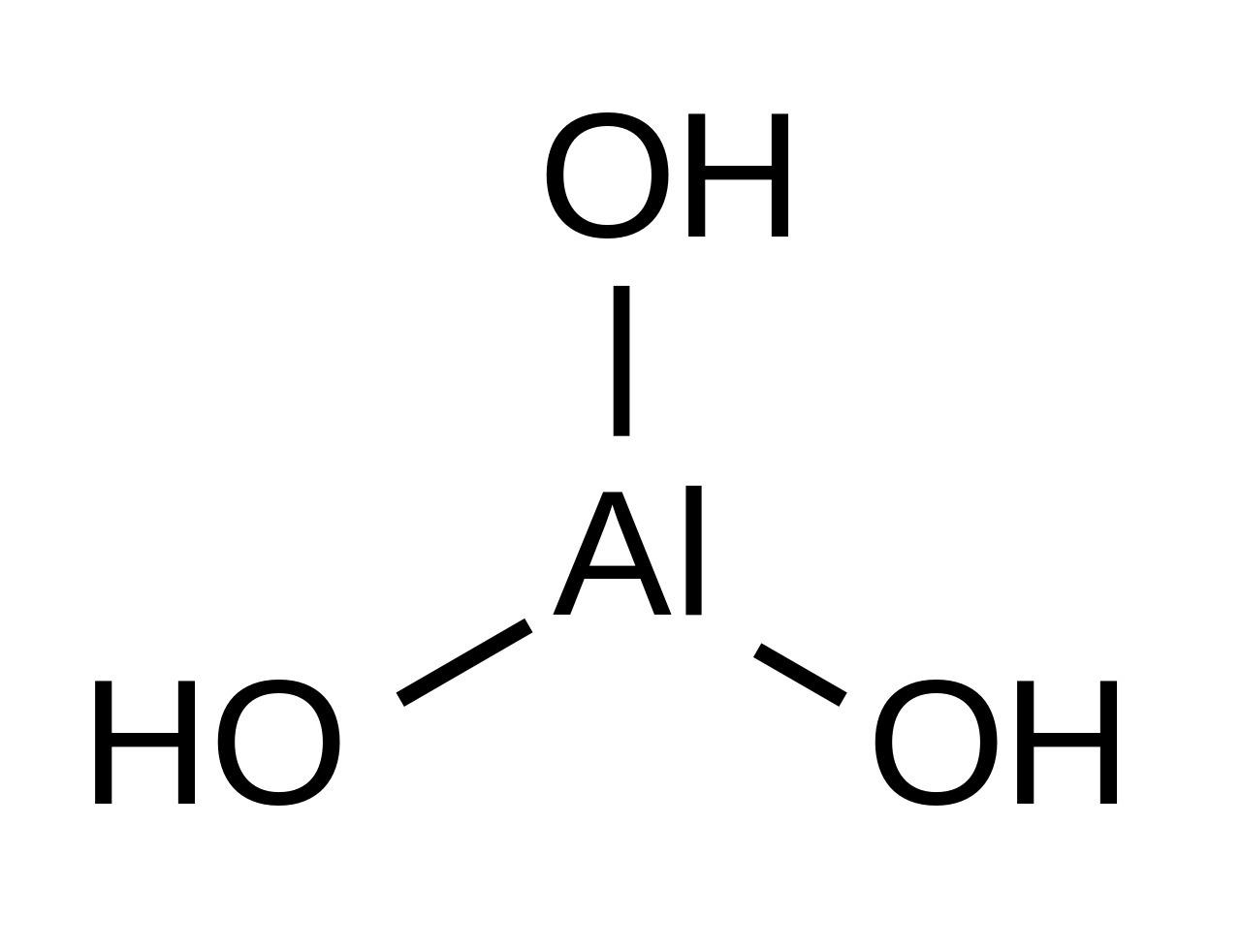
10. Гидроксид алюминия
Формула: Al(OH)3
Основность (pK b): 7,5
В чистом виде гидроксид алюминия представляет собой белые гранулы или порошок плотностью около 2,4 г/мл. Хотя он не растворяется в воде, он быстро растворяется в сильных основаниях и кислотах.
Гидроксид алюминия обладает двумя уникальными свойствами:
Гидроксид алюминия обычно используется в качестве дополнительного ингредиента в антацидных препаратах. Доказано, что он эффективен при лечении изжоги, кислотного расстройства желудка и расстройства желудка. Он также используется в обрабатывающей промышленности и в качестве огнезащитного наполнителя для полимеров.
9. Гидроксид цинка
Формула: Zn(OH)2
Основность (pK b): 8.15
Гидроксид цинка выглядит как белое твердое вещество и имеет плотность 3,05 г / см3. Он встречается в природе в трех редких минералах, а именно ашоверите, сладките и вульфингите. Его также синтезируют в лаборатории путем смешивания раствора гидроксида натрия с раствором любой соли цинка.
Подобно гидроксидам других металлов, таких как хром, олово, бериллий, свинец и алюминий, гидроксид цинка является амфотерным. Это означает, что он может реагировать и как кислота, и как основание. Он легко растворяется в растворе сильного основания (например, гидроксида натрия), а также в растворе сильной кислоты (например, соляной кислоты).
Гидроксид цинка в основном используется в качестве абсорбирующего агента в хирургических повязках. Он также используется в качестве промежуточного продукта при производстве пестицидов и пигментов.
8. Гидрокарбонат натрия
Формула: NaHCO3
Основность (pKb): 3.67
Соединение гидролизуется в воде с образованием катиона натрия и гидроксид-иона. Присутствие гидроксид-ионов делает соединение слегка основным.
Он в основном используется в выпечке как разрыхлитель. При смешивании с водой он действует как антацид, который довольно эффективен при лечении кислотного расстройства желудка и изжоги.
Бикарбонат натрия быстро реагирует с кислотами, образуя углекислый газ. Вот почему он широко используется для нейтрализации разливов кислоты и нежелательных кислотных растворов в химических лабораториях.
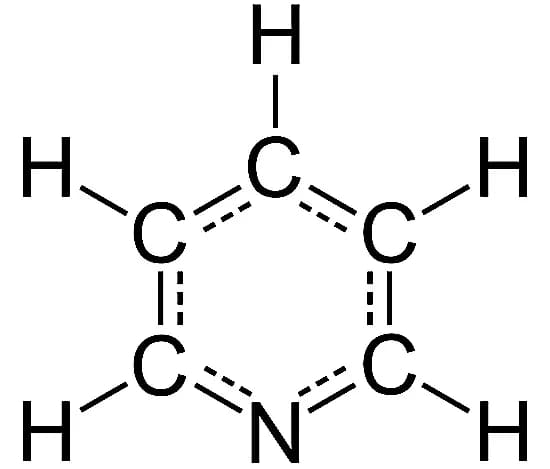
7. Пиридин
Формула: C5H5N
Основность (pKb): 8,75
Структура пиридина очень похожа на структуру бензола, но одна метиновая группа заменена атомом азота. Наличие азота (и его одинокой пары) в бензольном кольце делает пиридин уникальным соединением в химии.
Пиридин является значительно более слабым основанием, чем алкиламины и типичные алифатические третичные амины. Это водорастворимая и легковоспламеняющаяся жидкость с неприятным «рыбоподобным» запахом. Хотя чистый пиридин не имеет цвета, нечистые или старые образцы могут казаться желтыми.
Это основание в основном используется для растворения других соединений и изготовления различных продуктов, включая красители, краски, инсектициды, лекарства, пищевые ароматизаторы, витамины, клеи и резиновые изделия. Оно также содержится во многих природных материалах в окружающей среде.
6. Этиламин
Формула: C2H5NH2
Основность (pKb): 3,35
Равновесие устанавливается между неионизированными молекулами этиламина и двумя ионами, которые образуются в результате его ионизации.
Как и другие первичные амины, этиламин является отличным растворителем для металлического лития. Эти растворы используются для восстановления ненасыщенных органических веществ, таких как алкины и нафталины.
Кроме того, этиламин образует токсичные оксиды азота при сгорании. Обычно его хранят в закрытом контейнере; однако длительное воздействие высоких температур может привести к его резкому разрыву.
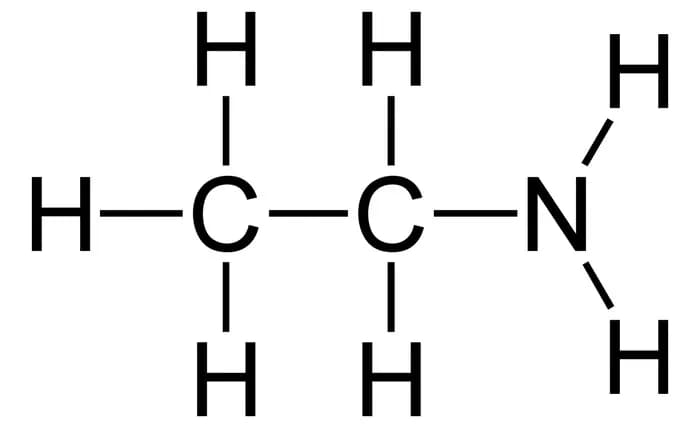
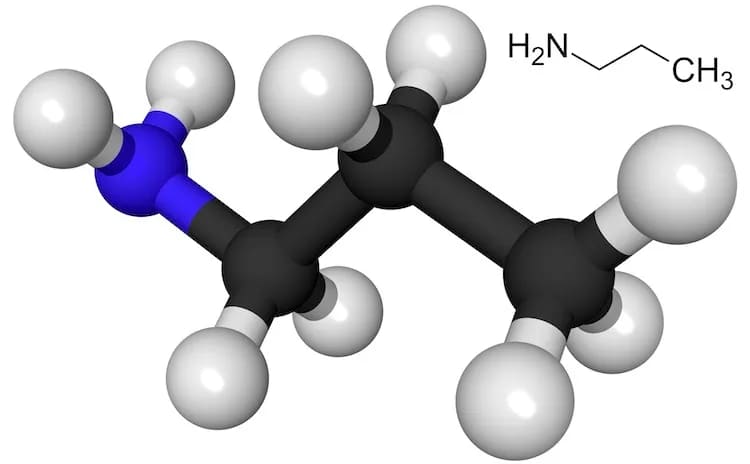
5. Пропиламин
Формула: C3H7NH2
Основность (pKb): 3,45
Пропиламин относится к классу органических соединений, называемых моноалкиламинами. Эти соединения содержат первичную алифатическую аминную группу.
Пропиламин растворим в воде и имеет меньшую плотность, чем вода. Это бесцветная летучая жидкость, а его пары тяжелее воздуха. При сгорании он образует токсичные оксиды азота.
Пропиламин обычно содержится в меньшей концентрации в нескольких различных продуктах питания, таких как зеленый болгарский перец, оранжевый болгарский перец, и в наибольшей концентрации в красном болгарском перце и желтом болгарском перце. Исследователи также обнаружили его в диком сельдерее и обычном винограде.
В лаборатории гидрохлорид пропиламина получают путем смешивания хлорида аммония с 1-пропанолом при высоком давлении и температуре с использованием катализатора кислоты Льюиса, например, хлорида железа.
Пропиламин в основном используется для синтеза и анализа других химических веществ.
4. Гидроксид аммония
Формула: NH4OH
Основность (pKb): 4,75
Хотя гидроксид аммония является соединением природного происхождения, он также производится человеком по ряду причин. Он изготавливается путем растворения аммиака в воде. Полученная жидкость бесцветна и имеет резкий запах.
Раствор содержит значительное количество воды и аммиака и меньшее количество иона аммония и гидроксид-иона. Поскольку гидроксид аммония не полностью диссоциирован на ионы, он является слабым основанием. Его pH колеблется между 7 и 10.
У этого соединения есть несколько применений. Например, в продуктах питания гидроксид аммония используется в концентрации 0,7%, тогда как бытовые чистящие средства производятся с концентрацией 5-10%. Он также используется в обычном качественном неорганическом анализе в качестве комплексообразователя и основания.
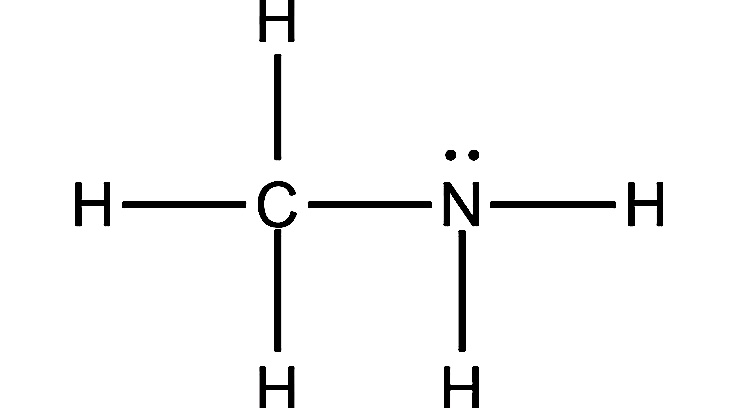
3. Метиламин
Формула: CH3NH2
Основность (pKb): 3,34
Как видно из формулы, основное различие между аммиаком и метиламином заключается в наличии у последнего группы CH3. Поскольку алкильная группа отталкивает электроны от себя, на атоме азота накапливается небольшой отрицательный заряд, что делает его одинокую пару еще более привлекательной для ионов водорода.
А поскольку аммиак не имеет электронодонорной группы, он является более слабым основанием, чем метиламин (в котором азот имеет более отрицательный заряд, поэтому он охотнее принимает H+).
Как и аммиак, метиламин представляет собой бесцветный газ или жидкость с резким запахом. Он может легко загореться. При длительном воздействии высоких температур емкости с метиламином могут разорваться. Поэтому обращаться с ним нужно осторожно.
Метиламин продается в основном в виде раствора в тетрагидрофуране, этаноле, метаноле или в виде безводного газа в контейнерах под давлением. Он широко используется для производства пестицидов, поверхностно-активных веществ, фармацевтических препаратов, растворителей краски и химических веществ для резины.
2. Анилин
Формула: C6H5NH2
Основность (pKb): 9,13
Более конкретно, одинокая пара над атомом азота в группе NH2 находится в сопряжении с электроном Pi бензольного кольца. Поэтому анилин не может легко потерять электронную пару, что делает его слабым основанием.
Он хорошо растворим в спирте и эфире и слабо растворим в воде. При реакции с сильными кислотами он образует ионы анилиния.
Анилин токсичен в природе. Он быстро всасывается в кожу, легкие и желудочно-кишечный тракт подопытных животных. Однако он широко используется для синтеза химических веществ, особенно сельскохозяйственных, фотохимикатов и красителей.
1. Аммиак
Формула: NH3
Основность (pKb): 4,75
Аммиак обладает большой способностью образовывать водородные связи. Когда он растворяется в воде, он получает ионы водорода из воды, образуя ионы аммония и гидроксида.
Эта реакция протекает в обоих направлениях, что означает ее обратимость. В любой момент реакции почти 99% вещества все еще остается в виде молекул аммиака, и только 1% действительно производит гидроксид-ионы. Поскольку лишь небольшая часть аммиака превращается в гидроксид-ионы в растворе, он является слабым основанием.
Амины
Классификация аминов
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.
Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом, у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).
Номенклатура и изомерия аминов
Названия аминов формируются путем добавления суффикса «амин» к названию соответствующего углеводородного радикала: метиламин, этиламин, пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.
Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.
Получение
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.
При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.
Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.
Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.
В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.
В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.
Химические свойства аминов
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет.
В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.
Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.
Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.
При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент «N=C».
Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.
При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химические свойства. 1. Анилин – гораздо более слабое основание, чем алифатические амины (Кb = 5,2-10-10)
2. Анилин весьма активен в реакциях электрофильного замещения в бензольном кольце. Это объясняется электронными эффектами, которые приводят к увеличению электронной плотности в кольце.
Анилин легко бромируетея даже под действием бромной воды, давая белый осадок 2,4,6-триброманилина:
С концентрированной азотной кислотой анилин реагирует со взрывом, поэтому непосредственное нитрование осуществить не удается. Можно, однако, на время реакции защитить аминогруппу, если перед нитрованием превратить ее в амидную группу –NH-CO-СН3 действием уксусного ангидрида (СН3СО)О, а после нитрования гидролизовать амид с образованием исходной аминогруппы. Данная последовательность реакций описывается схемой:
В этих реакциях образуется также небольшое количество орто-нитроанилина.
3. При реакции анилина с азотистой кислотой образуются диазо-соединения – соли диазония C6H5N2 + :
Диазосоединения можно выделить в виде кристаллических, легко взрывающихся веществ. Благодаря способности диазониевой группы легко замещаться на другие функциональные группы, эти соединения широко используются в органических синтезах. Во многих случаях можно не выделять диазосоединения в кристаллическом виде, а использовать их свежеприготовленные растворы.
4. Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении. При действии хлорной извести Са(Сl)ОСl на водный раствор анилина появляется интенсивное фиолетовое окрашивание. Это – качественная реакция на анилин.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
3.7. Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот.
Амины
Амины – производные аммиака, в молекуле которого один, два или все три атома водорода замещены на углеводородные радикалы.
По количеству замещенных атомов водорода амины делят на:
| первичные | вторичные | третичные |
| R-NH2 |
По характеру углеводородных заместителей амины делят на
Общие особенности строения аминов
Также как и в молекуле аммиака, в молекуле любого амина атом азота имеет неподеленную электронную пару, направленную в одну из вершин искаженного тетраэдра:
По этой причине у аминов как и у аммиака существенно выражены основные свойства.
Так, амины аналогично аммиаку обратимо реагируют с водой, образуя слабые основания:
Ароматические амины, в случае если аминогруппа непосредственно соединена с ароматическим ядром, проявляют более слабые основные свойства по сравнению с аммиаком. Связано это с тем, что неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца в следствие чего, электронная плотность на атоме азота снижается. В свою очередь это приводит к снижению основных свойств, в частности способности взаимодействовать с водой. Так, например, анилин реагирует только с сильными кислотами, а с водой практически не реагирует.
Химические свойства предельных аминов
Как уже было сказано, амины обратимо реагируют с водой:
Водные растворы аминов имеют щелочную реакцию среды, вследствие диссоциации образующихся оснований:
Предельные амины реагируют с водой лучше, чем аммиак, ввиду более сильных основных свойств.
Основные свойства предельных аминов увеличиваются в ряду.
Взаимодействие с кислотами
Как свободные предельные амины, так и их водные растворы вступают во взаимодействие с кислотами. При этом образуются соли:
Так как основные свойства предельных аминов сильнее выражены, чем у аммиака, такие амины реагируют даже со слабыми кислотами, например угольной:
Соли аминов представляют собой твердые вещества, хорошо растворимые в воде и плохо в неполярных органических растворителях. Взаимодействие солей аминов с щелочами приводит к высвобождению свободных аминов, аналогично тому как происходит вытеснение аммиака при действии щелочей на соли аммония:
2. Первичные предельные амины реагируют с азотистой кислотой с образованием соответствующих спиртов, азота N2 и воды. Например:
Характерным признаком данной реакции является образование газообразного азота, в связи с чем она является качественной на первичные амины и используется для их различения от вторичных и третичных. Следует отметить, что чаще всего данную реакцию проводят, смешивая амин не с раствором самой азотистой кислоты, а с раствором соли азотистой кислоты (нитрита) и последующим добавлением к этой смеси сильной минеральной кислоты. При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая уже затем реагирует с амином:
Вторичные амины дают в аналогичных условиях маслянистые жидкости, так называемые N-нитрозаминами, но данная реакция в реальных заданиях ЕГЭ по химии не встречается. Третичные амины с азотистой кислотой взаимодействуют также как и с другими кислотами — с образованием соответствующих солей, в данном случае, нитритов.
Полное сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
Взаимодействие с галогеналканами
Примечательно, что абсолютно такая же соль получается при действии хлороводорода на более замещенный амин. В нашем случае, при взаимодействии хлороводорода с диметиламином:
1) Алкилирование аммиака галогеналканами:
В случае недостатка аммиака вместо амина получается его соль:
2) Восстановление металлами (до водорода в ряду активности) в кислой среде:
с последующей обработкой раствора щелочью для высвобождения свободного амина:
3) Реакция аммиака со спиртами при пропускании их смеси через нагретый оксид алюминия. В зависимости от пропорций спирт/амин образуются первичные, вторичные или третичные амины:
Химические свойства анилина
Анилин – тривиальное название аминобензола, имеющего формулу:
Как можно видеть из иллюстрации, в молекуле анилина аминогруппа непосредственно соединена с ароматическим кольцом. У таких аминов, как уже было сказано, основные свойства выражены намного слабее, чем у аммиака. Так, в частности, анилин практически не реагирует с водой и слабыми кислотами типа угольной.
Взаимодействие анилина с кислотами
Анилин реагирует с сильными и средней силы неорганическими кислотами. При этом образуются соли фениламмония:
Взаимодействие анилина с галогенами
Данная реакция является качественной на анилин и часто позволяет определить его среди прочих органических соединений.
Взаимодействие анилина с азотистой кислотой
Анилин реагирует с азотистой кислотой, но в виду специфичности и сложности данной реакции в реальном ЕГЭ по химии она не встречается.
Реакции алкилирования анилина
С помощью последовательного алкилирования анилина по атому азота галогенпроизводными углеводородов можно получать вторичные и третичные амины:
Получение анилина
1. Восстановление маталлами нитробензола в присутствии сильных кислот-неокислителей:
2. Далее полученную соль обрабатывают щелочью для высвобождения анилина:
В качестве металлов могут быть использованы любые металлы, находящиеся до водорода в ряду активности.
Реакция хлорбензола с аммиаком:
Химические свойства аминокислот
Аминокислотами называют соединения в молекулах которых присутствуют два типа функциональных групп – амино (-NH2) и карбокси- (-COOH) группы.
Другими словами, аминокислоты можно рассматривать как производные карбоновых кислот, в молекулах которых один или несколько атомов водорода замещены на аминогруппы.
Таким образом, общую формулу аминокислот можно записать как (NH2)xR(COOH)y, где x и y чаще всего равны единице или двум.
Поскольку в молекулах аминокислот есть и аминогруппа и карбоксильная группа, они проявляют химические свойства схожие как аминов, так и карбоновых кислот.
Кислотные свойства аминокислот
Образование солей с щелочами и карбонатами щелочных металлов
Этерификация аминокислот
Аминокислоты могут вступать в реакцию этерификации со спиртами:
Основные свойства аминокислот
1. Образование солей при взаимодействии с кислотами
2. Взаимодействие с азотистой кислотой
Примечание: взаимодействие с азотистой кислотой протекает так же, как и с первичными аминами
4. Взаимодействие аминокислот друг с другом
Аминокислоты могут реагировать друг с другом образуя пептиды – соединения, содержащие в своих молекулах пептидную связь –C(O)-NH-
При этом, следует отметить, что в случае проведения реакции между двумя разными аминокислотами, без соблюдения некоторых специфических условий синтеза, одновременно протекает образование разных дипептидов. Так, например, вместо реакции глицина с аланином выше, приводящей к глицилананину, может произойти реакция приводящая к аланилглицину:
Кроме того, молекула глицина не обязательно реагирует с молекулой аланина. Протекают также и реакции пептизации между молекулами глицина:
Помимо этого, поскольку молекулы образующихся пептидов как и исходные молекулы аминокислот содержат аминогруппы и карбоксильные группы, сами пептиды могут реагировать с аминокислотами и другими пептидами, благодаря образованию новых пептидных связей.
Отдельные аминокислоты используются для производства синтетических полипептидов или так называемых полиамидных волокон. Так, в частности с помощью поликонденсации 6-аминогексановой (ε-аминокапроновой) кислоты в промышленности синтезируют капрон:
Получаемая в результате этой реакции капроновая смола используется для производства текстильных волокон и пластмасс.
Образование внутренних солей аминокислот в водном растворе
В водных растворах аминокислоты существуют преимущественно в виде внутренних солей — биполярных ионов (цвиттер-ионов):
Получение аминокислот
1) Реакция хлорпроизводных карбоновых кислот с аммиаком:
2) Расщепление (гидролиз) белков под действием растворов сильных минеральных кислот и щелочей.