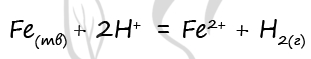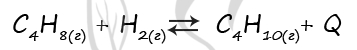Более сильные кислотные свойства чем глицерин
Ответами к заданиям 1—23 является последовательность цифр. Запишите ответ в поле ответа в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Последовательность цифр записывайте без пробелов, запятых и других дополнительных символов. Каждый символ пишите в отдельной клеточке в соответствии с приведенными в бланке образцами.
1. Электронную конфигурацию 1s 2 2s 2 2p 6 3s 2 3p 6 имеют частицы
Ответ:
2. В ряду элементов 
1) число электронных уровней
2) число внешних электронов
4) металлические свойства
Ответ:
3. В бромиде аммония присутствуют химические связи:
2) ковалентные неполярные
3) ковалентные полярные
Ответ:
4. Одинаковую степень окисления углерод проявляет в соединениях
Ответ:
5. Молекулярное строение имеют
Ответ:
6. Выберите формулы трех основных оксидов и запишите соответствующие им номера в ячейки ответа:
Ответ:
7. При комнатной температуре протекает реакция между железом и
1) концентрированной азотной кислотой
2) концентрированной серной кислотой
3) раствором хлорида железа(III)
4) раствором нитрата бария(II)
5) разбавленной соляной кислотой
Ответ:
8. С раствором гидроксида бария реагирует
Ответ:
9. Гидроксид бария реагирует с каждым из двух веществ:
Ответ:
10. Как с хлором, так и с нитратом серебра может реагировать
Ответ:
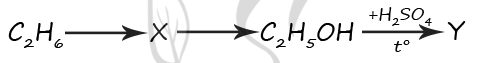
11. В заданной схеме превращений
веществами X и Y являются:
Ответ:
12. Изомером пропанола-2 является
2) метилэтиловый эфир
4) пропановая кислота
Ответ:
13. Толуол реагирует с каждым из двух веществ:
Ответ:
14. Глицерин проявляет более сильные кислотные свойства, чем
3) угольная кислота
Ответ:
15. Как муравьиная, так и масляная кислота реагируют с
Ответ:
16. Этилат калия образуется при взаимодействии
1) этановой кислоты и калия
2) этилового спирта и калия
3) этановой кислоты и оксида калия
4) этилового спирта и хлорида калия
5) этанола и гидроксида калия
Ответ:
17. Глицин реагирует с
1) бромидом аммония
2) углекислым газом
3) муравьиной кислотой
5) гидроксидом калия
Ответ:
18. В заданной схеме превращений
веществами X и Y являются:
Ответ:
19. Из предложенного перечня выберите две характеристики реакции взаимодействия натрия с водой.
Ответ:
20. Из приведенного списка выберите схему реакции, протекающей при обычных условиях наиболее быстро (А) и наиболее медленно (Б).
Ответ:
21. Нитрат-ионы образуются в процессе электролитической диссоциации вещества, формула которого
Ответ:
22. Пожароопасным является каждое из двух веществ:
Ответ:
23. Без участия катализатора в промышленности осуществляют
Ответ:
Ответом к заданиям 24—26 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Затем перенесите это число в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Каждый символ пишите в отдельной клеточке в соответствии с приведенными в бланке образцами. Единицы измерения физических величин писать не нужно.
24. Смешали 120 г 8%-ного раствора сульфата калия и 60 мл воды. Чему равна массовая доля соли в полученном растворе?
Ответ:_________ % (запишите число с точностью до десятых).
25. При горении 11 л этана в кислороде выделится __________ л (н.у.) углекислого газа. (Запишите ответ с точностью до целых.)
26. Вычислите массу сероводорода, образующегося при гидролизе 15 г сульфида алюминия.
Ответ: ________ г (запишите число с точностью до десятых).
В заданиях 27-35 к каждому элементу первого столбца подберите соответствующий элемент из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами. Получившуюся последовательность цифр перенесите в БЛАНК ОТВЕТОВ № 1 без пробелов, запятых и других дополнительных символов. Цифры в ответе могут повторяться..
27. Установите соответствие между названием класса и названием вещества, принадлежащего к этому классу.
А) одноатомные спирты
Б) многоатомные спирты
Ответ:
28. Установите соответствие между схемой реакции и свойством фтора, которое этот элемент проявляет в данной реакции.
1) только окислитель
2) только восстановитель
3) и окислитель, и восстановитель
4) ни окислитель, ни восстановитель
Ответ:
29. Установите соответствие между формулой соли и продуктом, выделяющимся на инертном катоде в ходе электролиза водного раствора этой соли.
3) водород и металл
Ответ:
30. Установите соответствие между формулой соли и отношением ее к гидролизу.
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизуется по катиону и по аниону
4) не гидролизуется
Ответ:
31. Установите соответствие между способом воздействия на равновесную систему
и направлением смещения химического равновесия в результате этого воздействия:
ВОЗДЕЙСТВИЕ НА СИСТЕМУ
А) увеличение концентрации хлора
Б) добавление катализатора
В) уменьшение температуры
Г) увеличение давления
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
Ответ:
32. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может реагировать.
Ответ:
33. Установите соответствие между формулами веществ и реактивом, позволяющим их различить.
Ответ:
34. Установите соответствие между схемой реакции и формулой органического продукта, преимущественно образующегося в ходе реакции.
Ответ:
35. Установите соответствие между схемой реакции и названием органического продукта, преимущественно образующегося в ходе реакции.
Ответ:
Часть 2
Для записи ответов на задания 36-40 используйте БЛАНК ОТВЕТОВ № 2. Запишите сначала номер задания (36, 37 и т.д.), а затем его подробное решение. Ответы записывайте четко и разборчиво.
36. Используя метод электронного баланса, составьте уравнение реакции
Определите окислитель и восстановитель.
37. Над оксидом меди(II) при нагревании пропустили водород. Образовавшееся в результате простое вещество обработали разбавленной азотной кислотой. К полученному раствору добавили раствор сульфида калия, а выпавший осадок растворили в концентрированной азотной кислоте. Напишите уравнения четырех описанных реакций.
38. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
39. Смесь порошков кремния и алюминия обработали избытком соляной кислоты, при этом выделилось 0,224 л газа. Если такую же навеску смеси обработать избытком раствора гидроксида натрия, то выделяется 0,336 л газа. Определите массовую долю кремния в исходной смеси.
40. При сгорании 4,6 г органического вещества образуется 8,8 г углекислого газа и 5,4 г воды. Указанное вещество газообразно при н.у., не реагирует с металлическим натрием и может быть получено дегидратацией спирта. На основании этих данных:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) приведите уравнение реакции его получения из спирта.
Библиотека образовательных материалов для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы из сети Интернет, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
© 2014-2021 Все права на дизайн сайта принадлежат С.Є.А.
Более сильные кислотные свойства чем глицерин
Название вещества (условия)
А) серная кислота (конц.), 180 °С
Б) перманганат калия (подкисленный)
В) оксид цинка, оксид алюминия (425 °С)
Г) серная кислота (конц.), 120 °С
1) только окислитель
2) только восстановитель
3) и окислитель, и восстановитель
4) не проявляет окислительно-восстановительных свойств
1) металл и кислород
2) водород и галоген
3) металл и галоген
4) металл и водород
5) водород и кислород
А) сульфид цезия
Б) нитрат метиламмония
В) сульфат рубидия
Г) стеарат натрия
ОТНОШЕНИЕ К ГИДРОЛИЗУ
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизуется по катиону и аниону
4) гидролизу не подвергается
А) использование катализатора
Б) увеличение концентрации водорода
В) повышение температуры реакции
Г) повышение давления
СМЕЩЕНИЕ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) смещается в сторону прямой реакции
2) смещается в сторону обратной реакции
3) не происходит смещения равновесия
А) поглотительная башня
Б) колонна синтеза
В) ректификационная колонна
1) азот и водород
2) оксид серы(IV) и кислород
3) нефть
4) оксид серы(VI) и концентрированная серная кислота
Ответом к заданиям 27-29 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Единицы измерения физических величин указывать не нужно.
Часть 2
Часть 2 Вы проверяете сами. Все пояснения и подсказки к частям 1 и 2 обязательно будут даны по окончании теста.
Для выполнения заданий 30,31 используйте следующий перечень веществ:
сульфит бария, нитрат калия, медь, диоксид серы, иодат натрия. Допустимо использование водных растворов веществ.
1) Исходя из того, что количество выделенного металла (Me) одинаково на обеих пластинках, сделаем вывод о том, что количества железа и кадмия, участвующих в реакциях, равны:
Отсюда 0,7x = 44,8
x = 64 г/моль
На основании данных в задаче:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте структурную формулу неизвестного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции этерификации этого вещества с помощью метанола, используя структурные формулы веществ.
1) Пусть формула вещества CxHyOz
Вычислим количества вещества углерода, водорода и сделаем проверку на кислород
n(CO2) = 13,2 : 44 = 0,3 моль
n(C) = n(CO2) = 0,3 моль
n(H2O) = 5,4 : 18 = 0,3 моль
n(H) = 2n(H2O) = 0,6 моль
Соотношение атомов составит:
x : y : z = 0,3 : 0,6 : 0,15 = 2 : 4 : 1
Простейшая формула: C2H4O
Молекулярная формула: C4H8O2
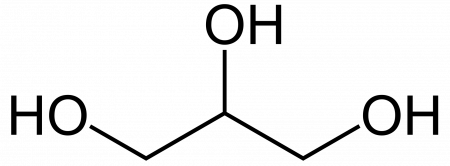
Глицерин
| Глицерин | |||
|---|---|---|---|
| |||
 | |||
| Традиционные названия | глицерин | ||
| Хим. формула | C3H8O3 | ||
| Рац. формула | HOCH2-CH(OH)-CH2OH | ||
| Молярная масса | 92,09 г/моль | ||
| Плотность | 1,261 г/см³ | ||
| Температура | |||
| • плавления | 17,9 °C | ||
| • кипения | 290 °C | ||
| • разложения | 554 ± 1 °F | ||
| • вспышки | 320 ± 1 °F и 160 °C | ||
| Давление пара | 0,003 ± 0,001 мм рт.ст. | ||
| Показатель преломления | 1,4740 | ||
| ГОСТ | ГОСТ 6824-96 ГОСТ 6823-2017 ГОСТ 6259-75 | ||
| Рег. номер CAS | 56-81-5 | ||
| PubChem | 753 | ||
| Рег. номер EINECS | 200-289-5 | ||
| SMILES | |||
| Кодекс Алиментариус | E422 | ||
| RTECS | MA8050000 | ||
| ChEBI | 17754 | ||
| ChemSpider | 733 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Синонимы: глицерóл, пропантриол-1,2,3.
Содержание
Физические свойства
Бесцветная вязкая жидкость без запаха. Сладкий на вкус, отчего и получил своё название (греч. γλυκερός — сладкий). Имеет молярную массу 92,09 г/моль, относительную плотность d4 20 = 1,260, коэффициент преломления nD 20 = 1,4740. Температура плавления составляет 17,9 °C, кипит при 290 °C, частично при этом разлагаясь. Гигроскопичен, поглощает воду из атмосферы в количестве до 40 % от собственной массы. С водой, метанолом, этанолом, ацетоном смешивается в любых пропорциях, но не растворим в эфире и хлороформе, хотя и способен растворяться в их смесях с этанолом.
При растворении глицерина в воде происходит выделение тепла и происходит контракция — уменьшение объёма раствора. Смеси глицерина с водой обладают температурой плавления значительно более низкой, чем каждое из веществ по отдельности, например, при массовом содержании глицерина в 66,7 % его смесь с водой будет замерзать при −46,5 °C.
Образует азеотропы с нафталином, его производными и рядом других веществ.
Химические свойства
Химические свойства глицерина типичны для многоатомных спиртов.
Взаимодействие глицерина с галогеноводородами или галогенидами фосфора ведёт к образованию моно- и дигалогенгидринов.
Глицерин этерифицируется карбоновыми и минеральными кислородосодержащими кислотами с образованием соответствующих сложных эфиров. Так, с азотной кислотой глицерин образует тринитрат — нитроглицерин (получен в 1847 г. Асканио Собреро), использующийся в настоящее время в производстве бездымных порохов.
При дегидратации он образует токсичный акролеин:
Сложные эфиры глицерина и высших карбоновых кислот — жиры являются важными метаболитами, важное биологическое значение играют также фосфолипиды — смешанные глицериды фосфорной и карбоновых кислот.
Получение
Глицерин впервые был получен в 1779 году Карлом Вильгельмом Шееле при омылении жиров в присутствии оксидов свинца. Основную массу глицерина получают как побочный продукт при омылении жиров.
На превращениях аллилхлорида в глицерин через дихлоргидрин или аллиловый спирт основаны другие методы. Известен также метод получения глицерина окислением пропилена в акролеин; при пропускании смеси паров акролеина и изопропилового спирта через смешанный ZnO — MgO катализатор образуется аллиловый спирт. Он при 190—270 °C в водном растворе перекиси водорода превращается в глицерин.
Глицерин можно получить также из продуктов гидролиза крахмала, древесной муки, гидрированием образовавшихся моносахаридов или гликолевым брожением сахаров. Также глицерин получается в качестве побочного продукта при производстве биотоплива.
Производные глицерина и их место в обмене веществ живых организмов
Глицериды
Триглицериды являются производными глицерина и образуются при присоединении к нему высших жирных кислот. Триглицериды являются важными компонентами в процессе обмена веществ в живых организмах.
Жиры и масла гидрофобны и нерастворимы в воде, так как гидроксильные группы глицерина заменены малополярными остатками жирных кислот.
Применение
Область применения глицерина разнообразна: пищевая промышленность, табачное производство, электронные сигареты, медицинская промышленность, производство моющих и косметических средств, сельское хозяйство, текстильная, бумажная и кожевенная отрасли промышленности, производство пластмасс, лакокрасочная промышленность, электротехника и радиотехника (в качестве флюса при пайке).
Глицерин относится к группе стабилизаторов, обладающих свойствами сохранять и увеличивать степень вязкости и консистенции пищевых продуктов. Зарегистрирован как пищевая добавка E422, и используется в качестве эмульгатора, при помощи которого смешиваются различные несмешиваемые смеси.
Поскольку глицерин хорошо поддается желированию и горит без запаха и чада, его используют для изготовления высококачественных прозрачных свечей и основы для жидкости, используемой в дым-машинах.
Также глицерин используется при изготовлении динамита.
В последние годы глицерин используется, наряду с пропиленгликолем, в качестве основного компонента для приготовления жидкости и картриджей для электронных сигарет.
Используется в криобиологии и крионике как основной компонент популярных проникающих криопротекторов для криоконсервирования анатомических препаратов, биологических тканей и организмов.