Блд у детей что это такое
Норильская межрайонная детская больница
Краевое государственное бюджетное учреждение здравоохранения
Синдром бронхиальной обструкции при бронхолегочной дисплазии у детей
Бронхолегочная дисплазия (БЛД) представляет собой приобретенное полиэтиологичное хроническое заболевание морфологически незрелых легких, развивающееся у новорожденных, главным образом глубоко недоношенных детей, нуждающихся в кислородотерапии и искусственной вентиляции легких (ИВЛ).
Медицинская значимость проблемы БЛД обусловлена ростом частоты заболевания во всем мире за счет снижения смертности среди детей с очень и экстремально низкой массой тела при рождении, несмотря на профилактику преждевременных родов, совершенствование технологий выхаживания (антенатальное применение глюкокортикостероидов (ГКС), широкое использование препаратов экзогенного сурфактанта и др.) и методик респираторной терапии (модернизация аппаратов ИВЛ и применение стратегии искусственной вентиляции более подходящей для недоношенных новорожденных).
Помимо этого, высокая летальность пациентов на первом году жизни и ранняя инвалидизация характеризуют и социальную значимость данной проблемы.
В течении заболевания целесообразно выделять:
• стадии — формирования и хронической болезни;
• и формы — «классическая или тяжелая» и «новая или легкая».
В стадии формирования БЛД клиническая картина заболевания повторяет клинику респираторного дистресс-синдрома и в основном складывается из признаков дыхательной недостаточности — ДН (цианоз, тахипноэ, участие вспомогательной мускулатуры в акте дыхания и т. д.), которая чаще всего носит смешанный характер (обструктивный и рестриктивный типы нарушения вентиляции, снижение диффузионной способности альвеолокапиллярного перехода, нарушение вентиляционно-перфузионного отношения, шунтирование) и требует респираторной поддержки — ИВЛ в жестких режимах с высокими фракционными концентрациями кислорода в дыхательной смеси [3].
«Классическая или тяжелая» БЛД характеризуется следующими изменениями морфологии легких: чередованием участков эмфиземы с участками ателектазов и фиброза, некротизирующим бронхиолитом, перибронхиальным фиброзом, гипертрофией гладкой мускулатуры в стенке дыхательных путей и сосудов [1, 3, 4].
Течение заболевания часто осложняется вирусными и бактериальными инфекциями с поражением респираторной системы, манифестирующими обструктивными бронхитами, бронхиолитами, в том числе облитерирующим, пневмонией с бронхообструктивным синдромом (БОС). У некоторых пациентов отмечается длительно персистирующая ДН, требующая базисной терапии ингаляционными ГКС.
Следует отметить, что частота указанных состояний снижается с возрастом и большинство пациентов на первых годах жизни достигает клинической ремиссии [1,
3,4].
Для «новой или легкой» БЛД, прежде всего, характерна задержка альвеологенеза, что приводит к упрощенному строению ацинусов, измененной капиллярной конфигурации и адаптивному дисморфному принципу васкулярного строения, а повреждение дыхательных путей, эмфизема и фиброз выражены минимально либо отсутствуют [3, 4, 8, 9]. Течение данной формы заболевания на первых годах жизни более благоприятное и редко осложняется инфекционным поражением респираторного тракта с развитием БОС [3, 4].
Именно этот факт часто сбивает пульмонолога с толка и заставляет менять степень тяжести БЛД в сторону ее снижения. Однако это не совсем корректно, так как степень тяжести, установленная в первые месяцы жизни согласно критериям классификации 2000 года, не должна подвергаться пересмотру [7].
Необходимо подчеркнуть, что выделяемые формы БЛД отражают лишь патоморфоз заболевания и не должны фигурировать в диагнозе, так как объективно отнести пациента к той или иной из них возможно только после проведения биопсии легкого.
Таким образом, БОС является неотъемлемой составляющей клинического течения заболевания в стадию его формирования, а также в стадию хронической болезни при классической БЛД.
Общеизвестно, что из педиатрической популяции дети грудного и раннего возрастов чаще других развивают БОС и предрасположены к его тяжелому течению ввиду анатомо-физиологических особенностей строения их респираторной системы:
• относительная узость дыхательных путей;
• богатая васкуляризация слизистой, гиперплазия лимфоидной и железистой ткани, ведущая к быстрому развитию отека стенки дыхательных путей и гиперсекреции
мокроты;
• низкая коллатеральная вентиляция (недостаточно развиты поры Кона, отсутствуют
каналы Ламберта), обуславливающая быстрое развитие при БОС воздушных «ловушек» и (или) ателектазов.
Помимо вышеуказанного дети с БЛД также имеют факторы преморбидного фона предрасполагающие их к развитию БОС:
• неспецифическая гиперреактивность бронхов (ГРБ), обусловленная недоношенностью, инфекционным поражением респираторного тракта, необходимостью проведения кислородотерапии и ИВЛ;
• аспирации и гастроэзофагеальный рефлюкс ввиду недоношенности, длительного
зондового кормления, раннего искусственного вскармливания, перинатального поражения центральной нервной системы;
• врожденные пороки сердца с обогащением малого круга кровообращения.
Для более полного и глубокого понимания патогенеза БОС при БЛД необходимо указать механизмы развития бронхиальной обструкции, которые разняться в зависимости от ее обратимости.
К обратимым (спонтанно или при терапевтическом воздействии) механизмам относят:
• отек и инфильтрацию клетками воспаления стенки дыхательных путей;
• гиперсекрецию мокроты, обусловленную гиперплазией железистой ткани, и изменение ее реологических свойств (повышение вязкости) за счет гиперплазии бокаловидных клеток и высокой частоты дыхания, ведущих к снижению эффективности мукоцилиарного клиренса;
• бронхоспазм также является клинически значимым механизмом бронхиальной
обструкции у детей грудного и раннего возрастов с БЛД, учитывая гипертрофию гладкой мускулатуры в стенке дыхательных путей.
Необратимые механизмы представлены:
• деформацией дыхательных путей ввиду перибронхиального пневмофиброза;
• снижением радиальной растягивающей силы, поддерживающей дыхательные пути в
расправленном состоянии за счет разрушения межальвеолярных перегородок при эмфиземе;
• падением давления в просвете воздухопроводящих путей при эмфиземе ввиду
уменьшения эластической отдачи, ведущим к их экспираторному коллапсу.
Реализация любого из вышеперечисленных механизмов приводит к уменьшению радиуса воздухопроводящих путей, а согласно закону Хагена-Пуазейля сопротивление ламинарному потоку воздуха обратно пропорционально радиусу бронха в четвертой степени, а в случае турбулентного потока — в пятой степени.
Следовательно, при уменьшении радиуса бронха в 2 раза сопротивление в случае ламинарного потока возрастет в 16 раз, а в случае турбулентного — в 32 раза.
Компенсаторно для преодоления высокого сопротивления в норме пассивный выдох становится активным за счет подключения вспомогательных мышц выдоха (прямые, поперечные и косые мышцы живота, а также внутренние межреберные), что ведет к повышению внутриплеврального давления, которое, однако, из-за динамической компрессии дыхательных путей (так называемый «резистор Старлинга»), обусловленной снижением силы, радиально растягивающей дыхательные пути и эластической отдачи при эмфиземе, даже в условиях нефорсированного выдоха не приводит к значимому увеличению объемной скорости экпираторного потока [2, 5].
Гиповентиляция альвеолярного пространства при БОС ведет к изменению состава альвеолярного газа (повышение парциального напряжения углекислого газа и реципрокное снижение парциального напряжения кислорода), что согласно рефлексу Эрля-Лильештрадта приводит к артериолоконстрикции и росту давления в системе легочной артерии.
Помимо этого, свойственное БОС повышение внутриальвеолярного давления, за счет сдавления альвеолярных сосудов, также способствует развитию легочной гипертензии и нарушению вентиляционно-перфузионного отношения. В результате возрастает внутрилегочное и внелегочное (персистирующие фетальные коммуникации и ВПС) шунтирование крови, что усугубляет гипоксемию.
Для коррекции закономерно возникающей при выраженном БОС гиповентиляции организм повышает инспираторное усилие (за счет подключения вспомогательных мышц вдоха и интенсификации их работы) с целью увеличения минутного объема дыхания. Что приводит к повышению отрицательного внутриплеврального давления, обуславливающему рост гидростатического давления в сосудах легких и, как следствие, развитие интерстициального отека со снижением диффузионной способности альвеолокапиллярного перехода [2, 5].
Однако, несмотря на прилагаемые усилия, значимо увеличить минутный объем дыхания ребенок грудного и раннего возрастов может только за счет увеличения его частоты, а не объема, ввиду особенностей строения грудной клетки. А запредельный рост частоты дыхания неизбежно отразится снижением дыхательного объема. Учитывая относительно больший по отношению к дыхательному объему объем мертвого пространства у детей данного возраста такой паттерн дыхания приведет к снижению вентиляции респираторных отделов при резко возросшей цене работы дыхания.
Которая, в свою очередь, обуславливает повышение потребления кислорода, наработки углекислого газа и расхода макроэргических соединений, что усугубляет гипоксемию и гиперкарбию, а в случае длительной персистенции ведет к системному гипоэргозу и снижению темпов роста ребенка.
Таким образом, само по себе нарушение вентиляции по обструктивному типу тесно сопряжено с другими механизмами развития ДН, которые нередко взаимообуславливают друг друга.
С целью коррекции гипоксемии и гипоксии пациентам с БЛД показана кислородотерапия для поддержания необходимого уровня аэробного метаболизма Помимо этого, требуется продуманная коррекция водно-электролитного баланса, ввиду увеличения неощутимых потерь жидкости (тахипноэ), длительного приема диуретиков данной категорией пациентов с одной стороны и «напряженной» гемодинамики с другой.
Бронхолитики. М-холинорецепторы полноценно развиты у детей грудного и раннего возрастов, а (Зг-адренорецепторы — недостаточно и, помимо этого, функционально незрелы, что и объясняет рациональность применения в данный возрастной период М-холинолитиков (эффективны и безопасны при длительном использовании благодаря минимальной системной абсорбции и отсутствию тахифилаксии; лишены кардиотоксического действия; значимо снижают ГРБ), или комбинированных препаратов (М-холинолитик + (Зг-агонист).
Проблемы, возникающие при использовании бронхолитиков:
• возможность развития парадоксального усиления бронхоконстрикции ввиду блокады Мг- холинорецепторов;
• вазодилатация, ведущая к усугублению гипоксемии при использовании (Зг-агонистов
вследствие повышения кровотока в отделах легких с низким вентиляционно-перфузионным отношением;
• возрастные ограничения в использовании большинства препаратов, зарегистрированных в Республике Беларусь.
Для длительной бронхолитической терапии возможно использование кленбутерола с рождения ребенка, однако риск развития побочных эффектов значительно превышает таковой для ингаляционных бронхолитиков.
Учитывая значимый вклад в развитие БОС у детей грудного и раннего возрастов таких механизмов, как гиперсекреция и повышение вязкости мокроты детям с БЛД показано назначение муколитических средств:
• амброксола (муколитик, мукорегулятор, мукокинетик, стимулятор синтеза и секреции
сурфактанта), разрешенного к применению с рождения;
• карбоцистеина (муколитик, мукорегулятор, мукокинетик, снижает количество
бокаловидных клеток, способствует регенерации слизистой и восстановлению местной
специфической и неспецифической защиты).
Ацетилцистеин детям с БЛД следует назначать с осторожностью ввиду его способности вызывать бронхоспазм. Системные и ингаляционные ГКС при БЛД показаны с целью коррекции ГРБ, детям с высокой ценой работы дыхания, а также с целью купирования БОС. Предпочтение следует отдать ингаляционным формам, ввиду меньшего риска развития системых побочных эффектов.
Низкие дозы ИГКС могут быть использованы достаточно продолжительно — до шести месяцев непрерывной терапии. При ее проведении рекомендуется использование компрессорного небулайзера или спейсера с подогнанной по размеру маской. Доза препарата за счет его потерь при использовании спейсера может быть увеличена вдвое.
Ее подбор осуществляется индивидуально, необходимо использовать минимально эффективную дозу. Для предотвращения сорбции препаратов в полости носа при использовании маски необходимо зажимать вход в его полость. С целью снижения риска возникновения кандидозного стоматита при использовании ИГКС рекомендуется обработка полости рта до и после ингаляции 2% раствором соды.
Будесонид. Характеризуется высокой местной противовоспалительной активностью. Системная биодоступность будесонида при проглатывании (11-13%), при ингаляции (26-38%), эффект первого прохождения через печень составляет 90%. Препарат выпускается в виде суспензии для ингаляций 0,25 и 0,5 мг/мл (0.25-0.5-1,0 мг в сутки за 2-3 ингаляции), а также в форме ДАИ по 50, 100, 200 мкг/доза (50-200 мкг/ингаляцию 1-2 раза в сутки).
Проблемы: в Республике Беларусь будесонид не зарегистрирован в форме суспензии для ингаляций.
Флутиказона пропионат. Характеризуется высокой местной противовоспалительной активностью не уступающей будесониду. Системная биодоступность при проглатывании — около 1%, при ингаляции — 16-30%, эффект первого прохождения через печень составляет 99%. Выпускается в форме ДАИ по 50, 125, 250 мкг/доза.
Назначают по 50-250 мкг/ингаляцию 1-2 раза в сутки. Возможной альтернативой использования системных и ингаляционных ГКС с противовоспалительной целью, при минимальной тяжести состояния пациента, может служить фенспирид, разрешенный к применению в педиатрической практике с рождения, однако длительность его приема ограничена 30 сутками, а дети с БЛД нередко нуждаются в более продолжительном лечении.
Таким образом, в настоящее время выбор средств для коррекции ГРБ и БОС при БЛД на первом году жизни пациента, то есть в период, когда это наиболее необходимо, ограничен. Помимо этого, в Республике Беларусь отсутствуют в продаже спейсеры с характеристиками (система клапанов вдоха и выдоха, универсальное отверстие для ДАИ), способствующими их эффективному применению у детей грудного и раннего возрастов.
На наш взгляд, сложившаяся ситуация требует незамедлительной разработки путей ее решения.
1. Войтович, Т. Н. Бронхолегочная дисплазия в стадии хронической болезни (биологическая характеристика) / Т. Н. Войтович, С. Н. Козарезов, Т. В. Матвеева // Мед. панорама. 2008. № 13. С. 26-29.
2. Гриппы, М. А. Патофизиология легких / М. А. Гриппи. М.; СПб.: Издательство Бином, 2001. 318 с.
3. Козарезов, С. Н. Бронхолегочная дисплазия в стадии хронической болезни : учеб.- метод. пособие / С. Н. Козарезов, Т. Н. Войтович. Минск: БГМУ, 2009. 32 с.
4. Козарезов, С. Н. Современные представления о бронхолегочной дисплазии у детей (обзор литературы, часть I) / С. Н. Козарезов // Мед. журнал. 2007. № 3. С. 13-16.
5. Патофизиология органов дыхания / пер. с англ. под ред. А. И. Синопальникова. М.: Бином, 2008. 232 с.
6. Greenough, A. Long-term pulmonary outcome in the preterm infant / A. Greenough // Neonatology. 2008. Vol. 93, № 4. P. 324-327.
7. Jobe, A. H. Bronchopulmonary dysplasia / A. H. Jobe, E. Bancalari // Am. J. Respir. Crit. Care Med. 2001. Vol. 163. P. 1723-1729.
8. Peterson, S. W. Understanding the sequence of pulmonary injury in the extremely low birth weight, surfactant-deficient infant / S. W. Peterson // Neonatal Netw. 2009. Vol. 28, № 4. P. 221- 229.
9. Thebaud, B. Bronchopulmonary dysplasia: where have all the vessels gone? Roles of angiogenic growth factors in chronic lung disease / B. Thebaud, S. H. Abman//Am. J. Respir. Crit. Care Med. 2007. Vol. 175, № 10. P. 978-985.
Блд у детей что это такое

Поиск
Современные подходы к диагностике и лечению бронхолегочной дисплазии
Статья содержит обзор данных литературы по этиологии, патогенезу и диагностике бронхолегочной дисплазии у новорожденных. Приводятся доказательные методы лечения данного заболевания с позиции современной медицины.
Current approaches to diagnosis and treatment of bronchopulmonary dysplasia
This article contains a review of the literature on the etiology, pathogenesis and diagnosis of bronchopulmonary dysplasia in infants. Conclusive methods treatment of this disease from the position of modern medicine are provided.
Бронхолегочная дисплазия (БЛД) — это полиэтиологическое хроническое заболевание морфологически незрелых легких, развивающееся у новорожденных, главным образом глубоконедоношенных детей, в результате интенсивной терапии респираторного дистресс-синдрома (РДС) и/или пневмонии. Протекает это заболевание с преимущественным поражением бронхиол и паренхимы легких, развитием эмфиземы, фиброза и/или нарушением репликации альвеол [2, 3]. Проявляется БЛД зависимостью от кислорода в возрасте 28 суток жизни и старше, бронхообструктивным синдромом и симптомами дыхательной недостаточности; для него характерны специфические рентгенологические изменения в первые месяцы жизни и регресс клинических проявлений по мере роста ребенка.
Частота БЛД обратно пропорциональна гестационному возрасту и массе тела при рождении. Так, у детей с весом при рождении 501-750 г, по результатам различных исследований, БЛД отмечается в 35-67%, а у детей с массой тела 1251-1500 г при рождении — в 1-3,6% случаев [1].
Первоначально БЛД рассматривалась как результат повреждающего действия кислорода и ИВЛ на легкие новорожденного, что нашло отражение в классической формуле A. Philip (1975): «кислород+давление+время». В настоящее время БЛД рассматривается как полиэтиологическое заболевание [3, 5]. Факторами, способствующими развитию БЛД, являются:
Клиника, принципы терапии и исходы бронхолегочной дисплазии
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
НИИ пульмонологии С.-Пб. ГМУ им. акад. И.П.Павлова, Детская областная клиническая больница, Санкт-Петербург
Б ронхолегочная дисплазия (БЛД) – заболевание легких, развивающееся преимущественно у недоношенных детей в периоде новорожденности, после острого эпизода дыхательных расстройств, требующих искусственной вентиляции легких (ИВЛ). БЛД формируется в результате воздействия многих факторов, среди которых наибольшее значение придается незрелости легких и ИВЛ с жесткими параметрами. Сочетанное действие высокой концентрации кислорода и положительного давления на выдохе, а также баротравма при длительной механической вентиляции играют основную роль в развитии болезни. Диагностическими критериями БЛД в периоде новорожденности являются сохраняющиеся респираторные симптомы, ИВЛ не менее 3 суток, потребность в кислородотерапии не менее 28 дней.
Морфологическое исследование при БЛД выявляет хронический бронхиолит с утолщением стенки и сужением просвета за счет перибронхиолярного склероза, гипертрофию гладкой мускулатуры мелких бронхов и бронхиол, деструкцию межальвеолярных перегородок и эмфизематозную перестройку легочной паренхимы.
В период с 1992 по 2000 г.г. с диагнозом БЛД наблюдались 96 детей в возрасте от 1 месяца до 7 лет. Дети рождались в тяжелом и крайне тяжелом состоянии с признаками дистресс-синдрома новорожденных, что требовало применения ИВЛ длительностью от нескольких дней до нескольких месяцев. В периоде новорожденности отмечались тахипноэ, цианоз, кислородозависимость в течение 28 дней и более, стойкие физикальные изменения в легких (ослабление дыхания, затруднение выдоха, сухие свистящие хрипы, влажные мелкопузырчатые хрипы и крепитация). В раннем периоде у детей на рентгенограммах определялись признаки болезни гиалиновых мембран («воздушная» бронхограмма, ателектазы и дистелектазы на фоне интерстициального отека), симптомы утечки воздуха (интерстициальная эмфизема, пневмомедиастинум, пневмоторакс).
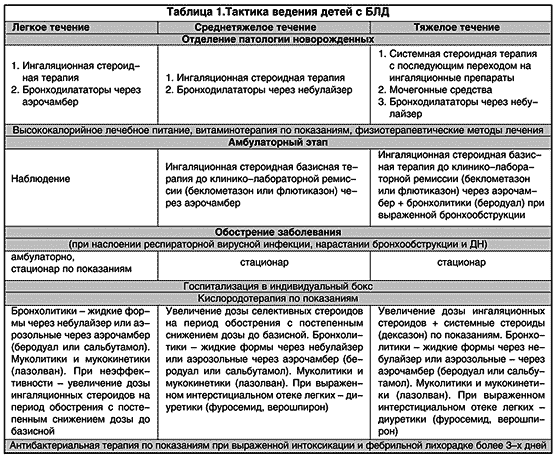
Наблюдение за детьми позволило выявить легкое, тяжелое и среднетяжелое течение болезни. Легкое течение характеризовалось отсутствием тахипноэ в покое и аускультативных изменений в легких, которые обычно появлялись при присоединении вирусной инфекции. Не отмечалось отставания в физическом развитии и признаков легочного сердца. Рентгенологическое исследование грудной клетки выявляло умеренные признаки вздутия. При среднетяжелом течении тахипноэ появлялось при физической нагрузке (плач, беспокойство, кормление), симптомы обструкции были выражены умеренно и нарастали при вирусной инфекции. Инструментальное исследование у части больных обнаруживало признаки легочного сердца. При рентгенографии грудной клетки отмечались вздутие легочной ткани, участки локального пневмосклероза, у отдельных больных – кардиомегалия. Дети с тяжелым течением БЛД имели тахипноэ в покое, усиливающееся при физической нагрузке и вирусной инфекции. Больные значительно отставали в физическом развитии, имелись выраженные аускультативные симптомы обструкции. Эхокардиография выявляла признаки легочного сердца (легочную гипертензию, дилатацию и гипертрофию правого желудочка). При рентгенологическом исследовании наблюдалось значительное вздутие, буллы, множественные участки пневмосклероза, гиповентиляции, перибронхиальные изменения, кардиомегалия, выбухание ствола легочной артерии.
Обычно течение БЛД волнообразное. При наслоении респираторной вирусной инфекции значительно нарастала дыхательная недостаточность, и в ряде случаев требовалась интенсивная терапия или даже реанимационное пособие.
Характер воспаления слизистой дыхательных путей изучали с помощью цитоморфологического исследования бронхиальных смывов. Воспалительные изменения слизистой бронхов характеризовались повышением числа нейтрофилов и лимфоцитов, выявлением пластов дедифференцированного метаплазированного эпителия, что свидетельствовало о длительно сохраняющемся повреждении эпителиального слоя слизистой оболочки бронхов. Выраженность этих изменений коррелировала с тяжестью течения заболевания.
Лечение БЛД включало проведение оксигенотерапии для поддержания сатурации кислорода в пределах 94–96%, назначение стероидных препаратов с целью ликвидации воспалительных изменений в слизистой оболочке дыхательных путей и бронхолитических препаратов, а также витаминов А и Е. В ряде случаев возникала необходимость в применении мочегонных средств. Успех лечения больных зависит также от адекватного энергетического обеспечения, которое достигалось увеличением калорийности пищи в 1,5–2 раза и дотацией белка до 3–3,5 г на 1 кг веса ребенка.
Клинические симптомы бронхиальной обструкции, обусловленные гиперреактивностью и воспалительными изменениями слизистой оболочки, диктуют необходимость назначения стероидных препаратов. При БЛД предпочтение отдавалось ингаляционным стероидам в виде дозированных аэрозолей или жидких форм, которые доставлялись в дыхательные пути при помощи специального спейсера с маской (аэрочамбер или бебихалер) или небулайзера. Начинали с низких доз, которые повышали до минимально эффективной, терапию продолжали до стойкого клинического и рентгенологического улучшения (от 1 месяца до 2,5 лет). Ухудшение состояния требовало удвоения дозы на 2–3 недели. При достижении клинико–лабораторной ремиссии базисную терапию ингаляционными стероидами постепенно отменяли.
Ингаляционные бронходилататоры высокооэффективны при БЛД, что определяется гипертрофией гладкой мускулатуры бронхов, отмечаемой при морфологических исследованиях. Использовались адреномиметики (сальбутамол) и холинолитики (атровент), а также комбинированные формы (беродуал) в виде дозированных ингаляторов через спейсер или жидких форм через небулайзер, в возрастных дозировках сроком от 10 дней до 3 месяцев, обычно совместно с ингаляционными стероидами.
Важным моментом для благоприятного исхода болезни является сотрудничество врача и родителей больного, которые должны знать, что следует делать регулярно, а что – во время ухудшения состояния при наслоении респираторной инфекции. Кроме того, необходимо постоянное мониторирование состояния больного ребенка с целью коррекции лечебных мероприятий (родители должны вести дневник состояния ребенка, отмечать частоту дыхания и частоту сердечных сокращений во сне, а также до и после приема лекарств).
Исходя из того, что наиболее тяжелое состояние у больных с БЛД отмечается на фоне вирусной инфекции, родителям рекомендовалось соблюдение строгого охранительного режима для ребенка; при угрозе инфицирования с профилактической целью назначался интерферон интраназально. Если инфицирования избежать не удавалось, то дозировка базисных препаратов (ингаляционных стероидов) и симптоматических средств изменялась с учетом индивидуальных особенностей ребенка и характера заболевания. При длительном обострении (более 7 дней) с фебрильной температурой более 3 дней, нарастающими катаральными симптомами и дыхательной недостаточностью проводилась антибактериальная терапия коротким курсом (7–10 дней) с учетом выделенной микрофлоры. Тактика ведения больных с БЛД на разных этапах наблюдения и при разной степени тяжести представлена в табл. 1.
Длительное динамическое наблюдение (в течение 2–5 лет) 83 больных БЛД позволило уточнить прогноз этого состояния в раннем детском возрасте. Стратегия этапного наблюдения и противовоспалительная терапия использовались у 76 детей из 83. Дети со среднетяжелой формой болезни (51 ребенок), получавшие противовоспалительную терапию, не нуждались в госпитализации по поводу обострений заболевания (до назначения терапии требовалась госпитализация 2–3 раза в месяц), и к 3 годам у них удалось добиться клинического выздоровления. Однако при этом сохранялись рентгенологические изменения в виде умеренного вздутия и интерстициальной реакции. Дети, имеющие тяжелую форму болезни (25 больных), также получали противовоспалительную терапию, однако клинического выздоровления удалось добиться у 18 больных (73%), 5 детей (23%) умерли в течение первых 1,5 лет жизни, у 1 ребенка (4%) сформировался хронический бронхиолит. Часть больных с БЛД (7 детей из 83) не получали базисную терапию, так как наблюдались в различных лечебных учреждениях с ошибочным диагнозом «рецидивирующая пневмония с обструктивным синдромом». Из них 1 ребенок умер (14%), а у 6 больных (84%) сформировалась тяжелая форма хронического бронхиолита, что послужило основанием для назначения инвалидности.