Биопсия эмбрионов что это
Биопсия эмбрионов и её влияние на раннее развитие ребенка
Процедуры скрининга и предимплантационной генетической диагностики не оказывают отрицательного влияния на развитие младенца, а также не являются причиной увеличения риска пороков развития.
Такие результаты были получены в ходе наблюдения за 70-ти детьми, которые появились на свет в результате одноплодной беременности. Руководил исследованиями профессор Maryse Bonduelle, по его мнению, эта информация очень важна как для врачей, так и для самих родителей.
Предимплантационная генетическая диагностика (ПГД) представляет собой инвазивную процедуру, которая заключается в том, что ещё до имплантации эмбриона в процессе ЭКО осуществляется биопсия бластомера. По клеткам эмбриона специалисты могут определить наличие таких генетических патологий, как мышечная дистрофия Дюшена или муковисцидоз. Здоровые эмбрионы затем переносят в полость матки. О том, как влияет биопсия эмбрионов на развитие плода, известно пока мало.
Профессор Maryse Bonduelle совместно с коллегами решил восполнить этот пробел, сравнив данные о 70-ти детях, которые появились на свет после ПГД, с аналогичным количеством малышей, которые были рождены в результате ИКСИ и зачатых естественным путём.
В ходе наблюдений учёные не выявили существенных отличий показателей роста, массы тела, окружности головы при рождении детей, и затем в возрасте 2-х лет. В первой группе дети чаще появлялись на свет в результате кесарева сечения, однако риск развития врождённых пороков был на том же уровне, как при естественном зачатии и ИКСИ.
Малыши, рождённые после ПГД, в детские сады ходили реже, скорее всего, их питание было более полноценным, за счёт чего показатели индексы массы тела у них были лучше.
Что же касается частоты осложнений, возникающих в ходе беременности, то этот показатель в двух первых группах был выше. На это влияют не только сами вспомогательные репродуктивные технологии, но и более старший возраст мам и пап. Родители малышей, зачатых естественным путём, отличались молодым возрастом, что положительно влияло и на исход беременности. Умственное, социально-эмоциональное и речевое развитие детей было одинаковым во всех трёх группах.
Учёные продолжают наблюдать за детьми, которые появились на свет после ПГД, поскольку существующий объем выборки не позволяет сделать объективное заключение. В группе ПГД у двух малышей были выявлены тяжёлые пороки развития, в группе естественного зачатия таких детей также оказалось двое (двусторонний крипторхизм и транспозиция магистральных сосудов), а в группе ИКСИ – один (врождённая паховая грыжа).
Учёные умышленно не принимали в расчёт рождение близнецов, поскольку в процессе многоплодной беременности очень часто возникают различные осложнения. Исследования таких детей должны проводиться отдельно.
Современные технологии биопсии эмбрионов и безопасность вспомогательных репродуктивных технологий (ВРТ).
С 1978 по 2014 год в мире родилось более 5 млн. детей «из пробирки». Ежегодно рождается около 300 тыс. детей с применением ВРТ.
У 0.5% всех новорожденных в мире выявляются хромосомные аномалии, которые так же являются одной из наиболее частых причин прерывания беременности, врожденных дефектов развития и умственной отсталости. Поэтому одной из важнейших задач современной репродуктивной медицины является повышение эффективности и безопасности методов ВРТ и развитие молекулярно-генетических методов преимплантационного анализа эмбрионов с целью рождения здорового ребенка.
Преимплантационная генетическая диагностика (ПГД) позволяет провести анализ одной или нескольких клеток эмбриона и определить риски генетических заболеваний (изменение числа, структуры хромосом, моногенные заболевания, заболевания, сцепленные с полом, резус-конфликт) у будущего ребенка до наступления беременности в рамках программы ЭКО/ИКСИ.
ПГД эмбрионов проводится на 3 или 5-6 сутки их преимплантационного развития. Для проведения диагностики необходима микрохирургическая операция – биопсия эмбриона. Это один из самых критических этапов в циклах ЭКО. В процессе биопсии бластоцисты производится забор нескольких клеток трофэктодермы для генетического анализа. Проведение биопсии связано с риском повреждения эмбриона и производится только опытными высококвалифицированными специалистами. Механическое воздействие микрохирургических инструментов на клетку может отрицательно сказаться на дальнейшем развитии и имплантации эмбриона. Поэтому современные методики биопсии трофэктодермы становятся все более атравматичными и максимально бесконтактными.
Система лазерной микрохирургии позволяет минимизировать механические воздействия на эмбрион и производить максимально быстрые, безопасные и эффективные лазерные процедуры с клетками и эмбрионами,
Преимущества лазерной биопсии:
С момента открытия отделения ЭКО в Перинатальном медицинском центре в 2008г. бипсия преимплантационных эмбрионов выполнялась с использованием лазерной системы Saturn 3 Active (Reseach Instrument, Великобритания). С 2014г. в лаборатории эмбриологии используется новейшая лазерная модель этой же фирмы-система Saturn 5 Active, обладающая целым рядом преимуществ. Режим биопсии The Saturn 5TM Biopsy Mode позволяет производить процедуру биопсии эмбриона бережно и быстро, забирая необходимое количество клеток для анализа. Во время лазерной биопсии трофэктодермы механическое воздействие на эмбрион, риски повреждения эмбриона значительно снижаются. Так же упрощается, а, следовательно, сокращается во времени сама процедура биопсии трофэктодермы. Таким образом биопсия трофэктодермы становится эффективной и относительно малотравматичной методикой получения генетического материала эмбриона и дает наиболее полную и достоверную информацию о генетическом статусе эмбриона.
Алгоритм наиболее перспективных и безопасных подходов в лечении бесплодия в настоящее время включает следующие лабораторные этапы:
Предимплантационная диагностика
Содержание
ЭКО является не только высокоэффективным методом лечения бесплодия, но и вспомогательным методом диагностики многих наследственных заболеваний до наступления беременности.
ПГД — это проверка эмбриона, полученного с использованием экстракорпорального оплодотворения (ЭКО) на наличие генетических аномалий до его имплантации в полость матки. В этом случае возможно отобрать здоровые эмбрионы еще до стадии переноса.
Настоящая технология применяется почти 30 лет, и с каждым годом ее востребованность растет вместе с увеличением количества женщин, желающих родить после 35 лет. Манипуляция выполняется только при ЭКО, не предоставляет угрозы для женщины и не влияет на будущую беременность. Во время естественного зачатия провести такое исследование невозможно, но как альтернативный метод проводят пренатальную диагностику.
Процедуру проводят не всем, только, когда известно, что родители либо болеют, либо носители моногенного заболевания. Таким образом, можно определить, унаследует ли ребенок хромосомные патологии от родителей или нет. У пар, страдающих бесплодием, проводят не тестирование, а скрининг, поэтому потребность в таком исследовании небольшая.
Обследование выполняется для исключения мутаций или несбалансированной хромосомной перестройки. Перенос недиагностированных бластоцист не проводится.
В настоящее время известно более 40 моногенных генетических заболеваний. Самые распространенные:
Типы ПГД
ПГС – преимплантационный генетический скрининг.
ПГТ – преимплантационное генетическое тестирование – то же самое, что и диагностика. Под диагностикой понимают анализ методом FISH по определенному числу хромосом, а под тестированием – методом CGH/NGS с диагностикой всех хромосомных пар.
Несколько типов ПГТ исследований:
ПГТ-А – анализ анеуплоидий выявляет лишние или недостающие хромосомы в клеточном ядре, то есть направлен на выбор бластоцист с нормальным количеством хромосом. Он позволяет быстрее получить желаемую беременность (повышает шансы до 70-75%) и избежать переноса анеуплоидов, например, с синдромом Дауна.
ПГТ-М – тестирование на наличие наследственных болезней. Диагностика проводится только на выявление конкретной патологии, поэтому необходима дополнительная диагностика родителей для уточнения, в каком участке гена могла произойти мутация. Данный тип исследования гарантирует отсутствие конкретного дефекта, но не дает гарантии на отсутствие других нарушений в геноме.
ПГТ – SR – тестирование на наличие специфических перестроек в их ДНК, которые так же могут приводить к разным заболеваниям и передаваться по наследству.
Показания к проведению
Преимплантационное обследование рекомендуется парам с рисками передачи известных хромосомных аномалий своим детям. Наличие показаний для осуществления ПГД первоначально определяет репродуктолог, а решение о целесообразности такого исследования принимает врач-генетик. Оно может быть проведено в протоколе экстракорпорального оплодотворения за свой счет. Противопоказаний к проведению нет.
Примерами распространенных заболеваний могут служить:
Делать ли ПГД?
Преимплантационное тестирование может потребоваться в следующих случаях:
По желанию пар можно сделать ПГД эмбриона на:
Супружеские пары, которые не могут забеременеть естественным путем, получают консультацию генетика. Специалист при необходимости назначает анализы с целью определения кариотипа и дает индивидуальные рекомендации относительно необходимости проведения ПГД перед переносом.
ПГД эмбриона цена
Биопсия
Криоконсервация, витрификация, хранение
Генетика
Техника проведения манипуляции
Предимплантационное обследование рекомендуется парам с рисками передачи известных хромосомных аномалий своим детям. Наличие показаний для осуществления ПГД первоначально определяет репродуктолог, а решение о целесообразности такого исследования принимает врач-генетик. Оно может быть проведено в протоколе экстракорпорального оплодотворения за свой счет. Противопоказаний к проведению нет.
С чего начинается ПГД?
Подготовка к лечебному циклу ЭКО с ПГД практически не отличается от обычного лечебного цикла ЭКО:
Сопутствующие риски и результаты исследования зависят от навыков и квалификации эмбриолога, проводящего биопсию. Такая процедура относится к высокотехнологичным и дорогим исследованиям. Поэтому предпочтительно сразу обращаться в крупные специализированные центры с возможностью проведения цитогенетического тестирования.
Результаты
По прошествии двух суток специалисты оценивают результаты и сопоставляют их с развитием соответствующего зародыша.
Если у него обнаружены отклонения, это означает обязательный отказ от переноса. В полость матки переносятся только те эмбрионы, у которых не было обнаружено патологий. Если исследование проводилось с цель рождения ребенка определенного пола (только по показаниям) или для предотвращения резус-конфликта, то подсаживаются соответствующие эмбрионы.
Схема ПГД применяется для конкретного случая своя. Если нарушение наследуется от женщины, то можно тестировать только полярные тельца. Можно также тестировать только бластомеры. Либо может проводиться последовательное изучение полярных телец, затем бластоцист. Какая именно схема будет применяться, определяется на консультации с врачом-генетиком.
Трофэктодерма: что это такое
В настоящее время предпочитают проводить биопсию трофэктодермы, а не забирать образцы еще не дифференцированной эмбриональной ткани. Такой подход позволяет увеличить жизнеспособность зародышей и минимизировать вред от манипуляции PGD.
Развитие эмбриона происходит по определенным закономерностям. После оплодотворения образуется зигота, которая начинает активно делиться, и количество зародышевых клеток растет в геометрической прогрессии. Продолжительность этого этапа до 3–4 суток. Затем происходит разделение клеток на 2 порции: наружную и внутреннюю. В толще эмбриональной клеточной массы формируется эксцентричная внутренняя полость – бластоцель, а достигшие этого этапа называются бластомерами. Трофэктодерма – наружный слой бластомера. Она является предшественником внезародышевых тканей, необходимых для нормальной имплантации эмбриона и последующего формирования плаценты. А внутренняя клеточная масса бластомера дает начало самому зародышу.
Внешний и внутренний листки бластоцисты имеют практически идентичный генный и хромосомный состав, поэтому информативность анализа трофэктодермы такая же высокая, как и при исследовании на более ранних этапах развития зародыша.
На какой день выполняют диагностику
На этапе подготовке к ЭКО у пар часто возникают вопросы: сколько делается ПГД и когда следует эмбриоперенос. Во многих клиниках, преимплантационная генетическая диагностика эмбрионов выполняется на 3 сутки. После оплодотворения яйцеклеток сперматозоидами в условиях эмбриологической лаборатории эмбрион развивается — клетки делятся. На третий день количество клеток достигает 6-8, что позволяет провести генетический анализ эмбриона без ущерба для дальнейшего развития зародыша.
В этот день происходит биопсия, то есть извлечение одного бластомера с помощью специальных микроинструментов. При стандартном протоколе без криоконсервации исследование выполняется за короткое время, так как эмбрион не может продолжать развиваться вне организма матери далее стадии бластоцисты (5-е сутки после оплодотворения). Пока выполняется генетическая диагностика, эмбрионы продолжают развиваться в соответствующей культуральной среде, после чего переносятся в полость матки на 5-е сутки развития. К этому времени эмбрион достигает стадии бластоцисты. Альтернативный подход – анализ ПГД в криоцикле. В этом случае биопсия производится на 5 день развития, а затем они подвергаются криоконсервации. Если в протоколе без верификации у эмбриологов остается не больше 48 часов для анализа, то в криоцикле специалист в течение месяца проводит генетическую диагностику.
Практика разобщённого цикла по сравнению со стандартным протоколом без криконсервации характеризуется: меньшим риском гиперстимуляции, большим количеством материала и временем для анализа, а также менее травматичной для эмбриона процедурой биопсии. В зависимости от вида протокола ЭКО специалисты индивидуально выбирают сроки проведения ПГС.
Используемые методы ПГД
У каждого метода свои преимущества и недостатки. Основные различия связаны с хромосомным числом, точностью результата и ценой процедуры.
При исследовании моногенных заболеваний применяются методы на основе ПЦР. Полимеразная цепная реакция многократно и избирательно копирует определенный геномный сегмент, который содержит ген для его дальнейшего исследования.
ПГД эмбриона: за и против
Преимущества
Сегодня такое обследование является альтернативным способом снижения вероятности беременности больным плодом и рождения ребёнка с генетическим заболеванием. Необходимо учитывать, что ПГД не может быть полной заменой пренатальной диагностики.
Преимущества тестирования:
Стоит подчеркнуть, что когда женщины, находящиеся в старшей возрастной группе (40+) принимают решение зачать ребенка с помощью ЭКО, то диагностика генетических нарушений является самым разумным подходом, позволяющим повысить шансы на здоровое потомство.
Риски
Основные недостатки методики:
— Возможность повреждения эмбриона при недостаточной квалификации врача (менее 1%).
— Получение ложноотрицательных и ложноположительных результатов при наличии у зародыша клеточного мозаицизма (состояние, при котором в организме присутствуют клетки с 2 и более вариантами кариотипа, при этом, чаще всего, один пул клеток содержит нормальный кариотип, а другие – «патологический»). При использовании современного цитогенетического теста такой риск существенно снижается (не более 10%).
— Длительность анализа ведет к откладыванию момента эмбриопереноса и использованию криоконсервации. Однако эмбриологи утверждают, что процедуру следует выполнять с последующей витрификацией. Это не только позволяет осуществить доскональное тестирование, но и осуществить перенос в естественном цикле, что значительно снизит нагрузку на женский организм и создает условия, максимально близкие к естественному оплодотворению.
— Высокая стоимость методики. Ее проведение ощутимо повышает стоимость протокола ЭКО.
— Необходимость прохождения лечебного цикла ЭКО при генетических заболеваниях родителей.
ПГД – это сложнейшая манипуляция по изъятию у бластомера нескольких клеток, которая должна быть проведена специалистом, прошедшим специальную подготовку и имеющим опыт осуществления таких исследований. Во всем мире возможность проведения такого обследования ограничивается стоимостью.
Цены в Санкт-Петербурге приблизительно одинаковы во всех клиниках, так как само тестирование выполняется ограниченным числом лабораторий, которые имеют необходимое оборудование и обученный персонал. Разница между клиниками в наличии эмбриологов, умеющих проводить биопсию бластомеров.
Биопсия бластоцисты
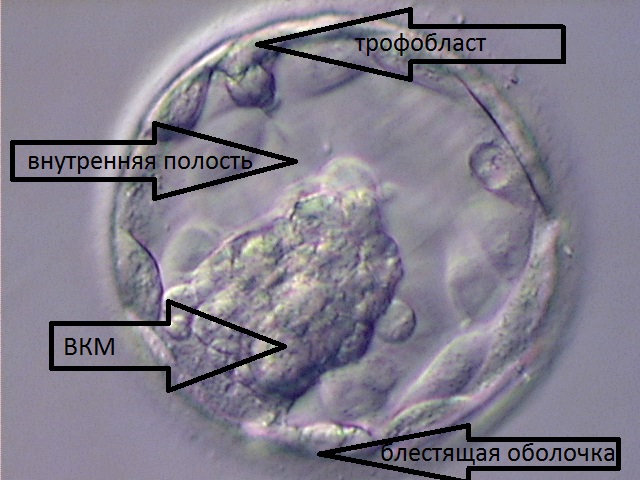
Преимплантационное развитие эмбриона человека продолжается около 7 дней от момента проникновения сперматозоида в яйцеклетку до момента имплантации в эндометрий матки. Это очень важный период развития и единственный, который может проходить вне организма матери, in vitro. За эти 7 дней эмбрион проходит огромный путь развития от 1 клетки до примерно 100, начинается дифференцировка – клетки эмбриона формируют 2 популяции – внутреннюю клеточную массу (ВКМ), из которой в дальнейшем разовьются все ткани и органы плода, и трофобласт – часть эмбриона, ответственная за имплантацию и формирование внезародышевых оболочек и эмбриональной части плаценты. Эмбрион на этой стадии представляет собой пузырек диаметром 0,2-0,3 мм и называется бластоцистой. У бластоцисты имеется внутренняя полость и четко видны две популяции клеток – ВКМ и трофобласт, она окружена защитной блестящей оболочкой (zona pellucida).
На этом этапе – на 5-6 сутки развития, до переноса в полость матки, мы имеем возможность взять несколько клеток трофобласта, не причинив эмбриону никакого вреда, поскольку трофобласт имеет уникальную способность к восстановлению, и из него НЕ формируются в дальнейшем ткани и органы будущего ребенка. Такая процедура называется биопсией трофобласта, или биопсией бластоцисты. Клетки, полученные при биопсии каждой бластоцисты, помещаются в специальные промаркированные пробирки и отправляются в генетическую лабораторию.
Здесь вы можете увидеть видео проведения биопсии бластоцисты. Процедура выполняется на инвертированном микроскопе с увеличением 200х, при помощи стеклянных микроинструментов и лазера.
Проведение биопсии может потребоваться для преимплантационной генетической диагностики эмбриона на носительство моногенных заболеваний или, что встречается чаще, для определения хромосомного набора эмбриона.
| ПРЕИМПЛАНТАЦИОННАЯ ГЕНЕТИЧЕСКАЯ ДИАГНОСТИКА ЭМБРИОНОВ (ПГД) | СТОИМОСТЬ, руб. |
| ПГД-консультирование | 3 000 |
| Prenetix – неинвазивная пренатальная диагностика плода на наличие анеуплоидий 13, 18, 21, X, Y хромосом (1 чел.) (включено: краткая расшифровка анализа) | 25 000 |
| Выявление полного набора хромосом у эмбрионов пациента методом секвенирования следующего поколения NGS (за 1 эмбрион) | 25 000 |
| Выявление полного набора хромосом у эмбрионов пациента методом сравнительной геномной гибридизации array-CGH 24Sure (за 1 эмбрион) | 30 000 |
| Выявление полного набора хромосом у эмбрионов пациентов-носителей транслокаций методом сравнительной геномной гибридизации array-CGH 24Sure (за 1 эмбрион) | 45 000 |
| Биопсия бластоцист | 32 000 |
| ПГД моногенных заболеваний (за 1 цикл) | 60 000. 180 000 |
| Разработка индивидуальной тест-системы для ПГД моногенных заболеваний (стоимость различается в зависимости от сложности диагностики) | 70 000. 270 000 |
Биопсия бластоцисты завоевала популярность несколько лет назад, практически полностью вытеснив ранее применявшуюся биопсию бластомеров (биопсия третьих суток развития, на стадии 6-8 клеток). По сравнению с биопсией третьего дня биопсия 5-6 дня имеет ряд преимуществ:
В нашей клинике биопсия бластоцист активно применяется с 2012 года, все эмбриологи в совершенстве владеют выполнением этой непростой процедуры.
Биопсия эмбрионов что это
Преимплантационное генетическое тестирование (ПГТ) — процедура определения генетической и/или хромосомной патологии эмбриона до его переноса в полость матки. Применявшиеся ранее термины «преимплантационная генетическая диагностика/скрининг» (ПГД/ПГС) в настоящее время заменены на «преимплантационное генетическое тестирование». ПГТ предусматривает два этапа: биопсия эмбриона — изъятие одной или нескольких клеток для получения источника ДНК и последующий ее анализ молекулярно-генетическими методами. В настоящее время по мере расширения спектра выявляемых аномалий востребованность процедуры ПГТ непрерывно возрастает. Проведение ПГТ помогает родить здорового ребенка семейным парам — носителям наследственных заболеваний (ПГТ моногенных заболеваний, ПГТ-M), семьям с наследственными транслокациями и другими особенностями кариотипа (ПГТ структурных перестроек, ПГТ-СП). Проведение доимплантационной генетической диагностики широко применяется для скринингового исследования числа хромосом эмбрионов (ПГТ на анеуплоидии, ПГТ-А), которое дает возможность избежать рождения детей с хромосомными синдромами [1].
Важным условием выполнения ПГТ является минимальное повреждение эмбриона при изъятии материала для исследования, при этом необходимо получить достаточное для анализа количество ДНК. Главными принципами при биопсии эмбрионов должны быть минимизация вреда и сохранение их репродуктивного потенциала [2]. Процедура биопсии эмбриона человека может выполняться на разных стадиях развития эмбриона. В настоящее время наиболее широко применяемой является биопсия трофэктодермы.
В современной практике клинической эмбриологии идут поиск и апробация новых неинвазивных методов биопсии или иных методов получения ДНК эмбриона для исследований, таких как генетический анализ среды культивирования эмбрионов [3]. Первая преимплантационная генетическая диагностика проведена на эмбрионах кролика. Материал для диагностики получен методом биопсии эмбриона на стадии бластоцисты [4]. В 1989 г. опубликована работа об успешной биопсии эмбриона человека на стадии дробления с целью определения пола [5]. Первоначально преимплантационная диагностика применялась для выявления моногенных и сцепленных с полом генетических заболеваний. С целью выявления носительства моногенного заболевания также использовали анализ ДНК, полученной при биопсии полярных телец [6]. Цитогенетические методы исследования, а именно FISH (fluorescence in situ hybridization, флюоресцентная гибридизация in situ), позволили определять число хромосом в фиксированном бластомере [7]. По мере развития технологий и перехода от цитогенетических к молекулярно-генетическим методам стало возможным определение анеуплоидий по всем 22 парам аутосом и половым хромосомам. Это позволило говорить о преимплантационном генетическом скрининге [8]. Следует отметить, что развитие и применение методов биопсии нельзя рассматривать в отрыве от развития методов молекулярно-генетического анализа. В процессе их совершенствования ПГТ начали использовать для многих других целей, таких как диагностика предрасположенности к опухолевым заболеваниям [9], выявление митохондриальных нарушений [10], оценка вероятности резус-конфликта [11], оценка системы тканевой совместимости HLA [12].
Биопсия полярных телец
Биопсия полярных телец — один из малоинвазивных методов биопсии: так как полярные тельца самопроизвольно отделяются от ооцита, их взятие не травмирует яйцеклетку. Исследование хромосомного и/или генетического статуса полярных телец — способ непрямой оценки хромосомного и/или генетического статуса ооцита. Метод не может давать полного представления о наличии или отсутствии патологии эмбриона, так как при его применении невозможно оценить генетическую составляющую, привнесенную сперматозоидом. Кроме того, очень высок уровень ошибок, ложноположительных и ложноотрицательных результатов [13]. Однако этот метод получил развитие в странах, в которых существуют законодательные ограничения на биопсию эмбрионов [14, 15]. Наибольшая информативность метода достигается при биопсии обоих полярных телец. В зависимости от способа анализа полярных телец возможна одновременная биопсия 1-го и 2-го полярных телец (последующий анализ методом FISH), или последовательная биопсия при замораживании яйцеклетки после биопсии 1-го полярного тельца, или при последующем анализе методами полимеразной цепной реакции (ПЦР), сравнительной геномной гибридизации (СGH), секвенирования нового поколения (NGS). Биопсию 2-го полярного тельца проводят через 8—14 ч после оплодотворения. В случае более ранней биопсии 2-го полярного тельца возможна энуклеация, так как все веретено деления может быть изъято вместе со 2-м полярным тельцем. Этот метод является наиболее экономически нецелесообразным, так как исследуются все ооциты, часть из которых затем не оплодотворяется, а часть отбраковывается ввиду низких морфологических характеристик и отставания в развитии. При этом нет свидетельств о негативном влиянии биопсии полярных телец на потенциал эмбриона к имплантации [2].
Биопсия бластомеров на стадии дробления
Широкое применение в рутинной практике получил метод биопсии бластомеров эмбриона на 3-и сутки развития. В этот момент в эмбрионе насчитывается 6—8 бластомеров. В ходе биопсии из объема эмбриона изымаются 1 или 2 клетки. Для облегчения изъятия клеток часто биопсию проводят в среде без кальция и магния, что ведет к потере адгезии между бластомерами и облегчает проведение манипуляции, снижает вероятность механического повреждения соседних бластомеров [16]. Рекомендовано проведение биопсии 3-суточного эмбриона в случае, если он имеет не менее 6 бластомеров, и фрагментация занимает менее 30% объема [2, 17]. В недавнем прошлом на долю биопсии на 3-и сутки развития приходилось 90% всех выполняемых биопсий эмбрионов [18]. Возможное негативное влияние биопсии бластомеров у 3-суточных эмбрионов широко обсуждалось, опубликовано множество работ как подтверждающих, так и опровергающих негативное влияние биопсии на потенциал к имплантации. В частности, показано, что эмбрионы после биопсии на стадии 6—8 бластомеров дробления образуют бластоцисты меньшего размера с утолщенной блестящей оболочкой (zona pellucida), что обусловлено нефизиологическим хетчингом эмбриона [19]. Окончательно то, что биопсия эмбрионов на 3-и сутки развития сильно влияет на жизнеспособность эмбриона и его потенциал к имплантации, подтвердили R. Scott и соавт. [20] в 2013 г. в результате двойного слепого рандомизированного исследования. Для переноса женщинам (моложе 35 лет с хорошим овариальным резервом) выбрали 2 эмбриона наилучшего качества во время стандартного цикла экстракорпорального оплодотворения, один эмбрион был подвергнут биопсии, другой же оставляли интактным, затем оба эмбриона переносили без анализа биоптата. Если имплантировался только один эмбрион, то ДНК плода сравнивали с ДНК из биоптата, чтобы оценить их соответствие. Это исследование показало, что существует значительное снижение (39%) потенциала к имплантации эмбриона после биопсии бластомера на 3-и сутки развития. Интересно отметить, что в ходе аналогичного исследования воздействия биопсии трофэктодермы, выполненной на стадии бластоцисты, авторы не отметили ее влияния на потенциал эмбрионов к имплантации.
Биопсия эмбрионов на стадии морулы
Метод предложен российской группой исследователей [21]. Как и при биопсии эмбриона на 3-и сутки развития, манипуляции с эмбрионом проводятся в безкальциево-безмагниевой среде, которая обусловливает декомпактизацию эмбриона на стадии морулы, в это время эмбрион состоит из гораздо большего числа клеток (20—30), чем эмбрион 3-суточный. Это позволяет взять для исследования несколько клеток и уменьшить риск влияния эмбрионального мозаицизма на точность диагностики. Кроме того, при биопсии эмбрионов на 4-е сутки развития есть возможность провести диагностику эмбрионов на анеуплоидии (в данном исследовании использовали FISH) до 5—6-х суток культивирования эмбриона, что дает возможность сделать перенос в этом же цикле, а так же криоконсервировать только эмбрионы без хромосомной или генетической патологии. Авторами не выявлены статистически значимые различия в частоте наступления беременности между группами пациенток с биопсией и без нее. Таким образом, метод биопсии эмбриона на стадии морулы может рассматриваться как перспективный, требующий, однако, дополнительного изучения с целью оценки его влияния на дальнейшее развитие эмбриона и его потенциала к имплантации.
Биопсия трофэктодермы
Биопсия бластоцисты — метод биопсии эмбриона на 5—6-е сутки развития, в котором дифференцированы трофэктодерма и внутренняя клеточная масса (ВКМ). Впервые применение метода биопсии трофэктодермы с целью преимплантационной диагностики эмбриона описано K. de Boer и соавт. [22]. О рождении ребенка в результате переноса эмбриона после биопсии трофэктодермы сообщено в 2005 г. сразу двумя группами исследователей [23, 24]. При биопсии бластоцисты изымаются несколько клеток трофэктодермы, как правило, с полюса, противоположного ВКМ. Для проведения процедуры биопсии эмбрионам проводят вспомогательный хетчинг на 3—4-е сутки развития [23], или же хетчинг производится непосредственно перед биопсией [25]. В первом случае к моменту проведения биопсии эмбрион, как правило, частично выходит из блестящей оболочки. Стеклянной пипеткой захватывают клетки трофэктодермы, вышедшие из оболочки, и отделяют их или механически, или при помощи лазерной пушки. При заблаговременном хетчинге существует вероятность, что при выходе из блестящей оболочки эмбриона будет лидировать ВКМ. В этой ситуации возможна биопсия трофэктодермы эмбриона после полного выхода его из оболочки. В случае хетчинга, проведенного непосредственно перед биопсией, есть возможность сориентировать эмбрион для наиболее безопасного и удобного положения ВКМ, однако в этом случае требуется вводить биопсийную пипетку под блестящую оболочку и «вытягивать» клетки трофэктодермы из оболочки эмбриона, далее проводится отделение этих клеток при помощи лазера или механически. Анализ полученных при биопсии клеток требует времени, поэтому после биопсии трофэктодермы эмбрионы криоконсервируют. Перенос пригодных эмбрионов проводят в криоцикле. Учитывая высокий потенциал таких эмбрионов, обычно практикуют перенос одного эмбриона. Это предотвращает развитие СГЯ и наступление многоплодной беременности [26, 27]. Следует отметить, что метод биопсии бластоцисты получил широкое распространение благодаря развитию технологии витрификации эмбрионов, которая позволяет сохранить высокий репродуктивный потенциал эмбриона при замораживании и последующем размораживании. Напомним, проведение процедуры биопсии трофэктодермы не оказывает влияния на выживаемость и имплантационный потенциал эмбрионов [20]. Необходимо также отметить возможное влияние эмбрионального мозаицизма на результат диагностики, взятие нескольких клеток трофэктодермы делает анализ более точным. Однако в случае диагностики методом NGS может быть выявлено присутствие в биоптате клеток, например с разным набором хромосом. В этом случае требуется интерпретация результатов с целью определить целесообразность переноса эмбриона.
Аспирация жидкости из полости бластоцисты (бластоцентез)
Для проведения преимплантационной генетической диагностики необходимо получение ДНК. Как правило, образец ДНК получают из одной или нескольких клеток, взятых путем механического изъятия из эмбриона на разных стадиях его развития. Однако такое механическое воздействие на эмбрион может быть сопряжено с риском его повреждения [28]. В настоящее время активно идут поиск и разработка новых методов получения внеклеточной ДНК, так, в 2013 г. обнаружено наличие внеклеточной ДНК в содержимом полости бластоцисты, причем показано, что эта ДНК соответствует ДНК эмбриона [29]. Процедура аспирации жидкости из полости бластоцисты получила название бластоцентеза, ранее этот метод применялся для коллапсирования бластоцисты перед процедурой криоконсервации. Стеклянной микропипеткой осуществляется пункция клеток полюса трофэктодермы, противоположного ВКМ, и производится изъятие жидкости из полости бластоцисты. Как правило, в результате процедуры удается получить относительно небольшое количество жидкости (около 0,01 мкл) для дальнейшего анализа [30]. Анализ полученного аспирата проводили методом ПЦР в сочетании с полногеномной амплификацией. Геномная ДНК присутствовала примерно в 90% проанализированных образцов. Высказано предположение, что фрагменты ДНК, находящиеся в жидкости бластоцеля, попадают туда в результате апоптоза клеток трофэктодермы и ВКМ. Показана возможность определения пола эмбриона путем амплификации мультикопийных генов TSPY1 (на Y-хромосоме) и TBC1D3 (на хромосоме 17). В случае амплификации обоих генов пол определяли как мужской. Это открывает новые возможности для пар с носительством Х-сцепленных нарушений для идентификации мужских эмбрионов с высоким риском заболевания. В другой работе [31] сделана попытка исследования анеуплоидий эмбрионов путем анализа ДНК, полученной из полости бластоцеля. Большинство (76,5%) образцов жидкости бластоцеля дало положительные сигналы на наличие ДНК. В качестве контроля проведена биопсия клеток трофэктодермы всех бластоцист. При сравнении данных плоидности, полученных при диагностике жидкости бластоцеля, с данными биопсии полярных телец и бластомеров выяснилось, что из 29 образцов, полностью соответствующих по хромосомному составу контрольным данным, только 6 оказались эуплоидными. В остальных 23 случаях установлена анеуплоидия. Таким образом, сделан вывод о возможности рассмотрения жидкости бластоцеля в качестве материала для диагностики анеуплоидии. При анализе хромосомного состава в 82% случаев сигналы образцов жидкости бластоцеля полностью совпадали с контрольными сигналами от клеток трофэктодермы. Причина расхождения сигналов в оставшихся случаях, предположительно, заключалась в явлении мозаицизма между клетками трофэктодермы и ВКМ, так как ученые предполагали, что геномная ДНК из полости бластоцисты может принадлежать не только клеткам трофэктодермы, но и клеткам ВКМ.
В 2015 г. группа российских ученых также опубликовали работу с описанием молекулярного кариотипирования внеклеточной ДНК, полученной из полости бластоцеля, диагностику проводили методом сравнительной геномной гибридизации. Показано соответствие внеклеточной ДНК и ДНК клеток бластоцисты [32]. По другим данным [33], при сравнении результатов биопсии жидкости из полости бластоцисты и биопсии трофэктодермы различия в кариотипах выявлены в 52% случаев.
В это же время другая группа исследователей [37] проводили анализ ДНК, полученной из полости бластоцисты методами количественной флюоресцентной полимеразной цепной реакции (КФ-ПЦР) и однонуклеотидного полиморфизма (SNP — Single nucleotide polymorphism). Целью было определить в том числе пригодность использования ДНК, полученной при аспирации полости бластоцисты и из среды культивирования эмбриона, для диагностики моногенных заболеваний. Установлено, что при диагностике моногенных заболеваний в аспирате полости бластоцисты и среды культивирования эмбриона в 2,9 и 20,8% случаев получен результат как и при исследовании трофэктодермы эмбриона. При этом образцы ДНК, полученной из полости бластоцисты, показали меньший уровень несоответствия результатов диагностики, а также контаминации, как посторонней, так и материнской ДНК. При анализе на анеуплоидии аспирата полости бластоцисты показана высокая частота отказов амплификации — 65,2%, а также всего 37,5% соответствия ДНК аспирата и ДНК, полученной при биопсии. Таким образом, авторы полагают, что аспирация полости бластоцисты не является надежным методом для получения ДНК с целью диагностики моногенных заболеваний.
Получение ДНК эмбриона для дальнейшего исследования в ходе ПГТ методом бластоцентеза представляет большой интерес, однако целесообразны дальнейшие исследования для повышения эффективности и точности метода [37].
Заключение
Анализируя развитие вспомогательных репродуктивных технологий, можно сделать вывод о том, что биопсия эмбриона является неотъемлемой частью проведения преимплантационного генетического тестирования. Развитие техник биопсии идет рука об руку с развитием методов молекулярно-генетического анализа. При проведении этой манипуляции необходимо сохранение качества эмбриона и его потенциала к имплантации. В настоящее время все чаще используется метод биопсии трофэктодермы бластоцисты на 5—6-е сутки развития. Он позволяет получить достаточное количество ДНК при минимальном повреждении эмбриона. Однако и другие методы биопсии эмбриона могут применяться в определенных случаях. Перспективным представляется метод бластоцентеза. Минимальное воздействие на эмбрион при таком способе получения ДНК является важным фактором, делающим необходимым совершенствование техники бластоцентеза и методов молекулярно-генетического анализа полученной ДНК с целью повышения их чувствительности и точности. Биопсия эмбриона для хромосомного скрининга является эффективным средством профилактики хромосомных заболеваний новорожденных и самопроизвольных патологических прерываний беременности по причине хромосомной патологии плода. Проведение преимплантационного генетического тестирования моногенных заболеваний дает возможность избежать рождения больных детей у супружеских пар с носительством заболевания. Квалификация эмбриолога, выполняющего процедуру биопсии, имеет решающее значение для успешности процедуры. Безукоризненное проведение биопсии эмбриона и получение достаточного количества информативного материала для генетической диагностики позволяют оптимизировать эмбриологический этап экстракорпорального оплодотворения.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare n conflict of interest.