Безъядерные клетки плоского эпителия что это
Гинекологический мазок «на флору»: на что смотреть, и как понять
Большинству женщин мазок «на флору» знаком, как самый «простой» гинекологический анализ. Однако исследование куда «полезнее», чем может казаться. И всего несколько (а то и одно) отклонений способны подсветить значимые проблемы, еще до появления каких-либо симптомов. Так как же понять полученные результаты? Рассказываем по пунктам.
1. Эпителий
Как известно, любой живой объект в природе имеет ограниченный срок жизни, по истечении которого он погибает «от старости».
Эпителий в гинекологическом мазке – это и есть слущенные «старые» клетки слизистой оболочки влагалища, цервикального или уретры (в зависимости от оцениваемого локуса). Которые могут присутствовать в материале в умеренных количествах.
Превышение нормативных пределов («много» или «обильно») может указывать на:
Уменьшение или отсутствие эпителия в мазке – на атрофические изменения, недостаток эстрадиола или избыток андрогенов.
Кроме того, ввиду зависимости эпителия от уровня половых гормонов, его количество в материале может сильно меняться в зависимости от дня цикла, начиная с единичного «в поле зрения» в самом начале – до умеренного и даже большого количества ближе к овуляции и во время нее.
А появление в мазке так называемых «ключевых клеток» (эпителий, «облепленный» мелкими кокковыми бактериями) – является маркером бактериального вагиноза.
2. Лейкоциты
«Норма» лейкоцитов в мазке также сильно зависит от стадии цикла и уровня половых гормонов, а также исследуемого локуса.
Так, за «максимум» для:
Повышение показателя – очевидно, свидетельствует о воспалении, а полное отсутствие может иметь место в норме в самом начале цикла.
Слизь
Результат «отсутствует», «мало» или «умеренно» для этого показателя является нормой, что тоже связано с индивидуальными особенностями гормонального фона и циклом.
А вот «много» слизи в мазке – может свидетельствовать о том, что мазок взят в середине цикла, дисбиотических изменениях или избытке эстрогенов. Поэтому требует внимания специалиста или, как минимум, контроля в динамике.
Флора
Преобладающей флорой женских половых путей в норме у женщин репродуктивного возраста, как известно, являются лактобактерии (или палочки Дедерлейна). Количество которых может быть от умеренного до обильного, в том зависимости, в том числе, от фазы менструального цикла.
Патологические элементы
Присутствия мицелия грибов, трихомонад, диплококков (в том числе и возбудитель гонореи), лептотрикса, мобилункуса и прочих патогенных микроорганизмов в нормальном мазке не допускается, даже в минимальном количестве. А их выявление – серьезный повод незамедлительно обратиться за лечением.
Что такое лейкоплакия шейки матки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Игнатенко Т. А., гинеколога со стажем в 13 лет.
Определение болезни. Причины заболевания
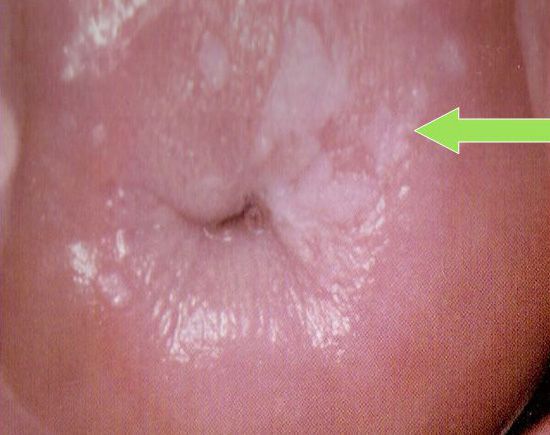
Лейкоплакия шейки матки — это утолщение и ороговение плоского эпителия слизистой оболочки шейки матки.
Термин «лейкоплакия» (в переводе с греческого — «белая бляшка») был предложен Швиммером в 1887 году для описания белесоватых участков слизистых оболочек щёк, которые расценивались как предраковые изменения. В отечественной литературе и клинической практике термин остаётся общепринятым до настоящего времени. За рубежом же предпочителен термин «дискератоз». [2]
Очаг лейкоплакии может располагаться на слизистой оболочке нижней губы, угла рта, дна полости рта, щёк, в аногенитальной области, на вульве, клиторе, во влагалище, на шейке матки, реже — в области головки полового члена, в окружности заднепроходного отверстия. [11]
Согласно статистике, частота лейкоплакии шейки матки составляет всего 0.7 на 100 000 случаев гинекологической заболеваемости, среди заболеваний шейки матки — 5.2%. [11]
Лейкоплакия шейки матки наиболее часто встречается в возрастной группе 17-39 лет. [9]
В большинстве стран Европы и США, где проводится организованный скрининг рака шейки матки, лейкоплакия шейки матки не попадает в активный поиск, пока цитологические мазки не выявят начальные степени дисплазии (предрака) шейки матки. В нашей стране тактика наблюдения и ведения лейкоплакии шейки матки более активная.
Причины развития лейкоплакии шейки матки делят на:
Под нарушением гормонального фона чаще подразумевают хроническое отсутствие овуляции, что приводит к дисбалансу эстрогена и прогестерона в организме с преобладанием первого. Относительно повышенные концентрации эстрогена, в свою очередь, действуют на органы-мишени (молочные железы, тело и шейка матки), приводя к гиперпластическим процессам (бесконтрольному увеличению числа клеток). [4] Часто у пациенток с лейкоплакией шейки матки диагностируют повышение уровня пролактина. Иммунные нарушения зачастую проявляются воспалительными процессами матки и ее придатков (вагиниты, сальпингоофориты, цервициты). [9] Отечественным исследованием выявлено повышение концентрации секреторного иммуноглобулина А (SIgA) у пациенток с такими фоновыми заболеваниями шейки матки, как эктопия цилиндрического эпителия и лейкоплакия шейки матки. [8]
Под химическими и травматическими воздействиями зачастую подразумевают интенсивное и неадекватное лечение по поводу «псевдоэрозии» шейки матки: приблизительно трети пациенток с лейкоплакией ранее проводилась диатермокоагуляция и другие деструктивные вмешательства на шейке матки. Немаловажным фактором развития лейкоплакии шейки матки является опущение и выпадение матки/шейки матки, которое сопровождается неизбежным нарушением влагалищной флоры и, при выраженных степенях, постоянным контрактом шейки матки с внешней средой. [5]
Симптомы лейкоплакии шейки матки
Зачастую заболевание протекает бессимптомно. Лишь около трети пациенток предъявляют жалобы на обильные бели и контактные кровяные выделения (после полового акта, использования тампонов, гинекологических осмотров).
Симптомы перерождения лейкоплакии в рак
Патогенез лейкоплакии шейки матки
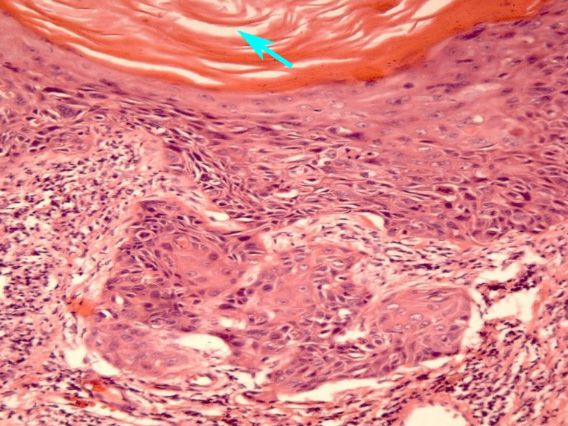
Механизм развития лейкоплакии в точности не выяснен. Считается, что под влиянием причинных факторов включаются механизмы ороговения в норме неороговевающего многослойного плоского эпителия шейки матки. На поверхности шейки матки формируются роговые чешуйки, клетки с деформированным ядром и внутриклеточными компонентами. [2]
Классификация и стадии развития лейкоплакии шейки матки
Согласно классификации Я.Б. Бохмана (1976), лейкоплакия, наряду с псевдоэрозией, эктропионом, полипом, эндометриозом шейки матки, цервицитами, истинной эрозией шейки матки, входит в группу фоновых заболеваний шейки матки, при которых не обнаруживается клеток с атипичными признаками, но длительное существование которых может послужить фактором риска развития предрака.
За рубежом лейкоплакию шейки матки с клеточным атипизмом относят к группе предраковой патологии шейки матки — ЦИН (цервикальной интраэпителиальной неоплазии, или дисплазии, шейки матки). [2]
Осложнения лейкоплакии шейки матки
Чем опасна лейкоплакия шейки матки
Лейкоплакия может распространяться с шейки матки на своды влагалища. Злокачественное перерождение клеток лейкоплакии наблюдается у 31,6% больных по данным отечественных авторов, 4,9-9% — по зарубежным данным. [11]
Диагностика лейкоплакии шейки матки
Комплексное обследование при лейкоплакии включает:
Кольпоскопия
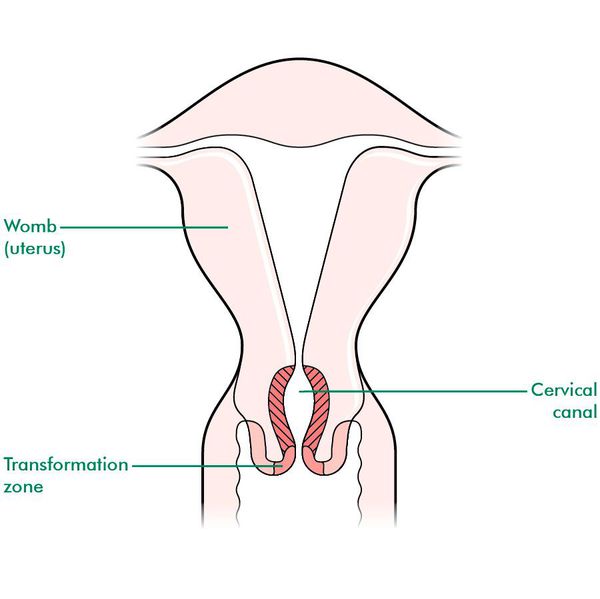
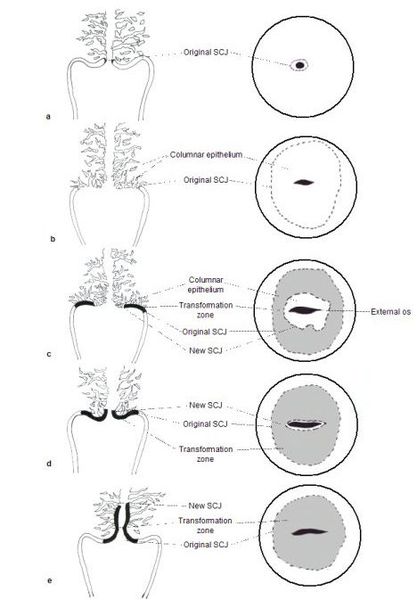
При кольпоскопии устанавливается тип зоны трансформации (переходной зоны стыка двух видов покровного эпителия шейки матки — многослойного плоского и цилиндрического), место расположения лейкоплакии.
Влагалищная часть шейки матки (экзоцервикс) покрыта многослойным плоским эпителием. В канале шейки матки (цервикальном канале, эндоцервиксе) — цилиндрический эпителий. Место перехода цилиндрического эпителия цервикального канала в многослойный плоский эпителий поверхности шейки матки носит название зоны трансформации. Эта область имеет большое клиническое значение, поскольку именно в ней возникает более 80% случаев дисплазии и рака шейки матки.
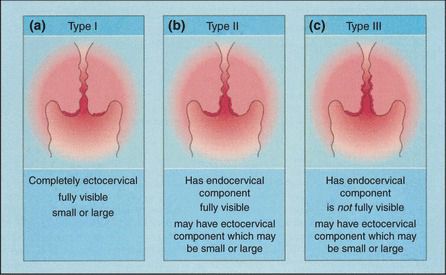
Зона трансформации 1 типа — переходная зона видна полностью. Это самый оптимальный и прогностически «благоприятный» вариант кольпоскопического заключения.
Зона трансформации 2 типа — переходная зона частично скрыта в канале шейки матки. Адекватно оценить такую картину сложно, так как наиболее измененные участки могут быть не видны и пропущены.
Зона трансформации 3 типа — переходная зона находится глубоко в канале шейки матки и оценить её кольпоскопически невозможно. Кольпоскопия в этом случае считается неинформативной, поскольку глубина залегания патологического очага остается неизвестной.
Цитологическое и гистологическое исследование
Сложность диагностики лейкоплакии при помощи простого цитологического соскоба с шейки матки заключается в невозможности оценки полноценного клеточного состава, так как из-за плотных роговых чешуек на поверхности многослойного плоского эпителия шейки матки в соскоб могут не попасть клетки из глубоких слоев. Таким образом может быть пропущена предраковая трансформация или даже рак шейки матки. [3] Именно поэтому основным методом диагностики лейкоплакии шейки матки является исследование ткани шейки матки, полученной при обязательно прицельной биопсии на фоне кольпоскопии. Зона трансформации 2 и 3 типа, определенные при кольпоскопии, могут послужить поводом для проведения не только биопсии, но и выскабливания слизистой канала шейки матки. Более щадящий метод оценки состояния слизистой канала шейки матки возможен при помощи микрокольпогистероскопии (офисная гистероскопия). Преимущество метода заключается в возможности нетравматичного прохождения канала шейки матки (цервикального канала) под визуальным контролем без анестезии. В процессе процедуры можно провести прицельную биопсию. При гистологическом исследовании лейкоплакия характеризуется терминами: кератоз, паракератоз, акантоз.
Бактериологическое исследование
Включает анализ влагалищного мазка и бактериальных посевов на флору и половые инфекции. Исследования важны тем, что при наличии воспаления шейки матки результаты цитологического и гистологического анализов могут быть искажены.
Анализ на ВПЧ
Исследование ДНК ВПЧ высокого онкогенного риска в соскобе с шейки матки и цервикального канала
В настоящее время изучают влияние вирусной инфекции на развитие лейкоплакии. Некоторые авторы считают, что процессы ороговения можно рассматривать как косвенный маркер папилломавирусной инфекции. Лейкоплакия, существующая вне инфицирования ВПЧ, зачастую не озлокачествляется. При сочетании с вирусом вероятность озлокачествления есть, но серьезных подтверждений этому факту пока нет. [12] [13]
Иммунограмма
Контроль уровня гормонов
Лечение лейкоплакии шейки матки
Консервативное лечение
Медикаментозное лечение при лейкоплакии включает:
В нашей стране лейкоплакию обычно подвергают деструкции — разрушению патологической ткани. Это обосновано, так как со временем лейкоплакия может трансформироваться, пациентка может заразиться ВПЧ и произойдёт перерождение ткани, что потребует новых биопсий и лишних визитов к врачу.
Хирургическое лечение
Наиболее часто применяемыми методами лечения лейкоплакии шейки матки являются:
Подготовка к операции включает:
Как проходят гинекологические операции
Манипуляции производят в первой половине менструального цикла (4-7 день от начала менструации). Для более точного определения патологической ткани процедура контролируется проведением кольпоскопии, а шейку матки обрабатывают раствором Люголя. Полное заживление и возвращение пациентки к привычной жизни (возможность половой жизни, использования вагинальных тампонов, посещение бассейна и прочее) зачастую ожидается через 28-40 дней после проведения процедуры. Коррекция гормональных нарушений и адекватная гормонотерапия, по некоторым данным, позволяет ускорить сроки заживления послеоперационной раны и снизить частоту повторного возникновения доброкачественных заболеваний шейки матки. [10]
При сочетании лейкоплакии с деформацией и гипертрофией шейки матки целесообразно проведение реконструктивно-пластических операций (пластика шейки матки) с целью восстановления анатомии цервикального канала. [14] [15]
Современные зарубежные исследователи расценивают лейкоплакию как доброкачественный физиологический процесс и в большинстве ситуаций рекомендуют профилактическое наблюдение.
Криодеструкция
Химическая коагуляция
Химическими коагулянтами, например Солковагином, лейкоплакию лечили в 90-х годах ХХ века. Эффективность лечения простой лейкоплакии шейки матки у молодых нерожавших женщин составляла около 70 %. Сейчас этот метод не применяют.
Антибиотикотерапия
Физиотерапия
Физиопроцедуры после операций на шейке матки, в том числе и при лейкоплакии, не проводятся.
Народные способы лечения
Беременность и лейкоплакия
При обнаружении лейкоплакии шейки матки у беременных обязательно лечат урогенитальную инфекцию, бактериальный вагиноз и восстанавливают микробиоценоз влагалища.
Реабилитация
Сразу после процедуры пациентку могут беспокоить тянущие боли внизу живота, однако они быстро проходят. Выделения чаще всего светлые слизистые или водянистые, редко с прожилками крови.
Кровянистые выделения после операции возникают редко. Но если они появились, беспокоят дольше 5–10 дней и/или менструации становятся обильнее и выделяются кровяные сгустки, то следует немедленно обратиться к врачу.
Также должна насторожить температуры тела свыше 37,5 °C, сильные боли внизу живота и гноевидные выделения из половых путей с резким неприятным запахом.
После операции в течение месяца рекомендуется:
Через две недели после операции врач проводит гинекологический осмотр, чтобы удостовериться, что пациентка восстанавливается. Слизистая полностью приходит в норму за 4–6 недель.
Наблюдение после лечения
Частота посещения доктора зависит от формы заболевания, эффективности лечения и наличия факторов риска, которые могут осложнить выздоровление: курение, ВИЧ-инфекция, заболевания, передаваемые половым путём, носительство онкогенных типов ВПЧ и т. п.
Диета
После лечения лейкоплакии следует придерживаться принципов правильного питания, специфическая диета не требуется.
Прогноз. Профилактика
При лейкоплакии шейки матки прогноз, как правило, благоприятный.
Принципы профилактики развития лейкоплакии шейки матки включают:
Цитологическая диагностика заболеваний шейки матки
Цитологическое исследование мазков из шейки матки позволяет оценить состояние слизистой оболочки, наличие или отсутствие признаков патологических процессов (реактивных, предопухолевых, опухолей). При выявлении другими лабораторными методами инфекционного агента (вирус папилломы человека, бактериальные и паразитарные инфекции), цитологический метод позволяет оценить реакцию организма на инфекционный агент, наличие или отсутствие признаков повреждения, пролиферации, метаплазии или трансформации эпителия. Возможно также при исследовании мазка определить причину изменений эпителия (наличие воспаления с ориентировочным или уверенным определением патогенной микробиоты (микрофлоры), патологических процессов, связанных с гормональным, лекарственным, механическим, лучевым воздействием на организм женщины и шейку матки, состояний, чреватых опасностью возникновения дисплазии и рака шейки матки, а при их развитии установить правильный диагноз. В связи с этим цитологическое исследование применяют как при скрининге (мазки с визуально нормальной шейки матки), так и при наличии видимых при гинекологическом осмотре изменений слизистой оболочки.
Получение материала
Рак шейки матки чаще всего развивается в зоне трансформации, ему предшествуют фоновые процессы и внутриэпителиальные поражения (дисплазия эпителия), которые могут располагаться на небольших участках, поэтому важно, чтобы материал был получен со всей поверхности шейки матки, особенно из зоны стыка плоского и цилиндрического эпителия. Число измененных клеток в мазке бывает различным, и если их мало, то увеличивается вероятность, что патологические изменения могут быть пропущены при просмотре препарата. Для эффективного цитологического исследования необходимо учитывать:
Материал из шейки матки должен брать врач-гинеколог или (при скрининге, профилактическом осмотре) хорошо обученная медицинская сестра (акушерка).
Важно, чтобы в мазок попадал материал из зоны трансформации, так как около 90% опухолей исходит из зоны стыка плоского и цилиндрического эпителия и зоны трансформации и только 10% из цилиндрического эпителия цервикального канала.
С диагностической целью материал получают раздельно из эктоцервикса (влагалищной порции шейки матки) и эндоцервикса (цервикального канала) с помощью шпателя и специальной щетки (типа Cytobrush). При проведении профилактического осмотра используют Cervex-Brush, различные модификации шпателя Эйра и другие приспособления для получения материала одновременно из влагалищной части шейки матки, зоны стыка (трансформации) и цервикального канала.
Перед получением материала шейку матки обнажают в “зеркалах”, дополнительных манипуляций не проводят (шейку не смазывают, слизь не удаляют; если слизи много – ее аккуратно снимают ватным тампоном, не надавливая на шейку матки.). Щетку (шпатель Эйра) вводят в наружный зев шейки матки, осторожно направляя центральную часть приспособления по оси цервикального канала. Далее ее наконечник поворачивают на 360° (по часовой стрелке), достигая тем самым получения достаточного числа клеток из эктоцервикса и из зоны трансформации. Введение инструмента выполняют очень бережно, стараясь не повредить шейку матки. Затем щетку (шпатель) выводят из канала.
Приготовление препаратов
Перенос образца на предметное стекло (традиционный мазок) должен происходить быстро, без подсушивания и потери прилипших к инструменту слизи и клеток. Обязательно перенести на стекло материал с обеих сторон шпателя или щетки.
Если предполагается приготовление тонкослойного препарата с помощью метода жидкостной цитологии, головку щетки отсоединяют от ручки и помещают в контейнер со стабилизирующим раствором.
Фиксация мазков выполняется в зависимости от предполагаемого метода окрашивания.
Окрашивание по Папаниколау и гематоксилин-эозином наиболее информативны в оценке изменений эпителия шейки матки; любая модификация метода Романовского несколько уступает этим методам, однако при наличии опыта позволяет правильно оценить и характер патологических процессов в эпителии и микрофлору.
Клеточный состав мазков представлен слущенными клетками, находящимися на поверхности эпителиального пласта. При адекватном получении материала с поверхности слизистой оболочки шейки матки и из цервикального канала в мазок попадают клетки влагалищной порции шейки матки (многослойный плоский неороговевающий эпителий), зоны стыка или трансформации (цилиндрический и, при наличии плоскоклеточной метаплазии, метаплазированный эпителий) и клетки цервикального канала (цилиндрический эпителий). Условно клетки многослойного плоского неороговевающего эпителия принято делить на четыре типа: поверхностные, промежуточные, парабазальные, базальные. Чем лучше выражена способность эпителия к созреванию, тем более зрелые клетки попадают в мазок. При атрофических изменениях на поверхности эпителиального пласта расположены менее зрелые клетки.
Интерпретация результатов цитологического исследования
Наиболее распространенная в настоящее время – классификация Bethesda (The Bethesda System), разработанная в США в 1988 г, в которую вносили несколько изменений. Классификация создана для более эффективной передачи информации из лаборатории врачам клинических специальностей и обеспечения стандартизации лечения диагностированных нарушений, а также последующего наблюдения за больными.
В классификации Bethesda выделяют плоскоклеточные интраэпителиальные поражения низкой и высокой степени (squamous intraepithelial lesions of low grade and high grade – LSIL и HSIL) и инвазивный рак. Плоскоклеточные интраэпителиальные поражения низкой степени включают изменения, связанные с папилломавирусной инфекцией и слабой дисплазией (CIN I), высокой степени – умеренную дисплазию (CIN II), тяжелую дисплазию (CIN III) и внутриэпителиальный рак (cr in situ). В этой классификации имеются также указания на специфические инфекционные агенты, вызывающие заболевания, передавае мые половым путем.
Для обозначения клеточных изменений, которые трудно дифференцировать между реактивными состояниями и дисплазией предложен термин ASCUS – atypical squamous cells of undetermined significance (клетки плоского эпителия с атипией неясного значения). Для клинициста этот термин мало информативен, однако он нацеливает врача на то, что данная пациентка нуждается в обследовании и/или в динамическом наблюдении. В классификацию Bethesda в настоящее время введен также термин NILM – no intraepithelial lesion or malignancy, объединяющий норму, доброкачественные изменения, реактивные изменения.
Так как данные классификации используются в практике врача-цитолога, ниже приведены параллели между классификацией Bethesda и классификацией, распространенной в России (Табл. 22). Цитологическое стандартизованное заключениепо материалу из шейки матки (форма № 446/у), утверждено приказом Минздрава России от 24.04.2003 № 174.
Причины получения неполноценного материала различны, поэтому цитолог перечисляет типы клеток, обнаруженные в мазках и по возможности указывает причину, по которой материал признан неполноценным.
Терминологическая система Бетезда(TBS-2014). Алгоритмы ведения пациенток

«В центре нашего внимания женщина, чьё предраковое поражение шейки матки должно быть диагностировано точно, быстро и полностью удалено, с тем, чтобы предотвратить развитие инвазивной карциномы и вернуть ей радость жизни».
История проблемы
«Я не мог убедить своих коллег в практичности процедуры».
Джорж Папаниколау, 1928 год.
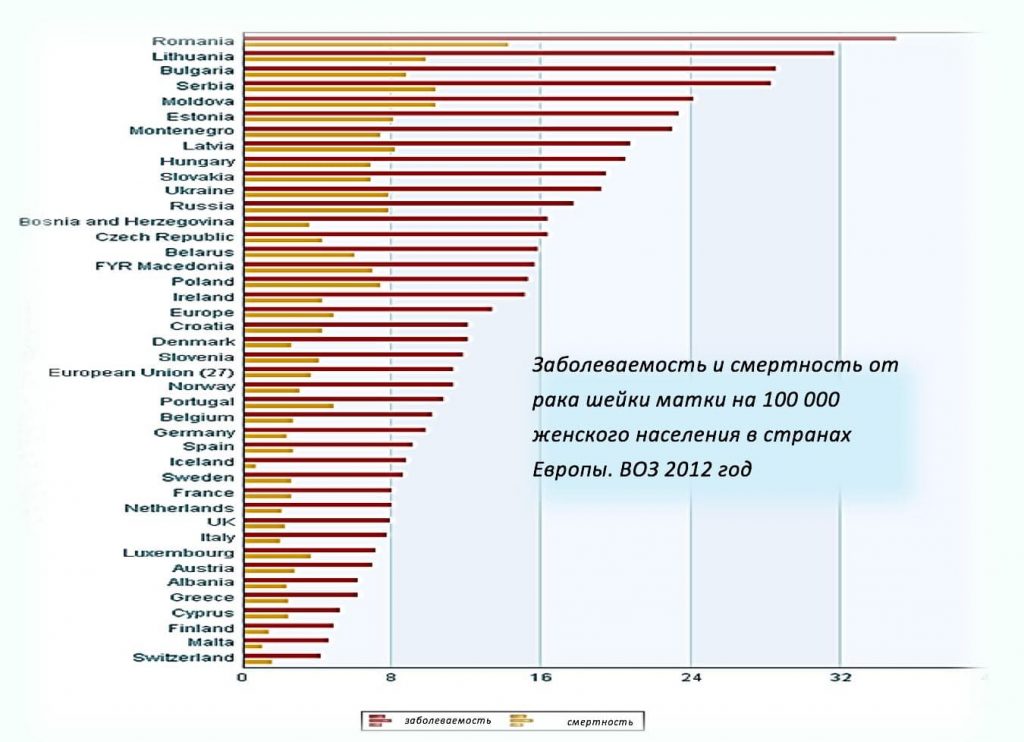
Эпидемиология рака шейки

По данным ВОЗ (2012):
Этиология

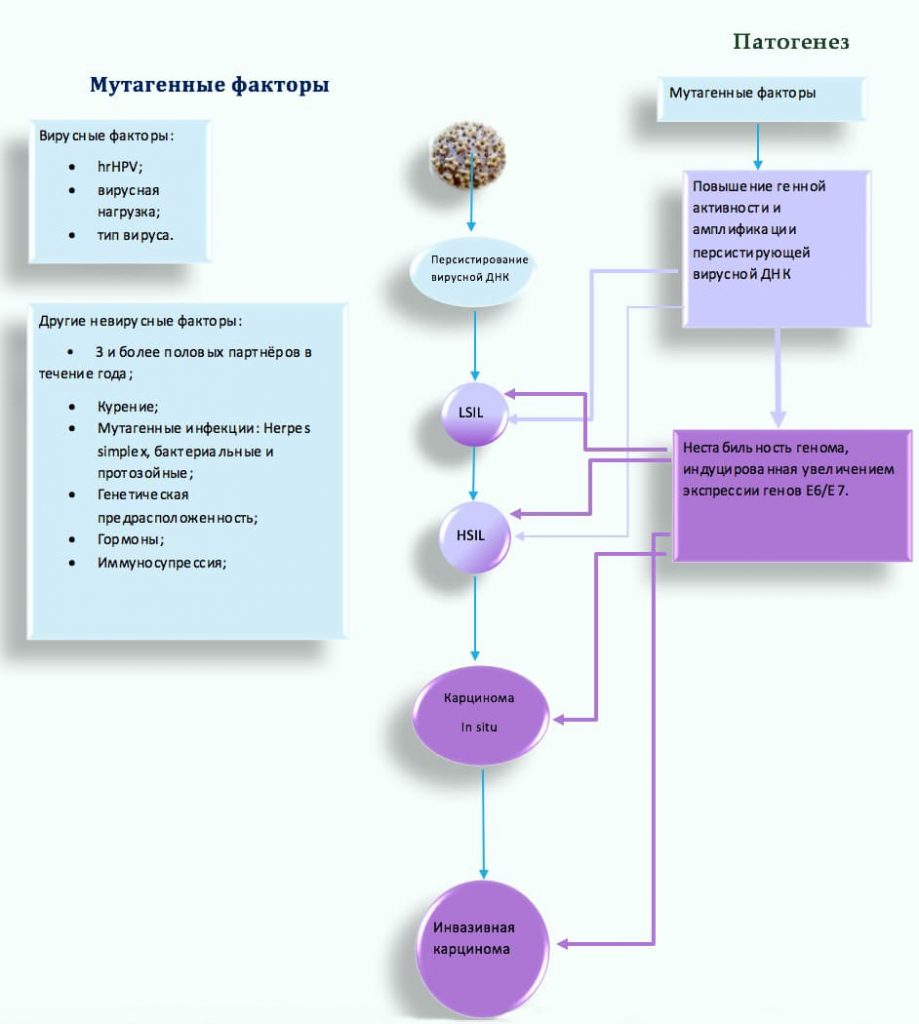
Рак шейки матки связан с персистированием ДНК вируса папилломы человека высокого риска (hrHPV). Согласно результатам мета-анализа (Li et al.2011) превалирование (hrHPV) обнаруживают в 85.9%-92.9% случаев рака. Аногенитальные типы HPV, вовлечённые в развитие карциномы и кондилом принадлежат к α-роду и подразделяются на два основных типа: hr (высокого риска) и lr (низкого риска).
lrHPV ассоциированы с кондиломами и транзиторной инфекцией. В большинстве случаев иммунная система, посредством апоптоза инфицированных клеток, элиминирует вирус lrHPV, а повреждения восстанавливаются регенерацией плоского эпителия.
hrHPV способен интегрироваться в ДНК человека и при отсутствии лечения вызывает карциномы урогенитальной и орофарингеальной области.
Частота выявления различных типов hrHPV при цервикальной карциноме в Европе
(de Sanjose et al.2010): HPV 16 – 66%, HPV 18 – 7%, HPV 33 – 6%,HPV 45 – 4%,HPV 31 – 3%.
При аденокарциномах наиболее часто выявляют: HPV 16,18,45.
Карциногенный эффект hrHPV необходимо рассматривать в контексте факторов риска, которые способствуют персистированию вируса:
Роль HPV и других факторов риска в онкогенезе
Формы существования ВПЧ в инфицированных клетках и ключевые, интегральные вирусные гены.
Ключевую роль в патогенезе играют:
P53 и Rb – белки, вовлечённые в процессы восстановления повреждённой ДНК и активации апоптоза клеток, с необратимыми структурными нарушениями генома.
Этапы развития инвазивной плоскоклеточной цервикальной карциномы
Инвазивной плоскоклеточной карциноме предшествует цервикальная интраэпителиальная неоплазия (CIN I,II,III).
CIN (I,II,III) – гистологические типы не инвазивной стадии заболевания, напрямую связанные с процессами инфицирования и интеграции ВПЧ, при которой аномальные клетки ограничены слоем эпителия.

ВПЧ16 и 33 характеризуются самым высоким риском прогрессии в CIN III.
ВПЧ 16 и 31 практически никогда не регрессируют.
Итак CIN I или LSIL – в большинстве случаев,
продуктивная или эписомальная стадия инфицирования ВПЧ.
CIN II, III или HSIL – интегративная или интросомальная стадии инфицирования ВПЧ.
Регуляция процесса деления (переход клетки из G1 в S фазу) нормальной эпителиальной клетки и при эписомальной инфекции ВПЧ
Нарушение регуляции клеточного деления при трансформирующей интросомальной инфекции ВПЧ
Избыточная экспрессия p16 высоко коррелирует с онкогенной трансформацией, вызванной персистирующим вирусом ВПЧ высокого риска (hrHPV).
В клетках эпителия, инфицированных трансформирующей hrHPV, онкопротеин вирусной ДНК E7 замыкает белок ретинобластомы, что нарушает образование комплекса pRb E2F. Это приводит к бесконтрольной пролиферации клеток эпителия, с вирусной ДНК, генетической нестабильности, гиперэкспрессии белка p16, которую выявляют при иммуноцитохимическом окрашивании жидкостных Пап-препаратов.
Таким образом, иммуноцитохимическое окрашивание на белок p16 позволяет:

А-LSIL (CIN I) – слабоположительное окрашивание.
Б-HSIL (CIN II) – умеренное окрашивание.
В-HSIL (CIS) – резко положительное окрашивание.
Г – HSIL (CIS) – резко положительное окрашивание. (И.П.Шабалова, К.Т. Касоян.2016).
Роль иммуногистохимического окрашивания на белок p16 в выработке тактики ведения пациенток по результатам гистоморфологического исследования.
А. Использование иммуногистохимического окрашивания биопсийного материала на белок p16 с целью дифференциальной диагностики HSIL от не неопластических мимикрирующих процессов, таких как незрелая плоскоклеточная метаплазия, атрофическая метаплазия и репарация.
Иммуноцитохимический тест P16/Ki67 (CINtec Plus).
В последние годы большое внимание цитологов направлено на исследование диагностической значимости одновременного определения экспрессии белков р16 и Ki-67 в цитологических препаратах для идентификации плоскоклеточного интраэпителиального поражения высокой степени (HSIL) в Pap-тесте с диагнозом ASC-US (клетки плоского эпителия с атипией неясного значения, LSIL (плоскоклеточное интраэпителиальное поражение низкой степени) и ASC-H, при которых представляется затруднительным исключить HSIL. По результатам одного из самых значительных проспективном диагностическом исследовании, в которое вошло 27 000 женщин из разных стран (PALMS- Primary, ASC-US, LSIL Marker Study), были сделаны следующие выводы о диагностической значимости теста P16/Ki67:

Взаимодействие ВПЧ с эпителиальной клеткой происходит по 2 основным сценариям:

Особенности и неоспоримые преимущества ЖЦ
Правила подготовки к проведению Пап-теста 
Наилучшее время для Пап-теста: промежуток между 5-м и 22-м днями цикла. Если Вам предстоит Пап-тест, то в за 2 дня Вы не должны:
Техника взятия материала для проведения BD SurePath Пап-теста
Цитологическое заключение составляется в течение 3-х рабочий дней с интерпретацией результатов по системе Bethesda 2014 (TBS-2014)
Этапы роботизированной пробоподготовки и клеточного обогащения SurePath
Окрашивание мазков, приготовленных по технологии BD SurePath
Технология BD SurePath предусматривает единственный метод окрашивания мазков – по Папаниколау. Это метод полихромного окрашивания клеточной суспензии. По признанию всех специалистов, он является наилучшим для гинекологических препаратов. Окраска по Папаниколау обладает целым рядом преимуществ перед другими методами, которые делают её мировым стандартом окрашивания мазков при проведении Пап-теста:
Фундаментальные принципы системы Bethesda:
Терминология цитологического заключения Пап-теста должна быть:
Основные категории
Атипия плоского эпителия
Атипия железистого эпителия
Причины последнего пересмотра TBS в 2014 году

В настоящее время TBS-2014 рекомендована во всём мире, как наиболее оптимальная терминологическая классификация патологических изменений шейки матки, которая составляет основу формирования цитологического заключения.

Более того, на основе ключевых принципов терминологической системы цервикальной патологии, позднее стали формироваться стандартизированные цитологические классификации для описания патологии иных локализаций: система Бетезда для щитовидной железы 2010 года, поджелудочной железы и Парижская система интерпретации патологии уринарного тракта 2013 года. В соответствии со «стилем Бетезда», каждая диагностическая категория в этих системах описана с ориентировочным риском развития злокачественной патологии и рекомендациями по ведению пациентов. И, самое главное, что аналогичная двухуровневая терминологическая система для плоскоклеточных поражений LSIL и HSIL, используемая цитологическами классификациями, в настоящее время рекомендована ВОЗ и ACSSP, для гистоморфологических описаний ВПЧ-ассоциированных поражений нижнего аногенитального тракта (Stoler M. Et al, 2014).
Пункты, которые содержит цитологическое заключение по системе Бетесда 2014, приведены в таблице 1.
Специфические инфекционные агенты:
Другие: клетки эндометрия (у женщин в возрасте старше 45 лет).
Атипичные клетки железистого эпителия:
Атипичные клетки железистого эпителия: эндоцервикальные клетки/железистые клетки с подозрением на неоплазию (AGC favor neoplastic);
Эндоцервикальная аденокарцинома in situ (AIS). Аденокарцинома:
Другие злокачественные новообразования (указать какие).
Дополнительные тесты (Результаты исследования).
Указание использования компьютеризированной интерпретации препарата (если применялясь).
Особенности последней редакции TBS-2014
Глава 1. Оценка адекватности образца.
Чувствительность Пап-теста в значительной степени определяется качеством взятия материала и способом приготовления цитологического препарата. Поэтому в цитологическом отчете важно указать метод исследования (традиционный или жидкостной). Для каждого из них существуют строго определённые требования к количественному составу клеточных элементов плоского эпителия, цилиндрического и метаплазированного.
Критерии адекватности по системе Бетезда
Образец считают удовлетворительным для оценки если:
При отсутствии клеток ЗТ образец может быть признан адекватным для оценки, но с обязательным указанием, что в образце не представлены клетки цилиндрического или метаплазированного эпителия, что отразится на тактике ведения пациентки.
Неудовлетворительным образец считают в следующих ситуациях:
Рекомендации при неудовлетворительном образце:
Система Бетезда: Т-зона. Цитологическое резюме:
Алгоритм ведения пациенток с цитологическим заключением NILM, нет ЗТ.
Глава 2. TBS-2014 посвящена категории неопухолевых изменений NILM (негативные в отношении интраэпителиальных поражений и злокачественности) с указанием типа:
I.Неопухолевые клеточные изменения:
II. Реактивные изменения, связанные с:
А также указывают на наличие специфических инфекционных агентов:
NILM –это категория, в которую входят все случаи без признаков внутриэпителиальной неоплазии. И это не только абсолютная норма, но и образцы с различными доброкачественными изменениями, которые возникают по ряду причин, а именно: острое и хроническое воспаление, гормональные сдвиги, беременность, кормление грудью, изменения pH, использование контрацептивов, облучение и химиотерапия в лечебных протоколах. Среди неопухолевых доброкачественных процессов, на которые необходимо акцентировать внимание, выделяют следующие:

Кератоз (без признаков атипии) – проявления защитной реакции в виде ороговения верхних слоёв эпителия, которая возникает, как правило, в ответ на хроническое воспаление, в том числе, вызываемое низкими титрами ВПЧ, при отсутствии каких-либо признаков неоплазии. Считают, что кератоз – это вторая линия защиты эпителиальных клеток, после метаплазии, которая представляет собой первую реакцию в ответ на действие повреждающего фактора. Кератоз, паракератоз, гиперкератоз и дискератоз – это описательные термины, которые в прошлом использовались непоследовательно. Потому в последней редакции для описания выявленных доброкачественных изменений используется единый термин «кератоз». После метаплазии, хроническое воздействие повреждающего фактора приводит, как правило, к образованию в клетках кератогиалиновых гранул и последующему кератозу.
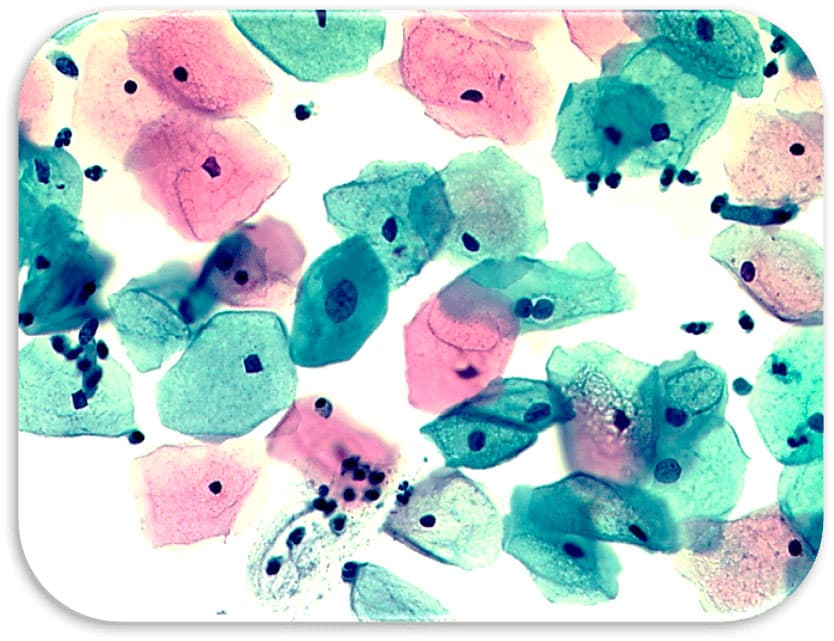
Критерии гиперкератоза: безъядерные клетки плоского эпителия поверхностных слоёв, полностью сохранившие клеточные контуры, но с пустыми пространствами на месте ядра, так называемыми «ядрами-призраками». Ранними признаками наступающего гиперкератоза являются клетки поверхностного эпителия с керато-гиалиновыми гранулами.
Критерии паракератоза: миниатюрные клетки поверхностных слоёв различной формы, с оранжевой или розовой цитоплазмой и маленькими пикнотичными ядрами. Ядерно-цитоплазматическое соотношение не нарушено, ядра округлые, с ровным контуром и напоминают по форме и размерам ядра соседних клеток. При обнаружении паракератозных клеток, необходимо полностью убедиться в отсутствии признаков ядерной атипии, в противном случае, при наличии плеоморфизма ядер, гиперхромазии и увеличенного ядерно-цитоплазматического соотношения, паракератоз интерпретируют, как ASC-US или ASC-H, или SIL. Для полной уверенности в интерпретации изменений, как NILM, следует провести ко-тестирование на ДНК ВПЧ.


Трубная метаплазия – это метапластический феномен, при котором нормальные эндоцервикальные клетки замещаются эпителием фаллопиевых труб. Этот феномен часто обнаруживается в верхней части цервикального канала.
Критерии трубной метаплазии

Цилиндрические реснитчатые клетки, располагающиеся небольшими группами. Круглые или овальные ядра часто бывают гиперхромными и плеоморфными. Хроматин распределён равномерно, ядрышки, как правило не видны. Ядерно-цитоплазматическое соотношение может быть увеличенным. Наличие ресничек и терминальной полоски – это самый важный отличительный признак этих клеток.
Трубная метаплазия – это доброкачественный процесс, но его часто принимают и интерпретируют, как атипичные эндоцервикальные клетки. Это происходит из-за увеличенных гиперхромных ядер, наслаивающихся друг на друга. Следует обращать внимание на наличие ресничек и терминальной полоски – признаков, позволяющих убедиться в доброкачественном характере обнаруженных структур.
Атрофия
Атрофия – это физиологический возрастной феномен, обусловленный снижением гормональной стимуляции, которая приводит к истончению эпителиального слоя, состоящего исключительно из незрелых базально/парабазальных клеток.

Атрофия с воспалением. Характерен фон препарата: дегенеративные изменения парабазальных клеток и полиморфноядерных нейтрофилов (ЖЦ).
В сложных случаях реактивно-репаративных изменений в клетках парабазального эпителия, иммуноцитохимическое окрашивание на белок р16 позволяет установить доброкачественную природу выявленных изменений.
Изменения, связанные с беременностью
В течение беременности в цитологических препаратах отмечают изменения, которые напоминают неопластические процессы. Это объясняется изменением гормонального фона, который приводит к неполному созреванию эпителия. Доминирующим клоном клеток во время беременности являются промежуточные клетки. Они напоминают лодочку и называются навикулярными клетками. Во время беременности отмечают феномен Ариас-Стеллы. Он представляет собой доброкачественный процесс, в который вовлечены клетки железистого эпителия (эндоцервикальные и эндометриальные). Критерии феномена:


Глава 3. TBS-2014 посвящена вопросу о необходимости указания в цитологическом заключении на наличие доброкачественных эндометриальных клеток у женщин старше 45 лет.

Глава 4. Эпителиальная атипия плоского эпителия. Клетки плоского эпителия с атипией неясного значения. (ASC).
В категорию ASC входят все случаи интраэпителиальных изменений, которые по качественным и/или количественным цитоморфологическим характеристикам не возможно отнести к LSIL или HSIL. В соответствии с критериями TBS-2014, в данной категории выделяют две группы клеток с атипией:
Категория ASC-US предполагает наличие клеточных изменений, более выраженных, чем реактивные, но по качеству или количеству, недостаточных для постановки LSIL. По данным различных исследований, в 40-50% случаев обнаруживают ДНК HR-HPV, а причина остальных цитоморфологических заключений, как ASC-US – реативно-репаративные процессы, присутствие специфического инфекционного агента, применение ВМС, атрофия, инфицированность ВПЧ низкого онкогенного риска, либо остаётся неизвестной. Однако, при интерпретации выявленных изменений, используя данные анамнеза и клинического осмотра, по возможности и данные пересмотра предыдущих исследований, а также ВПЧ-тестирования, следует помнить, что в 10-20% случаев ASC-US гистоморфологическое исследование даёт заключение HSIL. Hr-HPV тестирование является основным дифференциально диагностическим подходом для тактики ведения пациенток с цитологическим заключением ASC-US (R. Nayar, David C. Wilbur.2015). Обнаружение у пациентки любого возраста hr-HPV и цитоморфологических изменений, соответствующих критериям атипии неясного значения, позволяет поставить диагноз ASC-US или LSIL. При наличии указаний в цитологическом заключении на атипичную репарацию, вызванную воспалительным процессом, повторный Пап-тест назначают не раньше, чем через 2 месяца после окончания противовоспалительного лечения (И.П. Шабалова, К.Т. Касоян, 2016).
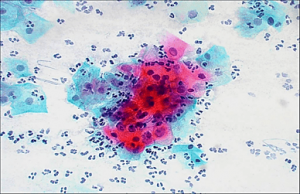
На данном слайде представлен кластер атипичных клеток, отнесённых к категории ASC-US. Клетки полиморфны по форме, размерам, ядерной гиперхромазии. Оксифильная цитоплазма клеток позволяет предположить HPV, однако классических койлоцитов в данном кластере нет.
Данная категория предполагает наличие всех убедительных цитоморфологических признаков LSIL в препарате, а также тех, которые подозрительны, но не совсем достаточны для заключения о наличии интраэпителиальных поражений высокой степени злокачественности (HSIL).
Цитоморфологические критерии:
При обнаружении резко выраженных изменений в структуре ядра (гиперхромия, высокое ядерно-цитоплазматическое соотношение, неровный контур), предпочтительным считают заключение HSIL. Цитологический диагноз ASC-H, не зависимо от результатов hr-HPV-тестирования, является показанием для проведения кольпоскопии. В практике цитологических исследований существует три основных ситуации, при которых устанавливают диагноз ASC-H:

На данном слайде представлен цитологический образец ASC-H в метаплазированных клетках. Последующая биопсия установила диагноз HSIL – интраэпителиального поражения высокой степени злокачественности.
Риски для категории ASC-US/ASC-H развития HSIL в течение 5 лет.
На основании представленных рисков развития интраэпителиальных поражений высокой степени злокачественности (HSIL), специалистами ASCCP в 2012 году были разработаны алгоритмы ведения пациенток для всех категорий, в том числе и при атипии неясного значения. Основной принцип, положенный в основу всех алгоритмов при цервикальном скрининге – соответствие менеджмента риску. При этом Пап-тест специалисты рассматривают, как основную меру или эталон принятия решений.
Глава 5. Атипия плоского эпителия. LSIL/HSIL
Двухуровневая система разделения атипии плоского эпителия составляет основу терминологической системы Бетезда, которая полностью отражает биологию вирусно-эпителиальных взаимодействий. Поражения низкой степени злокачественности (LSIL) представляют собой продуктивную, транзиентную, эписомальную форму ВПЧ-обусловленных изменений плоского эпителия. Если продукты трансляции вируса (ранние и поздние гены) нарушают экспрессию крайне консервативных у млекопитающих генов (онкогенов, генов-ингибиторов опухолевого роста, генов-блокаторов апоптоза), возникает принципиально иная форма ВПЧ-ассоциированных изменений – интросомальная, интегрированная, которая морфологически проявляет себя поражениями плоского эпителия высокой степени злокачественности (HSIL). Основной целью цервикального скрининга
LSIL &CIN I & слабая дисплазия):
Продукция вируса & Транзиентная инфекция & Койлоцитарная атипия
Цитоморфологическую LSIL основу составляют инфицированные клетки с койлоцитарной атипией.
Койлоциты – клетки плоского эпителия, содержащие в ядре и цитоплазме вирусные частицы, репликация которых, приводит к характерным цитоморфологическим изменениям, свойственным койлоцитарной атипии. Они вызваны цитопатогенным действием вируса, которое приводит к некрозу ядра и цитополазмы.
Койлоцитарная атипия является одним из важнейших прямых признаков ВПЧ-инфицирования эпителия шейки матки.
Критерии:
HSIL & CIN II, CIN III, CIS & умеренная дисплазия, тяжёлая дисплазия, cr in situ. HPV E6/E7 экспрессия & риск инвазивного рака.
Терминологическая система Бетезда объединяет все типы дисплазий после категории CIN I в единую группу атипий плоского эпителия высокой степени злокачественности (HSIL), которые представляют собой интегрированную, инрососмальную форму ВПЧ-ассоциированных поражений. Принципиально важной и наиболее значимой частью цитологической практики является дифференциальная диагностика LSIL и HSIL, которая полностью опирается на чётко определённые цитоморфологические критерии. На первый план выступают все признаки незавершённого клеточного созревания.
Критерии HSIL:
Четыре наиболее частых морфологических типа HSIL
Дисплазия с ороговением: клетки с ярко выраженной атипией, с признаками ороговения цитоплазмы (оранжевые клетки при окраске по Папаниколау) располагаются в пластах, с наслаивающимися гиперхромными ядрами. Опухолевый диатез отсутствует, что отличает эту форму HSIL от инвазивного рака. Но, с другой стороны, гипер- и паракератоз-косвенные признаки ВПЧ-инфекции, могут протекать без признаков клеточной атипии, что затрудняет дифференциальную диагностику Данной формы HSIL.
Мелкие клетки с резким дискариозом: ядра атипичных клеток чуть больше, чем у лимфоцита. Клетки располагаются разрозненно или в гиперхромных пластах, в которых достаточно трудно определимы границы между ними. Цитоплазма почти не определяется т.к. ядро занимает практически 100% клеточного объёма. Дифференциальную диагностику проводят с фолликулярным цервицитом, эндометриальным клетками и незрелой метаплазией, нейроэндокринной карциномой.
HSIL в незрелых метаплазированных клетках: клетки преимущественно располагаются по одиночке, в отличие от незрелых метаплазированных клеток, образующих небольшие пласты. Как известно, ядерно-цитоплазматическое соотношение в нормальных незрелых метаплазированных клетках приближается к 50%. Дифференциальная диагностика должна опираться на признаки атипии: аномальное распределение хроматина, неровность ядерной мембраны, плеоморфность ядер в пластах, гиперхромию ядер и гранулярный хроматин. Цитоплазма плотная, с чёткими границами, вакуолизирована.
HSIL в атрофических мазках: гиперхромные парабазальные пласты клеток, лежащие на фоне воспаления и аутолиза – это общие морфологические черты HSIL и атрофии. Для дифференциальной диагностики необходимо опираться на следующие признаки: внимание должны привлекать отдельно лежащие популяции клеток с признаками дискариоза. При наличии атрофического вагинита, при котором клетки могут быть увеличены и несколько атипичны, рекомендовано проведение короткого курса местной терапии эстрогенами и последующее котестирование, включающее цитологическое исслеование и ВПЧ-тестом.
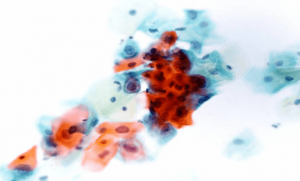


Глава 6. Атипия железистого эпителия (AGC).
Внедрение в практику Пап-теста жидкостных технологий приготовления препаратов, а также использование цитощёток Cervex-Brush Combi, захватывающих одновременно экто-эндоцервикс и зону трансформации, позволило существенно улучшить цитологическую диагностику патологии железистого эпителия, относительная доля которого в последние два десятилетия существенно возросла. (R. Nayar, David C. Wilbur.2015.).
Аденокарциномы соствляют 5-10% от всех неоплазм шейки матки. Гистологически выделяют три типа: эндоцервикальная, эндометриальная и светлоклеточная аденокарциномы. Эндоцервикальная аденокарцинома – самый распространённый и наиболее легко распознаваемый при цитологическом обследовании тип. Довольно часто она сочетается с плоскоклеточной карциномой, что свидетельствует об общности этих процессов по этиологии и патогенезу. Таким образом, наряду с плоскоклеточными неоплазмами, являются ВПЧ-ассоциированными злокачественными новообразованиями шейки матки. Достаточно долго аденокарцинома может не проявлять себя клинически, без изменений шейки матки. Цитологически выделяют три степени градации аденокарциномы, в зависимости от степени дифференцировки опухолевых клеток: высоко-, средне, и низкодифференцированная. Чем меньше дифференцировка, тем меньше злокачественные клетки напоминают нормальный эндоцервикальный эпителий.
В системе Бетезда выделена категория атипичных клеток железистого эпителия (AGC). Этот цитологический диагноз устанавливают если клеточная (ядерная) атипия превышает признаки реактивно-воспалительных изменений, но не является очевидной для постановки диагноза аденокарциномы.
| Атипия железистого эпителия: | |
| ASC-H | HPV-тест + кольпоскопия с биопсией. |
| LSIL | HPV-тест (-), повторное цитологическое обследование через 6 месяцев. |
| HSIL | HPV-тест+ кольпоскопия с биопсией. |
| Плоскоклеточная карцинома | Оперативное лечение |
| Атипия цервикальных клеток, возможно неоплазия; Эндоцервикальная аденокарцинома in situ Эндоцервикальная аденокарцинома | Кольпоскопия с конусовой радиоволновой эксцизией/гистероскопия с раздельным диагностическим выскабливанием цервикального канала и полости матки. |
| Эндометриальная аденокарцинома | Гистероскопия, раздельное диагностическое выскабливание цервикального канала и полости матки. |




Для получения профессиональной консультации обращайтесь к гинекологам нашей клиники.



















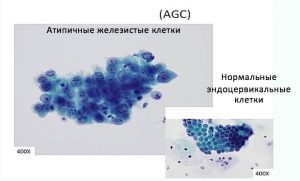 Критерии AGC:
Критерии AGC: