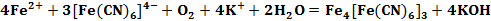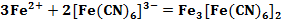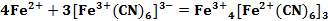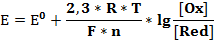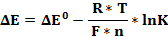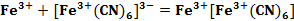Берлинская лазурь что это в медицине
Берлинская лазурь что это в медицине
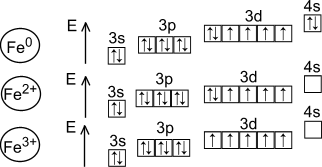
Железо – второй по распространенности элемент-металл в земной коре. На его долю приходится порядка 5,08 % по массе. Железо относится к группе переходных металлов, занимая место в 8 группе 4-го периода ПСХЭ [1]. У данного элемента идет заполнение предвнешнего d-подуровня по схеме (см. рисунок 1). Также на рисунке представлены электронные конфигурации внешних и предвнешних слоев катионов Fe2+ и Fe3+.
Рисунок 1 – электронная конфигурация предвнешнего и внешнего уровней железа
Такое электронное строение позволяет металлу активно вступать в реакции комплексообразования [1]. Одними из распространенных в химической практике соединений железа являются его комплексы с CN– (цианид-ионом), более известные как гексацианоферрат (II) калия (желтая кровяная соль) и гексацианоферрат (III) калия (красная кровяная соль). Данные комплексные частицы достаточно устойчивы: Кнест ([Fe(CN)6]4-) = 10-24 Кнест ([Fe(CN)6]3-) = 10-31 [2].
Первые упоминания пигмента «Берлинская лазурь» датируются началом 18 века. Он был получен путем добавления солей железа (II) к желтой кровяной соли с сопутствующим окислением ионов Fe2+ (см. формула 1) [3].
Также было установлено, что в результате реакции Fe2+ с красной кровяной солью образуется соединение, по цвету очень похожее на «Берлинскую лазурь» (см. формула 2). Оно получило название «Турнбулева синь» [3].
Описанные выше реакции (см. формула 1, 2) применяются в аналитической химии для качественного определения солей двух- и трехвалентного железа.
Вплоть до 20 века считалось, что «Берлинская лазурь» и «Турнбулева синь» – это два разных соединения, исходя из способов получения. Однако после измерения магнитных моментов было установлено, что в результате двух реакций (см. формула 1, 2) образуется в осадке вещество состава Fe4[Fe(CN)6]3. При добавлении в раствор красной кровяной соли ионов Fe2+ не происходит образования гипотетического соединения состава Fe3[Fe(CN)6]2, как это считалось раньше. В процессе данной реакции происходит перенос электрона от Fe2+ к [Fe(CN)6]3- (см. формула 3) [3].
Цель данной работы – выяснить и доказать наличие окислительно-восстановительного процесса в реакции, в результате которой образуется «Берлинская лазурь», при помощи изменения соотношения концентраций редокс пар Fe2+/ Fe3+ и [Fe(CN)6]4-/[Fe(CN)6]3- в системе.
Каждая редокс пара характеризуется своим стандартным электродным потенциалом (E0), измеренным относительно электрода сравнения. Электрический потенциал (E) зависит от количества электронов, участвующих в реакции; температуры; концентрации компонентов. Все виды зависимости можно изобразить в виде уравнения Нернста, которое имеет следующий вид (см. формула 4) [4]:
где Е0 – стандартный электродный потенциал; R – универсальная газовая постоянная; T – абсолютная температура окружающей среды; F – постоянная Фарадея; n – число электронов, участвующих в полуреакции; [Ox] – равновесная концентрация окисленной формы; [Red] – равновесная концентрация восстановленной формы.
В окислительно-восстановительной реакции участвуют две редокс пары. Степень протекания и направление реакции определяются разностью электродных потенциалов окислителя и восстановителя: ΔЕ=Еок-Ев. Если данная величина положительна, то реакция идет в прямом направлении, если же она отрицательна – в обратном. При нулевом значении устанавливается динамическое равновесие [4].
Степень протекания оценивается при помощи следующего выражения (см. формула 5) [4]:
где ΔЕ0 – стандартная ЭДС реакции; R – универсальная газовая постоянная; T – абсолютная температура окружающей среды; F – постоянная Фарадея; n – число электронов, участвующих в полуреакции; К – термодинамическая константа равновесия реакции.
Если разность ΔЕ больше 0,6 В, то данную ОВР можно считать практически «необратимой»: она идёт до конца и при достижении равновесия можно обнаружить только конечные продукты, независимо от начальных концентраций [4].
В конкретной задаче ox: Fe3+, [Fe(CN)6]3- ; red: Fe2+, [Fe(CN)6]4-. Используя табличные значения E0, выяснил, что E0 (Fe2+/ Fe3+) = 0,771 В и E0 ([Fe(CN)6]4-/[Fe(CN)6]3-) = 0,36 В [5].
Согласно уравнению (см. формула 3), Fe2+ – восстановитель, [Fe(CN)6]3- – окислитель. ΔЕ0=0,36–0,771=-0,411 0
Выпадение темно-синего осадка
Согласно вычисленным электродным потенциалам (Е) при помощи уравнения Нернста (см. формула 4), ни в одном случае течение реакции (см. формула 3) в прямом направлении невозможно, что и было доказано в ходе эксперимента. Из вышеизложенного можно сделать вывод, что в реакции (см. формула 3) происходит окислительно-восстановительный процесс с образованием в осадке «Берлинской лазури».
Окислительно-восстановительная реакция (см. формула 3) протекает практически мгновенно, обратную реакцию возможно осуществить в вакууме при Т = 573 К (300 оС) [3].
Данный эксперимент не ставит под сомнение использование гексацианоферрата (III) калия (красной кровяной соли) как реагента при определении ионов Fe2+, так как течение реакции (см. формула 3) возможно при концентрации Fe3+ не более 2,4*10-4 М. При смешении растворов Fe3+ и красной кровяной соли образуется осадок (см. формула 9):
Установить истинное строение «Турнбулевой сини» удалось при помощи гамма-резонансной (мёссбауэровской) спектроскопии. В данном опыте специально были получены осадки, меченные изотопом Fe57 (мёссбауэровский изотоп). В результате было установлено, что в различных цианидах железа атомы Fe (II)окружены шестью атомами углерода, а в ближайшем соседстве с атомами Fe (III)находятся только атомы азота. Это означает, что шесть цианидных ионов в красителе связаны всегда с атомами железа (II), то есть правильна формула 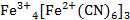
Таким образом, можно с уверенностью сказать, что при реакции солей Fe2+ с гексацианоферратом (III) калия (красной кровяной солью) образуется осадок гексацианоферрата (II) железа (III), то есть «Берлинская лазурь».