Бензол что это такое
Бензол: использование в промышленности и воздействие на человека
Бензол — углеводород, представитель ароматических (бензольных) соединений. Представляет собой бесцветную, прозрачную, сильно преломляющую свет легкоподвижную жидкость с характерным «ароматическим» запахом; легко испаряется при обычной комнатной температуре; кипит при температуре 80,5°С и застывает на холоде в кристаллическую массу, плавящуюся при +6°С; легко растворим в эфире, спирте, хлороформе и других растворителях, за исключением воды. Бензол — растворяющее средство для жиров, смол, масел, асфальта, алкалоидов, серы, фосфора, йода; на воздухе горит светлым, сильно коптящим пламенем и дает легко воспламеняющиеся пары.
Использование в промышленности
Бензол — один из наиболее распространенных химических продуктов и самое распространенное ароматическое соединение. В физическом весе пластмасс около 30%, в каучуках и резинах — 66%, в синтетических волокнах — до 80% приходится на ароматические углеводороды, родоначальником которых является бензол.
Бензол является важнейшим сырьем для химической промышленности, поскольку он используется и как исходный реагент для синтеза самых разнообразных соединений, и как растворитель для других реакций (бензол растворяет практически все органические соединения, это своего рода «органическая вода»).
В настоящее время бензол применяется в основном в производстве этилбензола, кумола и циклогексана. На основе бензола по-прежнему получают различные полупродукты (сульфо-, нитро-, галоген-, алкил-, арил-, ацетилбензолы и др.), используемые в дальнейшем для получения синтетических каучуков, пластмасс, синтетических волокон, красителей, поверхностно-активных веществ (ПАВ), инсектицидов, лекарственных веществ.
Бензол широко применяется также в качестве растворителя и экстрагента в производстве лаков и красок; применяется как компонент моторного топлива для повышения октанового числа.
Воздействие на организм человека
Бензол высокотоксичен. При отравлении его парами обычно наблюдаются учащенное сердцебиение, сонливость, головокружение, головные боли, тремор и прочие симптомы отравления. Попадание бензола внутрь может вызвать поражение желудочно-кишечного тракта. Бензол оказывает угнетающее действие на функцию кроветворения, обладает канцерогенным действием.
Вдыхание паров бензола в осложненных случаях способно привести к летальному исходу.
Действие бензола на организм обладает свойством кумулятивности, иными словами, многократное воздействие малыми дозами суммируется.
Основной путь поступления в организм — в виде паров (через дыхательные пути) и в жидком состоянии (через кожу). Метаболизм бензола в организме происходит по-разному. Бензол окисляется до фенолов и полифенолов, которые связываются серной и глюкуроновой кислотами и в виде органических сульфатов выделяются с мочой.
Общий характер действия: наркотическое и отчасти судорожное. Бензол действует на нервную систему и органы кроветворения.
Острые отравления в производственных условиях возникают редко: при авариях, чистке цистерн из-под этих веществ, при применении их в составе быстро сохнущих красок при работе в замкнутых помещениях, при переливании в плохо вентилируемых помещениях.
Легкая форма отравления бензолом напоминает опьянение: могут наблюдаться головная боль, головокружение, звон в ушах, спутанность сознания, рвота. В более выраженных случаях — потеря сознания, мышечные подергивания, которые могут перейти в судороги, зрачки расширены, плохо реагируют на свет, дыхание учащено, затем замедляется, температура тела снижается, кожные покровы бледные. Пульс слабого наполнения, учащен, артериальное давление падает.
Хроническое отравление бензолом вызывает головную боль, головокружение, слабость, быструю утомляемость, раздражительность, расстройство сна, плохой аппетит, неприятные ощущения в области сердца, кровоточивость десен, носовые кровотечения, появление синяков на теле. Ранним признаком хронического отравления являются функциональные изменения нервной системы: неврастенический или астенический синдром с вегетативной дисфункцией.
При появлении симптомов отравления необходимо срочно обратиться в медицинское учреждение.
Материал подготовлен на основе информации открытых источников
Бензол
| Бензол | |
|---|---|
 | |
| Общие | |
| Другие названия | фен (Лоран, 1837), фениловый водород, бензен |
| Молекулярная формула | C6H6 |
| SMILES | c1ccccc1 C1=CC=CC=C1 |
| Молярная масса | 78,11 г/моль |
| Вид | Синяя жидкость |
| Регистрационный номер CAS | 71-43-2 |
| ГОСТ | 8448-78 |
| Свойства | |
| Плотность и фазовое состояние | 0,8786 г/см³=878,6 кг/м³, жидкость |
| Растворимость в воде | 1,79 г/л при 25 °C |
| Температура плавления | 5,5 °C |
| Температура кипения | 80,1 °C |
| Вязкость | 0,652 П при 20 °C |
| Опасность | |
| Описание | Токсичен, опасен для окружающей среды, огнеопасен |
| Температура воспламенения паров | −11 °C |
| Температура самовозгорания | 562 °C |
| Близкие вещества | |
| Близкие углеводороды | нафталин циклогексан |
| Производные | толуол |
| Если не указано другое, параметры даны для 25 °C, 100 кПа | |
Бензо́л (C6H6, PhH) — органическое химическое соединение, бесцветная жидкость с приятным сладковатым запахом. Простейший ароматический углеводород. Бензол входит в состав бензина, широко применяется в промышленности, является исходным сырьём для производства лекарств, различных пластмасс, синтетической резины, красителей. Хотя бензол входит в состав сырой нефти, в промышленных масштабах он синтезируется из других её компонентов. Токсичен, канцерогенен.
Содержание
История
Физические свойства
Бесцветная жидкость со своеобразным резким запахом. Температура плавления = 5,5 °C, температура кипения = 80,1 °C, плотность = 0,879 г/см³, молярная масса = 78,11 г/моль. Подобно ненасыщенным углеводородам бензол горит сильно коптящим пламенем. С воздухом образует взрывоопасные смеси, хорошо смешивается с эфирами, бензином и другими органическими растворителями, с водой образует азеотропную смесь с температурой кипения 69,25 °C (91 % бензола). Растворимость в воде 1,79 г/л (при 25 °C).
Химические свойства
Для бензола характерны реакции замещения — бензол реагирует с алкенами, хлоралканами, галогенами, азотной и серной кислотами. Реакции разрыва бензольного кольца проходят в жёстких условиях (температура, давление).
Катализаторы содействуют созданию активной электрофильной частицы путём поляризации между атомами галогена.
В отсутствие катализатора при нагревании или освещении идёт радикальная реакция замещения.
Структура
Бензол по составу относится к ненасыщенным углеводородам (гомологический ряд CnH2n-6), но в отличие от углеводородов ряда этилена C2H4 проявляет свойства, присущие ненасыщенным углеводородам (для них характерны реакции присоединения) только при жёстких условиях, а вот к реакциям замещения бензол более склонен. Такое «поведение» бензола объясняется его особым строением: нахождением всех связей и молекул на одной плоскости и наличием в структуре сопряжённого 6π-электронного облака. Современное представление об электронной природе связей в бензоле основывается на гипотезе Лайнуса Полинга, который предложил изображать молекулу бензола в виде шестиугольника с вписанной окружностью, подчёркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углерода цикла.
Производство
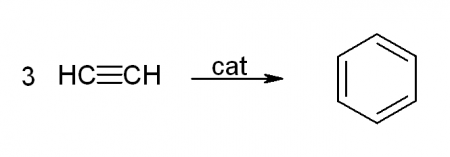
На сегодняшний день существует три принципиально различных способа производства бензола.
При пропускании ацетилена при 400°C над активированным углем с хорошим выходом образуется бензол и другие ароматические углеводороды:
Применение
Значительная часть получаемого бензола используется для синтеза других продуктов:
В существенно меньших количествах бензол используется для синтеза некоторых других соединений. Изредка и в крайних случаях, ввиду высокой токсичности, бензол используется в качестве растворителя. Кроме того, бензол входит в состав бензина. Ввиду высокой токсичности его содержание новыми стандартами ограничено введением до 1 %.
Биологическое действие
При непродолжительном вдыхании паров бензола не возникает немедленного отравления, поэтому до недавнего времени порядок работ с бензолом особо не регламентировался.
Бензол и токсикомания
Бензол оказывает на человека одурманивающее воздействие и может приводить к наркотической зависимости.
Бензол
| Бензол | |
|---|---|
 | |
   | |
| Систематическое наименование | бензол |
| Сокращения | PhH |
| Традиционные названия | фен (Лоран, 1837), фениловый водород, бензен |
| Хим. формула | C₆H₆ |
| Состояние | жидкость |
| Молярная масса | 78,11 г/моль |
| Плотность | 0,8786 г/см³ |
| Динамическая вязкость | 0,0652 Па·с |
| Энергия ионизации | 9,24 ± 0,01 эВ |
| Т. плав. | 5,5 °C |
| Т. кип. | 80,1 °C |
| Т. всп. | −11 °C |
| Т. свспл. | 562 °C |
| Пр. взрв. | 1,2 ± 0,1 об.% |
| Давление пара | 75 ± 1 мм рт.ст. |
| Растворимость в воде | 0,073 г/100 мл |
| ГОСТ | ГОСТ 5955-75 |
| Рег. номер CAS | 71-43-2 |
| PubChem | 241 |
| Рег. номер EINECS | 200-753-7 |
| SMILES | |
| Сигнальное слово | ОПАСНО! |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Бензол (C6H6, PhH) — органическое химическое соединение, бесцветная жидкость со специфическим сладковатым запахом. Простейший ароматический углеводород. Бензол входит в состав бензина, широко применяется в промышленности, является исходным сырьём для производства лекарств, различных пластмасс, синтетической резины, красителей. Хотя бензол входит в состав сырой нефти, в промышленных масштабах он синтезируется из других её компонентов. Токсичен, канцерогенен. Контаминант.
Содержание
История
Впервые бензолсодержащие смеси, образующиеся в результате перегонки каменноугольной смолы, описал немецкий химик Иоганн Глаубер в книге Furni novi philosophici, опубликованной в 1651 году. Бензол как индивидуальное вещество был описан Майклом Фарадеем, выделившим это вещество в 1825 году из конденсата светильного газа, получаемого коксованием угля. Вскоре, в 1833 году, получил бензол — при сухой перегонке кальциевой соли бензойной кислоты — и немецкий физико-химик Эйльгард Мичерлих. Именно после этого получения вещество стали называть бензолом.
К 1860-м годам было известно, что соотношение количества атомов углерода и атомов водорода в молекуле бензола аналогично таковому у ацетилена, и эмпирическая формула их — CnHn. Изучением бензола серьёзно занялся немецкий химик Фридрих Август Кекуле, которому в 1865 году и удалось предложить правильную — циклическую формулу этого соединения. Известна история о том, что Ф. Кекуле представлял в своём воображении бензол в виде змеи из шести атомов углерода. Идея же о цикличности соединения пришла ему во сне, когда воображаемая змея укусила себя за хвост. Фридриху Кекуле удалось в то время наиболее полно описать свойства бензола.
Физические свойства
Бесцветная жидкость со своеобразным резким запахом. Температура плавления = 5,5 °C, температура кипения = 80,1 °C, плотность = 0,879 г/см³, молярная масса = 78,11 г/моль. Подобно ненасыщенным углеводородам бензол горит сильно коптящим пламенем. С воздухом образует взрывоопасные смеси, хорошо смешивается с эфиром, бензином и другими органическими растворителями, с водой образует азеотропную смесь с температурой кипения 69,25 °C (91 % бензола). Растворимость в воде 1,79 г/л (при 25 °C).
Химические свойства
Для бензола характерны реакции замещения — бензол реагирует с алкенами, хлоралканами, галогенами, азотной и серной кислотами. Реакции разрыва бензольного кольца проходят в жёстких условиях (температура, давление).
В первой и второй реакциях образуется ацетофенон (метилфенилкетон), замена хлорида алюминия на хлорид сурьмы V позволяет снизить температуру протекании реакции до 25° С. В третьей реакции образуется бензофенон (дифенилкетон).
Реакции окисления
Бензол, вследствие своего строения, очень устойчив к окислению, на него не действует, например, раствор перманганата калия. Однако окисление до малеинового ангидрида можно провести при помощи катализатора оксида ванадия V:
Результатом реакции является образование диальдегида — глиоксаля (1,2-этандиаля).
Структура
Бензол по составу относится к ненасыщенным углеводородам (гомологический ряд CnH2n−6), но в отличие от углеводородов ряда этилена, C2H4, проявляет свойства, присущие ненасыщенным углеводородам (для них характерны реакции присоединения), только при жёстких условиях, а вот к реакциям замещения бензол более склонен. Такое «поведение» бензола объясняется его особым строением: нахождением атомов в одной плоскости и наличием в структуре сопряжённого 6π-электронного облака. Современное представление об электронной природе связей в бензоле основывается на гипотезе Лайнуса Полинга, который предложил изображать молекулу бензола в виде шестиугольника с вписанной окружностью, подчёркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углерода цикла.
В специальной и популярной литературе распространён термин бензольное кольцо, относящийся, как правило, к углеродной структуре бензола без учёта иных атомов и групп, связанных с атомами углерода. Бензольное кольцо входит в состав множества различных соединений.
Производство
На сегодняшний день существует несколько принципиально различных способов производства бензола.
Применение
Значительную часть получаемого бензола используют для синтеза других продуктов:
В существенно меньших количествах бензол используют для синтеза некоторых других соединений. Изредка и в крайних случаях, ввиду высокой токсичности, бензол используют в качестве растворителя.
Кроме того, бензол входит в состав бензина. В 1920-х — 1930-х годах, бензол добавляли ru de в прямогонный бензин для повышения его октанового числа, но к 1940-м годам такие смеси не выдержали конкуренции с высокооктановыми бензинами. Ввиду высокой токсичности содержание бензола в топливе ограничено современными стандартами введением до 1 %.
Биологическое действие и токсикология
Бензол является одним из самых распространённых ксенобиотиков антропогенного происхождения.
Бензол является сильным канцерогеном. Исследования показывают связь бензола с такими заболеваниями, как апластическая анемия, острые лейкозы (миелоидный, лимфобластный), хронический миелоидный лейкоз, миелодиспластический синдром и заболевания костного мозга.
Механизм трансформации и мутагенное воздействие бензола
Существует несколько вариантов механизма трансформации бензола в организме человека. В первом варианте происходит гидроксилирование молекулы бензола микросомальной системой окисления при участии цитохрома P450. Согласно механизму, бензол окисляется сначала до высокореакционного эпоксида, который далее преобразуется в фенол. Помимо этого происходит генерация свободных радикалов (активные формы кислорода), вследствие высокой активации Р450 по реакции:
Молекулярный механизм мутагенеза бензола
Механизм взаимодействия эпоксидного цикла, с нуклеофильными центрами — аминогруппами азотистых оснований (реакция арилирования) протекает, как реакция нуклеофильного замещения SN2. В результате образуются довольно прочные ковалентно-связанные ДНК-аддукты, наиболее часто такие дериваты наблюдаются у гуанина (так, как молекула гуанина имеет максимальное количество нуклеофильных центров), например, N7-фенилгуанин. Образовавшиеся ДНК-аддукты могут приводить к изменению нативной структуры ДНК, тем самым нарушается правильное протекание процессов транскрипции и репликации. Что является источником генетических мутаций. Накопление эпоксида в гепатоцитах (клетках печени) ведёт к необратимым последствиям: увеличению арилирования ДНК, а вместе с тем и к увеличению экспрессии (сверхэкспрессия) мутантных белков, являющихся продуктами генетической мутации; торможению апоптоза; трансформации клеток и даже гибели. Помимо яркой выраженной генотоксичности и мутагенности, бензол обладает сильной миелотоксичностью и канцерогенной активностью, особенно этот эффект проявляется в клетках миелоидной ткани (клетки данной ткани очень чувствительны к подобному роду воздействиям ксенобиотиков).
Бензол и токсикомания
Бензол оказывает на человека одурманивающее воздействие и может приводить к наркотической зависимости.
Острое отравление
Хроническое отравление
В тяжёлых случаях наблюдаются: головные боли, чрезвычайная утомляемость, одышка, головокружение, слабость, нервность, сонливость или бессонница, расстройство пищеварения, тошнота, иногда рвота, отсутствие аппетита, учащение мочеиспускания, менструаций, нередко развиваются упорные кровотечения из слизистой оболочки рта, особенно дёсен, и носа, длящиеся часами и даже сутками. Иногда упорные кровотечения наблюдаются после удаления зуба. Многочисленные мелкие геморрагии (кровоизлияния) в коже. Кровь в испражнениях, маточные кровотечения, кровоизлияния в сетчатку. Обычно именно кровотечения, а часто и сопутствующая им лихорадка (температура до 40° и выше) приводят отравленных в больницу. В подобных случаях прогноз всегда серьёзен. Причиной смерти иногда являются вторичные инфекции: известны случаи гангренозного воспаления надкостницы и некроза челюсти, тяжёлых язвенных воспалений дёсен, общего сепсиса с септическим эндометритом.
Иногда при тяжёлых отравлениях развиваются симптомы нервных заболеваний: повышение сухожильных рефлексов, двусторонний клонус, положительный симптом Бабинского, расстройство глубокой чувствительности, псевдотабетические расстройства с парестезиями, атаксией, параплегией и двигательными нарушениями (признаки поражения задних столбов спинного мозга и пирамидных путей).
Наиболее типичны изменения крови. Число эритроцитов обычно резко снижено, вплоть до 1—2 млн и ниже. Содержание гемоглобина также сильно падает, иногда до 10 %. Цветной показатель в части случаев низок, иногда близок к нормальному, а порой высок (особенно при сильной анемии). Отмечают анизоцитоз и пойкилоцитоз, базофильную пунктацию и появление ядерных эритроцитов, увеличение числа ретикулоцитов и объёма эритроцитов. Типичнее резкое уменьшение числа лейкоцитов. Иногда первоначально лейкоцитоз, быстро сменяющийся лейкопенией, ускорение СОЭ. Изменения со стороны крови развиваются не одновременно. Чаще всего раньше поражается лейкопоэтическая система, позже присоединяется тромбоцитопения. Поражение эритробластической функции часто наступает ещё позже. В дальнейшем может развиться характерная картина тяжёлого отравления — апластическая анемия.
Явления отравления могут сохраняться и даже прогрессировать через месяцы и годы после прекращения работы с бензолом.
Первая помощь при отравлении и лечение
При остром отравлении бензолом (парами бензола) пострадавшего необходимо в первую очередь вынести на свежий воздух, в случае остановки дыхания проводят искусственное дыхание до нормализованного, в качестве стимуляторов дыхания применяют кислород и лобелин. Применение адреналина в качестве аналептика категорически запрещено! При возникновении рвоты внутривенно 40% раствор глюкозы, в случае нарушения кровообращения — инъекцию раствора кофеина. Если отравление произошло перорально и бензол попал в желудок, необходимо промыть его с помощью растительного масла (хорошо абсорбирует бензол), процедуру следует проводить с осторожностью, так как возможна аспирация. При лёгких отравлениях больному показан покой. При возбуждённых состояниях необходимы седативные средства. При возникновении анемии проводят переливания крови, витамин B12, фолиевая кислота, при лейкопении — витамин B6, пентоксил. В случае снижения иммунитета (иммунодефицитное состояние) — иммуностимуляторы.
Действие бензола на биомембраны
Бензол является эффективным солюбилизатором биологических мембран, он быстро растворяет неполярные группы (т. н. углеводородные «хвосты») липидов, главным образом холестерина, входящего в состав мембран. Процесс солюбилизации лимитируется концентрацией бензола, чем его больше, тем быстрее протекает этот процесс. В процессе солюбилизации выделяется энергия, буквально, разрывающая двойной липидный слой (липидный бислой), что приводит к полной деструкции (разрушению структуры) мембраны и, последующему апоптозу клетки (в процессе деструкции биомембран происходит активация мембранных рецепторов (таких, как: CD95, TNFR1, DR3, DR4, и других), которые активируют апоптоз клетки).
Действие на кожу
При частом соприкосновении рук с бензолом наблюдаются сухость кожи, трещины, зуд, краснота (чаще между пальцами), отёчность, просовидные пузырьковые высыпи. Иногда из-за кожных поражений рабочие вынуждены бросать работу.
Безопасность
Работа с применением бензола сопряжена с риском отравления и серьёзного ухудшения здоровья. Бензол — легколетучая жидкость (летучесть 320 мг/л при 20 °С) с высокой степенью воспламенения, поэтому при работе с ним необходимо соблюдать технику безопасности работ с легковоспламеняющимися жидкостями. Большую опасность представляют пары бензола, так как они могут образовывать взрывоопасные смеси с воздухом. В настоящее время применение бензола в качестве органического растворителя сильно ограничено, ввиду токсичности и канцерогенного воздействия его паров и негативном воздействии на кожу. Работа с бензолом в лабораториях также предусматривает его ограничение (строго регламентирована). Бензол рекомендуется использовать в экспериментах лишь в небольших объёмах (не более 50 мл), работа должна проводиться исключительно в перчатках из фторкаучука (латекс растворяется и набухает при воздействии на него бензолом).
Экология
Бензол экологически небезопасное вещество, токсикант антропогенного происхождения. Основными источниками бензола, поступающего в окружающую среду со сточными водами или выбросами в атмосферу, являются нефтехимические и коксохимические промышленные предприятия, производство топлива и транспорт. Из водоёмов бензол легко улетучивается, cпособен к трансформации из почв в растения, что несёт серьёзную угрозу экосистемам.
Бензол обладает свойством кумуляции, вследствие своей липофильности он способен депонироваться в клетках жировой ткани животных, тем самым отравляя их.