Белки теплового шока что это
Белки теплового шока что это
К.Д. Никитин
«Клиническая онкогематология», апрель 2008
Как и многие другие открытия, белки теплового шока были обнаружены во многом благодаря случайности, когда однажды вечером в одной из итальянских лабораторий кто-то случайно установил слишком высокую температуру в инкубаторе с плодовыми мушками Drosophila. На следующий день при исследовании хромосом из слюнных желез мушек были выявлены интересные изменения, свидетельствующие о необычном характере экспрессии генов. Так было положено начало изучению группы белков, названных белками теплового шока (БТШ).
Название отражает некоторые свойства белков теплового шока, но далеко не все. Во-первых, БТШ синтезируются в некотором количестве постоянно в любых ядерных клетках, во множестве внутриклеточных структур (в цитоплазме, ядре, эндоплазматическом ретикулуме, митохондриях и хлоропластах) у всех многоклеточных организмов, начиная с самых примитивных, как у растений, так и у животных, вне зависимости от воздействия стрессовых факторов. Даже в покоящихся клетках до 2% всех белков могут составлять представители этого семейства.
Во-вторых, повышение внутриклеточного синтеза БТШ происходит отнюдь не только на тепловой шок, но и на любое стрессовое воздействие: внешнее (УФ, тепловой шок, тяжелые металлы, аминокислоты), патологическое (вирусные, бактериальные и паразитарные инфекции, лихорадка, воспаление, злокачественная трансформация, аутоиммунные реакции) или даже физиологическое (ростовые факторы, клеточная дифференциация, гормональная стимуляция, тканевый рост). Синтез БТШ является универсальным неспецифическим ответом клетки на стресс, и, по современным данным, нет такого вида клеточного стресса, при котором не происходило бы синтеза БТШ. В некоторых случаях содержание БТШ в клетках, подвергнутых шоку, может достигать 20% всех растворимых цитоплазматических белков.
Выделяют четыре основных семейства БТШ:
Несмотря на общую задачу всех этих белков (обеспечение выживания клетки в условиях стресса), функции и тканеспецифичность БТШ варьируют от группы к группе как в нормальных условиях, так и при стрессе.
Белки теплового шока
Белки теплового шока (англ. HSP, Heat shock proteins ) — это класс функционально сходных белков, экспрессия которых усиливается при повышении температуры или при других стрессирующих клетку условиях. [1] Повышение экспрессии генов, кодирующих белки теплового шока, регулируется на этапе транскрипции. Чрезвычайное усиление экспрессии генов, кодирующих белки теплового шока является частью клеточного ответа на тепловой шок и вызывается в основном фактором теплового шока (HSF англ. heat shock factor ). [2] Белки теплового шока обнаружены в клетках практически всех живых организмов, от бактерий до человека.
Белки теплового шока называют согласно их молекулярным массам. Например, наиболее изученные белки теплового шока Hsp60, Hsp70 и Hsp90 относятся к семействам белков с молекулярными массами 60, 70 и 90 кДа, соответственно. [3] Убиквитин является относительно небольшим белком (8 кДа), выполняющим функции белков теплового шока. Убиквитином в клетке помечаются белки, предназначенные для деградации. [4]
Содержание
История открытия
Было показано, что быстрое нагревание до сублетальных температур делает организмы нечувствительными к нагреванию до более высоких температур. В 1962 году Ритосса показал, что нагревание и ингибитор метаболизма динитрофенол вызывают сходные изменения в структуре пуффов политенных хромосом Дрозофилы. Это открытие далее привело к выделению белков теплового шока англ. heat-shock proteins (HSP) или белков стресса. Повышение экспрессии генов, кодирующих указанные белки у Дрозофилы было показано в 1974 году. Экспрессия повышалась после действия на мух стрессирующих факторов, например, теплового шока. [5]
Начиная с середины 1980-х годов было показано, что многие белки теплового шока действуют как шапероны и играют важную роль в сворачивании белков, внутриклеточном транспорте белков и ренатурации белков, изменивших конформацию после теплового шока.
Функции
Механизм активации
Точный механизм, по которому тепловой шок активирует экспрессию генов белков теплового шока, не выяснен. Однако, некоторые исследования свидетельствуют о том, что активация белков теплового шока происходит неправильно сложенными или поврежденными белками.
Повышение синтеза при стрессе
Высокие уровни белков теплового шока в клетке наблюдают после воздействия различных стрессирующих факторов — при инфекциях, воспалительных процессах, внешних воздействиях токсинов (этанол, мышьяк, тяжелые металлы), при ультрафиолетовом облучении, голодании, гипоксии, недостатке азота (у растений) или нехватке воды. Белки теплового шока называют белками стресса, так как повышение экспрессии соответствующих генов часто наблюдается при ответе на стресс. [6]
Шапероны
Белки теплового шока действуют как внутриклеточные шапероны в отношении других белков. Белки теплового шока играют важную роль в белок-белковых взаимодействиях, например, при фолдинге и сборке сложных белков, препятствуют нежелательной агрегации белков. Белки теплового шока стабилизируют частично свернутые белки и облегчают их транспорт через мембраны внутри клетки. [7] [8]
Некоторые белки теплового шока экспрессируются в малых или умеренных количествах во всех типах клеток всех живых организмов, так как играют ключевую роль в существовании белков.
Внутриклеточные функции
Белки теплового шока присутствуют в клетках и при нестрессовых условиях, как бы следят за белками в клетке. Белки теплового шока утилизируют старые белки в составе протеасомы и помогают корректно свернуться заново синтезированным белкам.
Сердечно-сосудистая система
По-видимому, белки теплового шока играют важную роль в сердечно-сосудистой системе. Для белков теплового шока hsp90, hsp84, hsp70, hsp27, hsp20, и альфа-B-кристаллин показана роль деятельности сердечно-сосудистой системы. [9]
Hsp90 связывает эндотелиальную синтетазу оксида азота и гуанилатциклазу, которые в свою очередь участвуют в расслаблении сосудов. [10]
В системе передачи сигнала при помощи оксида азота далее протеинкиназа G фосфорилирует малый белок теплового шока, hsp20, который принимает участие в расслаблении гладких мышц. [11] Hsp20 по-видимому, играет важную роль в развитии гладких мышц и предотвращает агрегацию тромбоцитов, предотвращает апоптоз после ишемического инсульта, а также имеет значение в функционировании скелетных мышц и ответе мышц на инсулин. [12]
Hsp27 является главным фосфопротеином при мышечном сокращении. [13]
Иммунитет
Внеклеточные и связанные с плазматической мембраной, белки теплового шока, и особенно Hsp70, участвуют в связывании и презентации антигенов. [14]
Клиническое значение
Фактор теплового шока 1 (англ. HSF1 ) является транскрипционным фактором, регулирующим экспрессию гена Hsp70. [15] Было показано, что HSF1 является многосторонним фактором канцерогенеза. Мыши, нокаутные по гену HSF1 имели сниженные уровни возникновения раковых опухолей после нанесения мутагена 7,12-диметилбенантрацена. [16]
Применение
Так как некоторые белки теплового шока играют роль в презентации антигенов, [14] их используют в качестве адъювантов для вакцин. [17] Более того, некоторые исследователи считают, что белки теплового шока могут принимать участие в связывании белковых фрагментов разрушенных опухолевых клеток, осуществляя презентацию антигена иммунной системе. [18] Некоторые белки теплового шока могут повышать эффективность вакцин против рака. [14] [19]
Противораковые препараты
Внутриклеточные белки теплового шока экспрессируются в раковых клетках и необходимы для выживания этих клеток. Показана роль малых молекул, ингибирующих белки теплового шока в качестве противораковых средств. [20] Эффективный ингибитор Hsp90 17-N-аллиламино-17-деметоксигельданамицин проходит клинические испытания как средство против некоторых видов рака. [21]
Применение в сельском хозяйстве
Исследована роль белков теплового шока в устойчивости к стрессу у гибридов растений, что может далее привести к выведению засухоустойчивых сортов, растущих на бедной почве. [22]
Классификация
Белки теплового шока, которые имеют функции шаперонов, классифицируют в пять классов: HSP33,HSP60, HSP70, HSP90, HSP100, и малые белки теплового шока (sHSPs). [5]
| Ориентировочная молекулярная масса, кДа | Прокариотические белки | Эукариотические белки | Функция |
|---|---|---|---|
| 10 кДа | GroES | Hsp10 | |
| 20-30 кДа | GrpE | Группа белков теплового шока HspB включает десять представителей у млекопитающих, в их числе Hsp27 | |
| 40 кДа | DnaJ | Hsp40 | Кофактор Hsp70 |
| 60 кДа | GroEL, антиген массок 60 кДа | Hsp60 | Участвует в фолдинге белков после их посттрансляционного транспорта в митохондрию или хлоропласт |
| 70 кДа | DnaK | Группа белков теплового шока HspA. Включает в себя Hsp71, Hsp70, Hsp72, Grp78 (BiP). Причем Hsx70 обнаружен только у приматов | Принимает участие в сворачивании и разворачивании белков, обеспечивает клетке нечувствительность к нагреванию. Предотвращает сворачивание белков в ходе посттрансляционного транспорта в митохондрии и хлоропласты. |
| 90 кДа | HtpG, C62.5 | Группа белков теплового шока HspC, включает в состав Hsp90, Grp94 | Поддержание структуры стероидных рецепторов и факторов транскрипции |
| 100 кДа | ClpB, ClpA, ClpX | Hsp104, Hsp110 | Обеспечивает невосприимчивость к повышению температуры |
Многие белки, представленные в таблице имеют разновидности, получающиеся в результате альтернативного сплайсинга, например, Hsp90α и Hsp90β.
Белки теплового шока что это
Белки теплового шока (heat shok proteins HSPs) широко распространены в живой природе и являются одними из наиболее консервативных молекул биосферы. Основная функция HSPs — защита биологических систем от повреждающих стрессорных воздействий. В процессе эволюции эукариот некоторые HSPs приобрели функции, позволившие им интегрироваться в систему иммунитета.
Роль HSPs во взаимодействии механизмов врожденного и приобретенного иммунитета определяется способностью HSPs перехватывать антигенные пептиды и репрезентировать их с помощью ДК Т-лимфоцитам в контексте молекул МНС.
Белки теплового шока обеспечивают важные жизненные функции и представлены у всех живых организмов. Продукты генов, наименованные белками теплового шока или белками клеточного стресса, вырабатываемые в условиях гипертермии, изначально были идентифицированы как молекулы, вырабатываемые в ответ на присутствие в клетках белков с нарушенной конформацией. Затем было установлено, что HSPs играют роль шаперонов в нековалентной сборке и демонтаже других макромолекулярных структур, хотя сами не являются перманентными компонентами этих структур при выполнении своих биологических функций.
Реакция белков теплового шока зафиксирована не только в условиях гипертермии, но также при оксидативном стрессе, ацидозе, ишемии, гипоксии-гипероксии, энергетическом истощении клеток и т п. В этих условиях HSPs высвобождаются из некротизированных клеток при разрушении ткани или лизисе инфицированных клеток.
Благодаря особенности распознавания гидрофобных аминокислотных последовательностей на поверхности белков, как предупредительного сигнала о конформационной их нестабильности, HSPs способны осуществлять такие жизненно важные функции, как участие в обеспечении пространственной организации белковых молекул (фолдинге), их стабилизации, коррекции конформационных изменений (рефолдинге), транслокации белков через мембраны внутриклеточных органелл, предотвращении белковой агрегации и деградации нестабильных белков. Наряду с этим, HSPs проявляют антиапоптотическую активность. В совокупности, HSPs выполняют роль буферной системы, противодействующей стохастическим и потенциально дестабилизирующим факторам клеточного окружения.
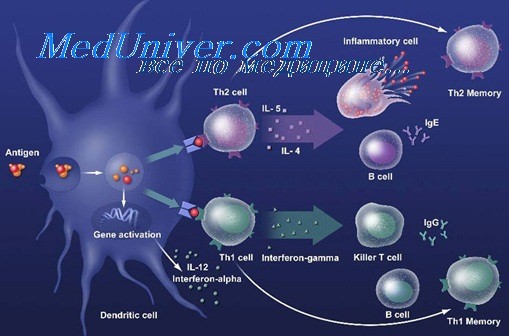
HSPs играют важную роль в индукции иммуного ответа, в особенности врожденного иммунитета: усиливают активность NK-клеток, созревание АПК и продукцию цитокинов. Пептидные фрагменты расщепляющихся белковых молекул перехватываются HSPs и, в конечном итоге, претерпевая процессинг в АПК, индуцируют реакции адаптивного иммунитета. Таким образом, через активацию АПК и участие в процессинге антигена белки теплового шока интегрируют реакции врожденного и приобретенного (адаптивного) иммунитета.
Иммуностимулирующие свойства проявляют HSP про- и эукаритического происхождения. Способностью к индукции иммунного ответа обладают представители нескольких семейств HSP (кальретикулин, HSP10, HSP60, HSP70, HSP90, HSP100 и HSP170).
Шаперонная функция белков теплового шока осуществляется не только в процессе биогенеза других белков, но и при иммунном ответе на антигены. Изменение окружающей среды при инфицировании создает стрессорную ситуацию как для вторгшегося патогена, так и для клеток хозяина, что проявляется в обоюдной интенсификации синтеза и функциональной активности белков теплового шока. Молекулярные шапероны бактерий выступают в роли лигандов для рецепторов на поверхности клеток хозяина.
HSPs могут быть распознаны TLR2, TLR4. Другие др96, HSP90 и HSP70, взаимодействуют с антигенпрезентирующими клетками через общий рецептор, CD91. HSP-шаперонные пептиды проникают в макрофаг/дендритные клетки через CD91, процессируются и презентируются вместе с молекулами МНС I и МНС II. Это вызывает активацию CD4 и CD8 Т-клеток. HSP-ДК взаимодействие через CD91 ведет к созреванию дендритных клеток и секреции ряда цитокинов.
В результате взаимодействия рекомбинантного HSP 70 М tuberculosis с TLR-2 и TLR-4 in vitro запускается сигнальный каскад с вовлечением адапторных белков MyD88, TIRAP, TRIF и TRAM в эндотелиоцитах человека и в макрофагах мышей происходит активация фактора транскрипции NF-кВ.
Представленный в эндоплазматическом ретикулуме эукариот, шаперон GRP94/gp96 через взаимодействие с TLR-2 и TLR-4 активирует дендритные клетки к инициации CD8′ Т-лимфоцитарного ответа. При этом усиливается экспрессия MICA/B молекул, взаимодействующих с NKG2D рецептором, представленным на поверхности CD8, но не СD4*Т-клеток. При взаимодействии TLR7 с HSP70, активно секретируемым, так и освобождаемым при некротической гибели клеток млекопитающих, усиливается фагоцитарная функция макрофагов. Данный эффект проявляется за несколько минут и выражается не только в стимуляции фагоцитоза, но также и функции представления антигена Т-клеткам через сигнальные пути, опосредуемые фосфоинозитид 3-киназой и р38 МАР-киназой.
В осуществлении презентации антигена хелперным Т-клеткам принимают участие также зрелые В-лимфоциты, экспрессирующие TLR-2 и TLR-4. Они отвечают на LPS, пептидогликан, HSP60 повышением экспрессии МНС II и костимуляторных молекул. HSP 60 человека, но не GroEL E. coli или HSP65 М. tuberculosis индуцируют пролиферацию наивных В-клеток мышей и секрецию ими IL-6 и IL-10.
На сегодняшний день многие рецепторы, распознающие паттерны известных PAMPs прокариотов, грибков, вирусов, простейших патогенов остаются еще не охарактеризованными. Существует взаимосвязь между фагоцитозом и экспрессией TLRs, поскольку активация сигналов через TLR усиливает фагоцитарные процессы, а фагоцитоз модулирует последовательность активации TLR.
Является очевидным, что еще неопределенные молекулярные паттерны могут искажать или направлять адаптивный имунный ответ по Тh-2 типу Возможно, что отсутствие сигналов (например — PAMPs), подобно дефициту своих МНС I для NK-клеточной активации является стимулом для запуска иммунитета второго типа.
Индукция сигналов через Toll-подобные рецепторы может обеспечивать не только защиту организма от различных инфекций. Нарушение функции проводимости данных сигналов приводит к развитию целого ряда патологических процессов в организме. Например, чрезмерная продукция провоспалительных цитокинов эндогенными лигандами может стать причиной развития хронического воспаления, аутоиммунных заболеваний, таких как болезнь Крона, диабет типа 1, атеросклероз. Изменение баланса в сторону провоспалительных цитокинов, вероятно, обусловлено развитием локальных отеков и воспалительных реакций в ЦНС инициированных провоспалительными цитокинами (TNF-a или IL-1p). В формировании длительно сохраняющихся неврологических нарушений принимают участие несколько цитокинов, которые потенцируя продукцию и действие друг друга, дольше сохраняются в циркуляции.
Постоянное присутствие цитокинов поддерживает хронический воспалительный процесс в ЦНС, сопровождающийся демиелинизацией, а в ряде случаев и гибелью нейронов.
Как клетки выбирают путь спасения при стрессе

Рис. 1. HSP70 подавляет развитие аутофагии. (А) В клетках запускали аутофагию, помещая их в условия дефицита питательных веществ (EBSS+). В некоторых случаях в клетках экспрессировали HSP70 (Ad70+). Количество модифицированного LC3 (LC3-II, по оси ординат), который является маркером аутофагии, измеряли с помощью иммуноблоттинга спустя 2 часа после индукции аутофагии. Если сравнить голодающие клетки, в которых экспрессирован HSP70 (Ad70+, EBSS+), с клетками, которые голодают без HSP70 (Ad70-, EBSS+), то видно, что аутофагия в последнем случае сильнее. Значит, HSP70 ингибирует аутофагию. (Б) В клетках, помещенных в условия недостатка питательных веществ (Ad70-/EBSS+), запускается аутофагия. Об этом говорят красные точки — аутофагосомы. В клетках окрашен белок LC3, который находится в аутофагосомах. Если в голодающих клетках экспрессируется HSP70, то аутофагосом становится меньше. Это подтверждает, что HSP70 ингибирует аутофагию. Рисунок из обсуждаемой статьи в Journal of Biological Chemistry с изменениями
Два механизма помогают нашим клеткам выжить при стрессе — белки теплового шока (задача которых — сохранить структуру других белков) и аутофагия (самопереваривание частей клетки). Связаны ли эти системы между собой? Как клетка может сделать выбор в пользу одной из них? Оказывается, белки теплового шока управляют аутофагией, не давая клетке принять радикальные меры там, где достаточно легкой починки.
Организмы часто попадают в неблагоприятные условия, и должны каким-то образом бороться с ними, чтобы выжить. Если рассматривать эту проблему на уровне отдельной клетки, то стресс (например, повышение температуры) может нарушить структуру белков — элементарных винтиков клеточной машины. Нарушение структуры многих белков выливается в сбои целых метаболических путей, появлению свободных радикалов (так называемому окислительному стрессу) и повреждению отдельных органелл клетки (в первую очередь, митохондрий). В процессе эволюции живых организмов возникло множество механизмов защиты от подобных негативных последствий стресса.
Один из механизмов выживания клетки в экстремальных условиях связан с так называемыми белками теплового шока (БТШ, HSP — Heat shock protein). Их задача — контролировать правильное сворачивание белковых молекул. При повышении температуры, как и при целом ряде других возможных воздействий на клетку, белки разворачиваются, теряя правильную структуру, а при понижении температуры могут неправильно свернуться обратно, что помешает нормальному функционированию белка. (Все сталкивались с этим эффектом в быту: белки куриного яйца при варке приобретают другую структуру, за счет чего содержимое яйца затвердевает.) В таком случае белки теплового шока связываются с развернутым белком и удерживают его от слишком быстрого сворачивания, которое, скорее всего, окажется неправильным. Некоторые БТШ представляют собой большую бочку, внутри которой белок может спокойно свернуться. Если же после нескольких попыток белок всё равно оказывается свернут неправильно, то БТШ направляют его на уничтожение. На самом деле, белки, регулирующие структуру белка (шапероны), в том числе БТШ, работают в клетке и в нормальных условиях. Однако в условиях стресса, когда риск нарушения структуры белков повышается, роль БТШ усиливается и их количество увеличивается.
Недостаток питательных веществ — тоже один из типов стресса. В этом случае в клетке может возникнуть необходимость «разобрать» некоторые органеллы на отдельные молекулы и использовать получившийся «строительный материал». Такое часто происходит при травмах или инфекционных заболеваниях (которые сопровождаются и снижением аппетита). Разрушение белков до аминокислот в одной части организма требуется для поддержания их усиленного синтеза в поврежденной части, а также для синтеза антител, необходимых для защиты от инфекции. Для обеспечения клеток строительным материалом в таких экстренных случаях предусмотрен механизм аутофагии.
Существует как минимум два разных типа аутофагии — микро- и макроаутофагия. Первый позволяет направить в лизосому (клеточную органеллу, содержащую ферменты для расщепления белков, жиров и углеводов) для уничтожения отдельные белковые молекулы. Такой путь называет аутофагией, опосредованной шаперонами (CMA, chaperone-mediated autophagy). Он запускается при активном участии Hsc70 (это белок-шаперон, родственник HSP70, одного из БТШ). Этот шаперон направляет белок, который необходимо уничтожить, к поверхности лизосомы. Здесь находится рецептор LAMP-2A, способствующий деградации белка-мишени внутри лизосомы. Этот путь хорошо изучен, и в нём центральная роль принадлежит шаперонам, что вполне объяснимо, поскольку как было сказано выше, шапероны (например, БТШ) могут «направлять на уничтожение» неправильно свёрнутые белки, и логично было бы предположить, что при определенном изменении условий функционирование шаперонов может измениться таким образом, что «черная метка» будет прикрепляться и к правильно свёрнутым белкам тоже.
Второй тип аутофагии связан с образованием мембранной структуры — аутофагосомы — вокруг той части клетки, которую предполагается уничтожить. В этом процессе играют роль белки семейства Atg (один из них — LC3, являющийся маркером начала аутофагии). Интересно, что эти белки — родственники убиквитина, который участвует в уничтожении белков-мишеней протеасомой. Убиквитин, на который похож белок LC3, — это та самая молекулярная «метка смерти», которая обеспечивает его узнавание и, в конечном итоге, разрушение протеасомой. Следовательно, две системы — протеасомы и аутофагия — оказываются как бы родственниками: они регулируются сходным образом, а также выполняют сходные функции.
В последнее время аутофагия всё чаще привлекает внимание исследователей. Нарушения в молекулярных механизмах ее запуска связаны со старением, развитием рака и нейродегенеративных заболеваний. Например, было доказано, что усиление аутофагии при травмах спинного мозга связано с ускорением восстановления нарушенных функций (см.: Kanno et al., 2012. The role of mTOR signaling pathway in spinal cord injury).
Таким образом, у клетки есть два пути спасения в условиях стресса — прибегнуть к помощи БТШ или же запустить аутофагию. В эволюции эти два пути появились в разное время. БТШ — древний механизм, имеющийся не только у эукариот, но и у бактерий. А вот аутофагия появилась только у эукариот. Есть мнение, что все механизмы, необходимые для данного процесса, существовали уже у последнего общего предка всех эукариот. Аутофагии нет только у сильно деградировавших облигатных внутриклеточных паразитов, таких как некоторые микроспоридии.
Среди предположений по поводу роли макроаутофагии первое и самое очевидное — поддержание жизни в неблагоприятных условиях за счет использования частей клетки. Прежде всего, речь идет о получении аминокислот для построения новых белков. С другой стороны, аутофагия может быть древнейшей системой защиты клеток от «вторжения извне», если вместе с частью цитоплазмы будут захвачены вирусы или другие внутриклеточные паразиты.
Могут ли самопереваривание при помощи аутофагии и починка при помощи БТШ уживаться друг с другом? Есть ли контроль одного процесса со стороны другого? Существует ряд работ, посвященных этой проблеме. Например, недавно была показана роль HSP70 в развитии аутофагии в клетках сердца (кардиомиоцитах) (см.: Hsu et al., 2013. Attenuating heat-induced cellular autophagy, apoptosis and damage in H9c2 cardiomyocytes by pre-inducing HSP70 with heat shock preconditioning). Если клетки нагревали до высокой температуры (44°C), развивалась сильная аутофагии, и клетки гибли. Однако если предварительно клетки держали при 37°C (что приводило к активному синтезу БТШ), то при последующем сильном увеличении температуры снижалась интенсивности аутофагии и выживаемость клеток увеличивалась. Судя по всему, БТШ могут смягчать проявления аутофагии в определенных условиях.
В этой работе, как и в некоторых других, в качестве индуктора аутофагии выступало повышение температуры. Однако, как было сказано, вероятнее всего в процессе эволюции аутофагия развилась как приспособление к недостатку питательных веществ. В таком случае между БТШ и аутофагией нет очевидной связи. Удивительно, но только недавно появилась работа исследователей из США и Дании, которые занялись исследованием этого вопроса.
Один из важных белков теплового шока — HSP70. Он играет важную роль в «спасении» клетки при повышении температуры, а также при отравлении тяжелыми металлами, которые также нарушают структуру белков. Сначала исследователи проверили, может ли HSP70 влиять на аутофагию в культуре клеток. В качестве индуктора аутофагии использовали голод: клетки росли в среде, не содержащей питательных веществ. Аутофагию можно зафиксировать, наблюдая за белком LC3 (он один из участников этого процесса и родственник убиквитина). При развитии аутофагии происходит модификация этого белка. Количество модифицированного белка можно определить методом иммуноблоттинга. Уже через 2 часа в голодающих клетках аутофагия становилась хорошо заметной (рис. 1А). Но если в таких клетках увеличить количество HSP70, то аутофагия замедлялась. Таким образом, HSP70 предотвращает развитие аутофагии при голодании.
Этот результат удалось подтвердить и другим методом, когда аутофагию отслеживали по изменению локализации LC3 в клетках (рис. 1Б). При запуске аутофагии в клетках появляются характерные органеллы — аутофагосомы. Белок LC3 локализуется на их поверхности. Положение LC3 можно определить, если покрасить клетки флуоресцирующими (светящимися при определенных условиях) антителами против него (см. Флуоресцентный иммуноанализ). Клетки, в которых запущена аутофагия, не окрашены равномерно. LC3 собирается на поверхности аутофагосом, поэтому клетка выглядит пятнистой. И снова, если в голодающих клетках увеличена экспрессия белка HSP70, аутофагия в них развивается медленнее. Таким образом, белок HSP70 ингибирует аутофагию в культуре клеток.
Аутофагия может быть вызвана не только голоданием, но и ингибированием белка mTOR. Свое название этот белок получил из-за того, что с ним связывается антибиотик рапамицин (mTOR = mammalian target of rapamycin, «мишень рапамицина у млекопитающих»). mTOR — один из основных регуляторов метаболизма. В зависимости от условий он запускает процессы запасания или расходования энергии. Если mTOR активен, то аутофагия не запускается. Оказалось, что и запущенная ингибированием mTOR аутофагия подавляется в присутствии HSP70.
HSP70 является только одним звеном в развитии ответа на тепловой шок. Точнее, он — непосредственный исполнитель, который участвует в стабилизации структуры других белков и ее исправлении. Одним из регуляторов экспрессии HSP70 является белок HSF-1. Чтобы проверить, участвует ли он в развитии аутофагии в условиях стресса, исследователи подавили экспрессию HSF-1 при помощи миРНК (короткой молекулы РНК — около 20 нуклеотидов, комплементарной участку мРНК определенного гена (в данном случае, HSF-1), и способной вызывать «выключение» конкретного гена) (рис. 2). Это само по себе вызвало развитие аутофагии, что было показано по увеличившемуся количеству модифицированного белка LC3. Повышение экспрессии HSP70 в таких условиях предотвращало развитие аутофагии. Следовательно, можно сделать вывод, что именно HSP70 является промежуточным звеном между HSF-1 и предотвращением развития аутофагии. При этом важна именно каталитическая активность HSP70 — мутация в той его части, которая ответственна за проявление активности, приводит к развитию аутофагии в стрессовых условиях.

Рис. 2. Аутофагия зависит от активности HSP70 и его регулятора — HSF-1. Клетки помещали в нормальные условия (белые столбики) или в среду с недостатком питательных веществ (EBSS, черные столбики). В них выключали HSF-1 (siHSF1+) или увеличивали экспрессию HSP70 (Ad70+) и измеряли количество модифицированного LC3. Видно, что аутофагия запускается при выключении HSF-1 (siHSF1+/Ad70-/EBSS, 3-й черный столбик). При этом HSP70 предотвращает развитие аутофагии (siHSF1+/Ad70+/EBSS, 4-й черный столбик). Рисунок из обсуждаемой статьи в Journal of Biological Chemistry
Все описанные эксперименты были проведены на культуре клеток. Это хорошая модель, однако организм — более сложная система. И проверка полученных результатов на уровне организма необходима. Авторы исследования не остановились на модельных экспериментах и изучили аутофагию у людей (рис. 3). Простейшим способом вызвать стресс является выполнение упражнений. Было показано, что у людей после физической нагрузки интенсивность аутофагии в мононуклеарных клетках крови (лимфоциты, моноциты, макрофаги) увеличивается (рис. 3, группа плацебо). Но как доказать, что в этом процессе участвует HSP70? В культуре клеток всё просто — надо выключить его и посмотреть, как изменится ответ. Если вы работаете с мышами, то можно вывести животных с дефицитом интересующего белка — такназываемых нокаутных животных (подробнее про нокаутных животных см.: Нобелевская премия по физиологии и медицине — 2007, «Элементы», 12.10.2007). Но если в эксперименте принимают участие люди, то остается надеяться только на физиологические способы изменения активности белков.
В случае HSP70 известно, что его активность увеличивается при добавлении глутамина в пищу. Исследователи использовали такой подход: одна группа добровольцев в течение недели три раза в день выпивала раствор глутамина, а вторая группа — раствор, не содержащий глутамина (плацебо). На восьмой день проводили тест с физической нагрузкой. После него у добровольцев брали кровь, выделяли из нее мононуклеарные клетки и уже в них анализировали интенсивность протекания аутофагии и количество HSP70. Оказалось, что прием глутамина значительно снижает проявление аутофагии, что согласовывалось с повышением количества HSP70. Сам по себе этот факт — только интересная корреляция. Однако вместе с экспериментами на культуре клеток он говорит о том, что аутофагия непосредственно связана с белками теплового шока.

Рис. 3. Аутофагия (А) и уровень HSP70 (Б) в мононуклеарных клетках крови добровольцев после физической нагрузки. Показатели для добровольцев, принимавших глутамин, показаны черными столбиками, для принимавших плацебо — белыми. По оси абсцисс показано время после физической нагрузки. Видно, что у добровольцев, принимавших плацебо, с течением времени развивается аутофагия, а у принимавших глутамин — остается на низком уровне. Напротив, количество HSP70 у принимавших глутамин больше, чем у принимавших плацебо. Рисунок из обсуждаемой статьи в Journal of Biological Chemistry
В недавней работе японских ученых также было получено важное подтверждение участия HSP70 и его регулятора — HSF — в развитии аутофагии (см.: Funasaka et al., 2012. Regulation of autophagy by nucleoporin Tpr). Эта команда изучала эффекты выключения одного из белков-компонентов ядерной поры. Внезапно оказалось, что удаление белка Tpr вызывает активацию аутофагии. Исследователи установили, что этот белок контролирует транспорт мРНК HSP70 и его регулятора HSF из ядра в цитоплазму. Участвует он и в транспорте мРНК других белков, участвующих в развитии аутофагии, а также вообще обладает свойствами регулятора транскрипции. Нарушение регуляции транспорта мРНК HSP70 из ядра в цитоплазму приводит к развитию аутофагии.
Что эти исследования дают для общего понимания процессов, происходящих при стрессе? Системы аутофагии и белков теплового шока имеют одну цель — выживание клетки в трудных условиях. БТШ способствуют этому путем исправления ошибок в сворачивании белков. Аутофагия обеспечивает клетки строительным материалом. Однако она может использоваться при стрессе и для уничтожения поврежденных органелл вместе с неправильно свернутыми белками. Следовательно, аутофагия — это более радикальный способ решения проблем. Логично, что ее стоит «включать» тогда, когда БТШ не справляются со своей задачей. В обсуждаемых работах показано, что усиление функции БТШ предотвращает запуск аутофагии. Был найден и один из возможных регуляторов связи между БТШ и аутофагией на уровне клеточного ядра. Кроме того, с определенной долей уверенности можно сказать, что и в организме в целом система БТШ подчиняет себе аутофагию.
Надо сказать, что БТШ регулируют не только аутофагию, но и воспалительный ответ — реакцию на «вторжение чужаков». Следовательно, БТШ — не простые исполнители. Возможно, на них сходятся важные регуляторные сигналы от разных систем, участвующих в ответе организма на стресс.
Источник: Karol Dokladny, Micah Nathaniel Zuhl, Michael Mandell, Dhruva Bhattacharya, Suzanne Schneider, Vojo Deretic, Pope Lloyd Moseley. Regulatory coordination between two major intracellular homeostatic systems: heat shock response and autophagy // Journal of Biological Chemistry. 2013. V. 288. P. 14959–14972.
См. также:
1) Haruo Kanno, Hiroshi Ozawa, Akira Sekiguchi, Seiji Yamaya, Satoshi Tateda, Kenichiro Yahata and Eiji Itoi. The role of mTOR signaling pathway in spinal cord injury // Cell Cycle. 2012. V. 11. P. 3175–3179.
2) Shu-Fen Hsu, Chien-Ming Chao, Wu-Tein Huang, Mao-Tsun Lin, Bor-Chih Cheng. Attenuating heat-induced cellular autophagy, apoptosis and damage in H9c2 cardiomyocytes by pre-inducing HSP70 with heat shock preconditioning // International Journal of Hyperthermia. 2013. V. 29. P. 239–247.
3) Tatsuyoshi Funasaka, Eriko Tsuka, Richard W. Wong. Regulation of autophagy by nucleoporin Tpr // Scientific Reports. 2012. V. 2. P. 878.