Барицитиниб при коронавирусе для чего назначают
Барицитиниб при коронавирусе для чего назначают
Барицитиниб – пероральный селективный ингибитор янус-киназ JAK1/2. Данный препарат был выбран в качестве потенциально эффективного при COVID-19 средства вследствие противовоспалительных свойств, ингибирования ряда цитокинов, участвующих в патогенезе COVID-19. Кроме того, не исключается противовирусное действие барицитиниба в отношении SARS-CoV2. Рандомизированное исследование ACTT-2 показало, что барицитиниб в комбинации с ремдесивиром ускоряет выздоровление пациентов с COVID-19.
В многоцентровое рандомизированное исследование 3 фазы COV-BARRIER включено 1525 пациентов, госпитализированных в связи с COVID-19. Пациенты основной группы в течение 14 суток получали 4 мг барицитиниба, пациенты контрольной группы – плацебо. Исследуемые препараты назначались на фоне стандартного лечения, которое могло включать парентеральные глюкокортикоиды (были назначены 91,3% пациентов) и противовирусное лечение ремдесивиром (его получали 18,9% пациентов).
В подгруппе пациентов, не получавших кортикостероиды, степень снижения смертности на фоне барицитиниба была еще выше: частота смерти от всех причин за 28 суток составила 5% в группе барицитиниба и 15% в группе плацебо (ОШ 0,31 [95% ДИ 0,11– 0,88], p=0,030).
Преимущества барицитиниба сохранялись и через 60 суток – смертность в этой группе составила 10%, в группе плацебо 15% (ОШ 0,62 [95% ДИ 0,47–0,83]; p=0,0050). В подгруппе пациентов, не получающих ГКС, смертность через 60 суток составила 5%, в группе плацебо 18% (ОШ 0,27 [95% ДИ 0,10–0,75], p=0,0080).
Применение барицитиниба не увеличивало в сравнении с плацебо частоту побочных эффектов, серьезных вторичных инфекций и эпизодов венозной тромбоэмболии.
Marconi VC, Ramanan AV, de Bono S, et al. Efficacy and safety of baricitinib for the treatment of hospitalised adults with COVID-19 (COV-BARRIER): a randomised, double-blind, parallel-group, placebo-controlled phase 3 trial. Lancet Respir Med. 2021 Aug 31:S2213-2600(21)00331-3. doi: 10.1016/S2213-2600(21)00331-3.
БАРИЦИТИНИБ (BARICITINIB) ОПИСАНИЕ
Фармакологическое действие
Фармакокинетика
После приема внутрь барицитиниб быстро всасывается, время достижения C max составляет приблизительно 1 ч (диапазон 0.5-3 ч), абсолютная биодоступность составляет около 79% (CV = 3.94%). Фармакокинетика барицитиниба является линейной по времени.
Средний V d после в/в введения составляет 76 л, что свидетельствует о распределении барицитиниба в тканях. Приблизительно 50% барицитиниба связывается с белками плазмы.
Метаболизм барицитиниба опосредован изоферментом CYP3A4, при этом биотрансформации подвергается менее 10% дозы. В плазме крови метаболиты барицитиниба не обнаруживаются. В условиях in vitro барицитиниб является субстратом для изофермента CYP3A4, транспортера органических анионов 3 (ОАТ3), Р-гликопротеина (Pgp), белка резистентности рака молочной железы (BCRP) и белков множественной резистентности и выведения токсинов 2-К (МАТЕ 2-К). Барицитиниб может быть ингибитором транспортеров органических катионов (ОСТ) 1.
Функция почек значительно влияет на экспозицию барицитиниба. Среднее соотношение AUC у пациентов с легкой и умеренной почечной недостаточностью и у пациентов с нормальной функцией почек составляют 1.41 (90% ДИ: 1.15-1.74) и 2.22 (90% ДИ: 1.81-2.73) соответственно. Среднее соотношение С mах у пациентов с легкой и умеренной почечной недостаточностью и у пациентов с нормальной функцией почек составляют 1.16 (90% ДИ: 0.92-1.45) и 1.46 (90% ДИ: 1.17-1.83) соответственно.
Показания активного вещества БАРИЦИТИНИБ
Лечение активного ревматоидного артрита умеренной или тяжелой степени у взрослых пациентов с непереносимостью или отсутствием адекватного ответа на лечение одним или несколькими базисными противоревматическими препаратами.
Возможность применения препарата барицитиниб у пациентов с COVID-19, в том числе для терапии «цитокинового шторма»
Полный текст:
Аннотация
Ключевые слова
##article.ConflictsofInterestDisclosure##:
##article.articleInfo##:
Депонировано (дата): 27.10.2020
##article.reviewInfo##:
##article.editorialComment##:
Для цитирования:
Отделенов В.А., Цветов В.М., Сычёв Д.А. Возможность применения препарата барицитиниб у пациентов с COVID-19, в том числе для терапии «цитокинового шторма». Качественная Клиническая Практика. 2020;(4S):11-14. https://doi.org/10.37489/2588-0519-2020-S4-11-14
For citation:
Otdelenov V.A., Tsvetov V.M., Sychev D.A. Possibility to use barycytinib in patients with COVID-19, including for treatment of «cytokine storm». Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2020;(4S):11-14. (In Russ.) https://doi.org/10.37489/2588-0519-2020-S4-11-14
Введение
Барицитиниб (торговое наименование Олумиант) — селективный иммунодепрессант, обратимый ингибитор Янус-киназы 1 и 2 (JAK1 и JAK2) [1]. Янус-киназы (JAK) представляют собой ферменты, которые трансдуцируют внутриклеточные сигналы от клеточных рецепторов ряда цитокинов и факторов роста, участвующих в процессах гемопоэза, воспаления и иммунного ответа. В рамках внутриклеточного сигнального пути Янус-киназы фосфорилируют и активируют STAT (транспортёры сигнала и активаторы транскрипции), которые в свою очередь активируют экспрессию гена в клетке. Барицитиниб модулирует эти сигнальные каскады реакций, частично ингибируя ферментативную активность JAK1 и JAK2, тем самым уменьшая фосфорилирование и активацию STAT.
Показание к медицинскому применению барицитиниба, согласно инструкции по медицинскому применению: лечение активного ревматоидного артрита умеренной или тяжёлой степени у взрослых пациентов с непереносимостью или отсутствием адекватного ответа на лечение одним или несколькими базисными противоревматическими препаратами.
С учётом влияния барицитиниба на иммунный ответ путём нарушения трансдукции внутриклеточных сигналов от клеточных рецепторов ряда цитокинов (ИЛ-6) и факторов роста обсуждается предположительная эффективность барицитиниба при «цитокиновом шторме», наблюдающемся при тяжёлом течении COVID-19.
Цитокиновый шторм — каскадное неконтролируемое увеличение уровня цитокинов в крови, которое может привести к избыточному иммунному ответу, повреждению органов и тканей [2]. Установлено, что при COVID-19 также происходит лимфогистиоцитолиз, что ведёт к цитокиному шторму, впоследствии — к полиорганной недостаточности [3]. В 50 % случаев при этом развивается острый респираторный дистресс-синдром [3].
Анализ клинических руководств, протоколов ведения пациентов с COVID-19
Согласно Временным методическим рекомендациям Министерства здравоохранения РФ по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19), версия 6 (08.04.2020 г.), в качестве патогенетического лечения при среднетяжёлых формах пневмоний с целью подавления гипервоспаления и развития серьёзных поражений лёгких и других органов, обусловленных COVID-19, можно рассматривать назначение таблетированного препарата барицитиниб (относится к группе ингибиторов янус-киназ) в качестве дополнительной терапии (рекомендуемая доза: 4 мг один раз в сутки в течение 7—14 дней). Барицитиниб включён в схемы лечения среднетяжёлых форм COVID-19 (пневмония без дыхательной недостаточности) у пациентов старше 60 лет или пациентов с сопутствующими хроническими заболеваниями:
Барицитиниб не упоминается в протоколе лечения пациентов с COVID-19, представленном Информационным центром COVID-19 Медицинского факультета Вашингтонского университета [16].
В алгоритмах лечения пациентов с COVID-19 Yale New Haven Health System [17] барицитиниб включён в список лекарственных препаратов, не рекомендованных в качестве терапии первой линии для лечения COVID-19 (но может быть рассмотрен в некоторых клинических случаях после обсуждения с клиническими фармакологами и специалистами по лечению инфекционных заболеваний). Кроме того, отмечается риск развития тяжёлых инфекций на фоне применения барицитиниба.
Анализ завершённых и запланированных клинических исследований
В настоящий момент на сайте clinicaltrials.gov зарегистрировано 5 клинических исследований барицитиниба при лечении COVID-19 [4]: 1 завершено (NCT04358614), 4 запланировано (NCT04340232, NCT04320277, NCT04346147, NCT04362943).
В завершённом исследовании NCT04358614 [5] изучалось применение барицитиниба совместно со стандартной терапией. Исследование не рандомизированное, последовательное. Исследователи оценивали безопасность терапии барицитинибом в сочетании с лопинавиром—ритонавиром при вирусной пневмонии среднетяжёлого течения у пациентов с COVID-19. В исследование включено 12 человек, которым назначался барицитиниб. В контрольную группу включены 12 пациентов с COVID-19, пневмонией среднетяжёлого течения, получавшие стандартную терапию (лопинавир+ритонавир 250 мг 2 раза в день в сочетании с гидроксихлорохином 400 мг/день перорально в течение 2 нед.) и госпитализированные в период непосредственно до первого пациента, которому назначался барицитиниб. Барицитиниб применялся в дозе 4 мг/день. Лечение барицитинибом хорошо переносилось, без серьёзных побочных эффектов. Лихорадка, показатели SpO2, PaO2/ FiO2, СРБ и результаты шкалы MEWS значительно улучшились в группе, получавшей барицитиниб, по сравнению с контрольной группой (p 1. Государственный реестр лекарственных средств. Инструкция по медицинскому применению Олумианта. URL: http://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=6e78e3ed51b3-415a-a79c-3b06b503555f&t= (дата обращения: 01.05.2020)
2. Chousterman BG, Swirski FK, Weber GF. Cytokine storm and sepsis disease pathogenesis. Semin Immunopathol. 2017 Jul;39(5):517-528. doi:10.1007/s00281-017-0639-8
3. Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ; HLH Across Speciality Collaboration, UK. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet. 2020 Mar 28;395(10229):10331034. DOI: 10.1016/S0140-6736(20)30628-0
4. URL:https://clinicaltrials.gov/ct2/results?cond=Baricitinib+COVID19&term=&cntry=&state=&city=&dist= (дата обращения: 01.05.2020)
5. Cantini F, Niccoli L, Matarrese D, Nicastri E, Stobbione P, Goletti D. Baricitinib therapy in COVID-19: A pilot study on safety and clinical impact. J Infect. 2020 Apr 22. pii: S0163- 4453(20)30228-0. DOI: 10.1016/j.jinf.2020.04.017
6. URL: https://clinicaltrials.gov/ct2/show/NCT04340232 (дата обращения: 01.05.2020)
7. URL: https://clinicaltrials.gov/ct2/show/NCT04346147 (дата обращения: 01.05.2020)
8. URL: https://clinicaltrials.gov/ct2/show/NCT04320277 (дата обращения: 01.05.2020)
9. URL: https://clinicaltrials.gov/ct2/show/NCT04362943 (дата обращения: 01.05.2020)
10. URL: https://www.clinicaltrialsregister.eu/ctr-search/trial/2020001367-88/DK (дата обращения: 01.05.2020)
11. URL: https://www.clinicaltrialsregister.eu/ctr-search/trial/2020001246-18/FR (дата обращения: 01.05.2020)
12. Временные методические рекомендации Министерства здравоохранения РФ по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19). Версия 6 (08.04.2020). URL: https://static-1.rosminzdrav.ru/system/attachments/attaches/000/050/116/original/28042020_%D0%9CR_COVID-19_v6.pdf (дата обращения: 01.05.2020)
13. Stebbing J, Phelan A, Griffin I, Tucker C, Oechsle O, Smith D, Richardson P. COVID-19: combining antiviral and anti-inflammatory treatments. Lancet Infect Dis. 2020 Apr;20(4):400-402. DOI: 10.1016/S1473-3099(20)30132-8
14. Pu SY, Xiao F, Schor S, et al. Feasibility and biological rationale of repurposing sunitinib and erlotinib for dengue treatment. Antiviral Res. 2018 Jul;155:67-75. DOI: 10.1016/j.antiviral.2018.05.001
15. Bekerman E, Neveu G, Shulla A et al. Anticancer kinase inhibitors impair intracellular viral trafficking and exert broad-spectrum antiviral effects. J Clin Invest. 2017 Apr 3;127(4):1338-1352. DOI: 10.1172/JCI89857
16. UW Medicine Interim Treatment Guidelines for SARS-CoV-2 Infection/COVID-19. URL: https://covid-19.uwmedicine.org/Pages/default.aspx (дата обращения: 02.05.2020)
17. Yale School Of Medicine. COVID-19 Treatment Algorithm. URL: https://files-profile.medicine.yale.edu/documents/e91b4e5c-ae56-4bf1-8d5fe674b6450847 (дата обращения: 02.05.2020)
Об авторах
Отделенов Виталий Александрович – доцент кафедры клинической фармакологии и терапии. SPIN-код: 8357-5770
Цветов Виталий Михайлович – к. м. н., врач — клинический фармаколог. SPIN-код: 3202-7659
Сычёв Дмитрий Алексеевич – д. м. н., профессор, член-корр. РАН, ректор, зав. кафедрой клинической фармакологии и терапии. SPIN-код: 4525-7556
Для цитирования:
Отделенов В.А., Цветов В.М., Сычёв Д.А. Возможность применения препарата барицитиниб у пациентов с COVID-19, в том числе для терапии «цитокинового шторма». Качественная Клиническая Практика. 2020;(4S):11-14. https://doi.org/10.37489/2588-0519-2020-S4-11-14
For citation:
Otdelenov V.A., Tsvetov V.M., Sychev D.A. Possibility to use barycytinib in patients with COVID-19, including for treatment of «cytokine storm». Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2020;(4S):11-14. (In Russ.) https://doi.org/10.37489/2588-0519-2020-S4-11-14

НАШИ КНИГИ
Другие журналы
«Издательства ОКИ»
ПАРТНЕРЫ
В. А. Отделенов
ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
Россия
Отделенов Виталий Александрович – доцент кафедры клинической фармакологии и терапии. SPIN-код: 8357-5770
В. М. Цветов
ФГБУ «Федеральный центр сердечно-сосудистой хирургии» Минздрава России
Россия
Цветов Виталий Михайлович – к. м. н., врач — клинический фармаколог. SPIN-код: 3202-7659
Д. А. Сычёв
ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
Россия
Сычёв Дмитрий Алексеевич – д. м. н., профессор, член-корр. РАН, ректор, зав. кафедрой клинической фармакологии и терапии. SPIN-код: 4525-7556
Препарат от артрита снизил смертность при COVID-19 на 71%
Препарат от артрита барицитиниб может снизить смертность при COVID-19 на две трети, заявляют врачи из Каролинского института в Швеции. Исследование было опубликовано в журнале Science Advances.
Барицитиниб — новый препарат, разрешенный к применению с 2017 года. Он используется для лечения тяжелых проявлений ревматоидного артрита у взрослых. Лекарство ингибирует активность ферментов, которые посылают внутриклеточные сигналы от клеточных рецепторов ряда цитокинов и факторов роста, участвующих в процессах воспаления и иммунного ответа организма.
Более ранние исследования показали, что барицитиниб, вероятно, способен подавлять воспаление, снижая риск цитокинового шторма, одной из распространенных причин смерти при COVID-19.
Теперь же его действие удалось проверить в клинических условиях.
Исследователи отобрали пациентов, госпитализированных с вызванной COVID-19 пневмонией. Средний возраст пациентов составлял 81 год. 83 из них вместе с обычным лечением получали также и барицитиниб, контрольную группу лечили стандартными методами. В первой группе скончались 17% пациентов, во второй — 35%.
По словам исследователей, препарат в целом хорошо переносился, а воспаление уменьшалось с первых дней лечения. Известные побочные эффекты длительного использования барицитиниба, включая коагулопатию и тромбоз, не наблюдались ни у одного из пациентов, возможно, из-за применения антикоагулянтов. При этом наблюдались бактериальные инфекции, проблемы с желудочно-кишечным трактом и сердцем, однако они встречались и в контрольной группе, поэтому нельзя наверняка связать их с барицитинибом.
«Мы рады сообщить о снижении смертности на 71% в группе, получающей барицитиниб в дополнение к стандартному лечению,
— говорит один из авторов работы Фолькер Лаушке, доцент кафедры персонализированной медицины и разработки лекарств. — Эти результаты особенно обнадеживают, поскольку в исследование была включена большая когорта пожилых пациентов, группа, которую часто исключают из других исследований».
Также исследователи более подробно изучили воздействие барицитиниба на мини-органах, созданных из человеческих клеток печени. Они продемонстрировали, что цитокины, высвобождаемые в ответ на внедрение вируса, увеличивают экспрессию рецепторов ACE2, через которые SARS-CoV-2 и проникает в клетки. Но барицитиниб оказался способен сдержать экспрессию, тем самым снизив и патогенность вируса.
«Наши результаты объясняют двойное антицитокиновое и антивирусное действие барицитиниба», — говорит соавтор исследования Али Миразими, адъюнкт-профессор кафедры лабораторной медицины.
Исследователи отмечают, что необходимы дальнейшие исследования препарата — по всей видимости, он действительно способен спасти множество жизней, но важно изучить его воздействие и возможные побочные эффекты в плацебо-контролируемых исследованиях.
Ранее ученые из Йельского университета нашли восемь генов, мутации в которых повышают риск смерти от коронавируса. Дефектные копии даже одного из них снижают выживаемость на 20%.
Авторы работы использовали данные британского Биобанка, чтобы изучить гены 1778 пациентов с COVID-19. 445 из них умерли от болезни. Исследователи разработали алгоритм, который позволил выявить восемь связанных с риском смерти генов на семи хромосомах.
Часть генов связана с контролем движения ресничек — крошечных волосков в дыхательных путях, которые помогают движению слизи.
Вирус, по всей видимости, через дефектный ген «отключает» способность очищать слизь через реснички, поясняют исследователи. Это приводит к тяжелой респираторной недостаточности, одной из причин смерти при COVID-19.
Другие генетические варианты, влияющие на выживаемость, оказались связаны с сердечно-сосудистыми заболеваниями, тромбоэмболией, митохондриальной дисфункцией и врожденным иммунитетом.
Исследователи надеются, что результаты могут дать ключ к пониманию молекулярного патогенеза COVID-19 и генетической основы, определяющей различия пациентов в восприимчивости к инфекции, что потенциально может привести к новым способам лечения.
Эффективность и безопасность тофацитиниба у пациентов с COVID-19: многоцентровое нерандомизированное контролируемое исследование
Изучить эффективность и безопасность тофацитиниба у госпитализированных пациентов с COVID-19 ассоциированной пневмонией.
Материалы и методы
В многоцентровое нерандомизированное контролируемое исследование включали пациентов с COVID-19 ассоциированной пневмонией, сопровождавшейся снижением сатурации крови кислородом в покое (SpO 2 ), повышенным уровнем С-реактивного белка (≥50 мг/л) и/или персистирующей лихорадкой. Пациентам основной группы назначали тофацитиниб в дополнение к стандартной терапии, в то время как больные контрольной группы получали только стандартную терапию. Суммарную частоту перевода на инвазивную вентиляцию легких (ИВЛ) и смерти во время госпитализации (первичная конечная точка) анализировали отдельно в двух когортах пациентов, выделенных в зависимости от исходной SpO 2 (≤93% и >93%). Отношения рисков (ОР) и доверительные интервалы (95% ДИ) рассчитывали с использованием регрессии Кокса и поправкой на взвешенный propensity matching score.
В исследование были включены 384 пациента с COVID-19 (212 мужчин, медиана возраста 60 лет); 131 из них получали тофацитиниб, 253 – только стандартную терапию. Среди больных со сниженной SpO 2 частота комбинированной первичной конечной точки в группе тофацитиниба и контрольной группе составила 12,5% (9/72) и 14,1% (26/185), соответственно (ОР 0,92, 95% ДИ 0,33-2,56), а среди больных с нормальной SpO 2 – 1,7% (1/59) и 4,4% (3/68), соответственно (ОР 0,83, 95% ДИ 0,07-9,44).
Патогенез тяжелого течения COVID-19 предполагает развитие чрезмерного воспалительного ответа, вызванного SARS-CoV-2 и характеризующегося значительным повышением содержания различных цитокинов и воспалительных биомаркеров, в частности С-реактивного белка (СРБ). Эти изменения сходны с “цитокиновым штормом», который наблюдается при синдроме активации макрофагов или после CAR-T-клеточной терапии [1,2]. Факторы риска тяжелого течения COVID-19 включают в себя пожилой возраст, мужской пол и некоторые сопутствующие заболевания, в том числе ожирение, сахарный диабет и коронарную болезнь сердца [3,4]. Эф фективные противовирусные препараты, которые могли бы предотвратить развитие избыточного иммунного ответа при COVID-19, по прежнему отсутствуют. В открытом рандомизированном клиническом исследовании у 168 пациентов с COVID-19 легкого или средне-тяжелого течения применение фавипиравира привело к более быстрому улучшению состояния пациентов по сравнению со стандартной терапией (умифеновир + интраназальный интерферон a2b или гидроксихлорохин), хотя медиана времени до элиминации вируса достоверно не отличалась между группами, а эффективность препарата в профилактике неблагоприятных исходов COVID-19 остается недоказанной [5].
На практике для лечения COVID-19 средней тяжести и тяжелого течения широко применяют глюкокортикостероиды и различные антицитокиновые препараты (в частности, ингибиторы интерлейкина-6), которые изучались в многочисленных наблюдательных и ран домизированных клинических исследованиях [6]. В исследовании RECOVERY применение глюкокортикостероида дексаметазона, обладающего широким спектром противовоспалительной активности, привело к снижению 28-дневной летальности у госпитализированных пациентов с COVID-19, нуждавшихся в респираторной поддержке, причем наиболее выраженный эффект был достигнут у больных, находившихся на ИВЛ [7]. Благоприятное влияние тоцилизумаба на летальность больных с COVID-19 было показано в многочисленных сериях наблюдений и нерандомизированных клинических исследованиях [8], но не подтверждено в нескольких рандомизированных клинических исследованиях [9,10]. В ретроспективном когортном исследовании у 328 пациентов с тяжелой COVID-19 пневмонией, госпитализированных в российские отделения реанимации и интенсивной терапии (ОРИТ), как более раннее, так и позднее введение тоцилизумаба, т.е. до или после интубации, не сопровождалось снижением летальности от всех причин [11]. В то же время в крупном рандомизированном исследовании RECOVERY у неинтубированных больных с гипоксией и признаками системного воспаления введение тоцилизумаба в дополнение к стандартной терапии привело к достоверному снижению риска перевода на ИВЛ или смерти на 16% (p
Материал и методы
Дизайн исследования. Многоцентровое нерандомизированное контролируемое исследование TOFA-COV-2 проводилось в трех клиниках Сеченовского университета, перепрофилированных в инфекционные госпитали. В исследование включали взрослых (≥18 лет) пациентов со среднетяжелым течением COVID-19, госпитализированных в университетские клиники с 17 апреля по 1 августа 2020 г. Диагноз COVID-19 был подтвержден при помощи полимеразной цепной реакции (ПЦР) и/или компьютерной томографии (КТ) органов грудной клетки. У пациентов с сомнительным или отрицательным результатом ПЦР назофарингеального мазка наличие пневмонии, вызванной вирусом SARS-CoV-2, устанавливали при наличии симптомов острой респираторной инфекции, типичных КТ-признаков (4 или 5 по шкале CO-RADS) и исключении других явных причин заболевания [17]. Объем поражения легочной паренхимы (0-24%, 25-49%, 50-74%, ≥75%) оценивали в пяти областях в соответствии с анатомическим строением легких: левая верхняя доля, левая нижняя доля, правая верхняя доля, правая средняя доля и правая нижняя доля.
Исследование было одобрено Этическим комитетом Сеченовского университета. Все пациенты подписали добровольное информированное согласие на использование экспериментальной терапии в соответствии с Временными методическими рекомендациями Министерства здравоохранения РФ по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19). Протокол исследования зарегистрирован на сайте clinicaltrials.gov (NCT04750317).
Медикаментозная терапия. Тофацитиниб применяли в течение 5 дней в дозе 10 мг два раза в сутки в первый день, а затем по 5 мг два раза в сутки. У пациентов с рСКФ 2 дозу снижали до 5 мг один раз в сутки. Доза препарата и длительность терапии были выбраны на основе доз, рекомендуемых для лечения ревматоидного артрита. Мы предполагали, что большая интенсивность иммуносупрессии, в частности прием тофацитиниба в более высокой дозе и в течение более продолжительного времени, не является необходимой и может быть опасной у пациентов с активной вирусной инфекцией. Кроме того, у госпитализированных пациентов с COVID-19 возможно увеличение риска развития некоторых побочных эффектов тофацитиниба, таких как вторичные инфекции, вызванные бактериальными или вирусными агентами, лимфопения и венозные тромбоэмболические осложнения [18].
Все пациенты во время госпитализации получали стандартную терапию в соответствии с Временными методическими рекомендациями Министерства здравоохранения РФ по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19). Необходимое лечение определялось лечащим врачом и могло включать в себя введение увлажненного кислорода (целевой уровень сатурации крови кислородом ≥93% в покое), применение гидроксихлорохина (400 мг два раза в сутки в первый день, затем по 200 мг два раза в сутки), азитромицина, лопинавира/ ритонавира (400/100 мг два раза в сутки) и низкомолекулярного гепарина в соответствии с массой тела и фильтрационной способностью почек. Внутривенное введение дексаметазона допускалось в дозе не более 16 мг/сут.
Показатели эффективности и безопасности. Первичной комбинированной конечной точкой была частота смерти от всех причин во время госпитализации или перевода на ИВЛ, вторичными – два компонента первичной конечной точки по отдельности. Риск смерти у пациентов с COVID-19 зависит от необходимости в респираторной поддержке и от ее типа (введение увлажненного кислорода, неинвазивная вентиляция легких или ИВЛ), который отражает тяжесть острого респираторного дистресс синдрома (ОРДС). По данным нашего предыдущего исследования, в российских ОРИТ летальность больных с ОРДС, вызванным SARS-CoV-2, составила в среднем около 65%. У пациентов, находившихся на оксигенотерапии она равнялась 10,1%, а при переводе на неинвазивную вентиляцию легких и ИВЛ увеличивалась до 36,8% и 76,5%, соответственно [19]. В связи с этим, все больные, принимавшие участие в исследование TOFA-COV-2, были разделены на две когорты в зависимости от SpO2 и необходимости в респираторной поддержке на момент включения в исследование: ≤93% (когорта 1) и >93% (когорта 2). Исходы оценивали раздельно в двух когортах. Первичные и вторичные конечные точки анализировали проспективно в группе тофацитиниба и ретроспективно на основании медицинской документации в контрольной группе.
Статистический анализ. Нормальность распределения данных оценивали с помощью теста Шапиро-Уилка. Демографические и исходные клинические показатели представлены в виде медианы и межквартильного интервала (IQR) для непрерывных переменных и в виде процентов для категориальных переменных. Сравнение непрерывных переменных в группе тофацитиниба и контрольной группе проводилось с использованием U-критерия Манна-Уитни для двух групп и критерия Краскелла-Уоллеса для трех групп. Категориальные переменные между группами сравнивали при помощи точного теста Фишера или критерия χ 2 Пирсона.
Все участники находились под наблюдением с момента включения в исследование до выписки или смерти. Выживаемость и время до интубации или смерти сравнивали между двумя группами с помощью невзвешенных кривых Каплана-Мейера и однофакторной и многофакторной модели регрессии Кокса c фиксированными ковариатами. Рассчитывали отношения рисков (ОР) и 95% доверительные интервалы (ДИ). В базовую модель была внесена поправка на обратно взвешенные коэффициенты предрасположенности (propensity matching). Валидность регрессионной модели проверяли путем оценки пропорциональных рисков с использованием метода остатков Шонфельда.
Различия считали статистически значимыми при p менее 0,05. Статистическая обработка данных осуществлялась с использованием программного обеспечения IBM SPSS Statistics, version 22 (IBM Corporation, USA).
Результаты
Общая характеристика пациентов. В исследование были включены 384 пациента с COVID-19 средней тяжести, в том числе 212 (55,2%) мужчин. Медиана возраста составила 60 лет (IQR 48-70). Диагноз COVID-19 был подтвержден исследованием мазка из носоглотки методом ПЦР у 180 (46,9%) пациентов, однако у всех пациентов имелись типичные КТ-признаки COVID-19 ассоциированной пневмонии, а балл по шкале CO-RADS составлял 4 или 5. CO-RADS представляет собой стандартизированную систему классификации пациентов с подозрением на COVID-19 и позволяет оценить вероятность наличия заболевания на основании КТ органов грудной клетки – от очень низкой (CO-RADS 1) до очень высокой (CO-RADS 5) [17]. Медиана продолжительности пребывания в больнице до смерти или выписки составила 16 дней (IQR 14-20). 131 (34,1%) пациент получали тофацитиниб в дополнение к стандартному лечению, а 253 (65,9%) – только стандартную терапию. Исходные клинические и демографические показатели пациентов с низкой и нормальной SpO2, получавших тофацитиниб или стандартную терапию, представлены в табл. 1 и 2.
С помощью метода Каплана-Мейера мы не выявили различий кумулятивной частоты первичной или вторичных конечных точек между двумя группами (рис. 1). По данным регрессионного анализа Кокса, добавление тофацитиниба к стандартному лечению не привело к снижению риска развития первичной или вторичных исходов (табл. 3).
| Когорты/конечные точки | Нескорректированное ОР (95% ДИ) | p | Скорректированное ОР (95% ДИ) | p |
|---|---|---|---|---|
| Пациенты со сниженной SpO2 | ||||
| Смерть или перевод на ИВЛ | 0,91 (0,42–1,97) | 0,82 | 0,92 (0,33-2,56) | 0,87 |
| Перевод на ИВЛ | 0,67 (0,25–1,78) | 0,42 | 0,46 (0,11-1,99) | 0,30 |
| Смерть | 1,24 (0,54–2,84) | 0,62 | 1,25 (0,44-3,54) | 0,67 |
| Пациенты со нормальной SpO2 | ||||
| Смерть или перевод на ИВЛ | 0,76 (0,07–8,57) | 0,83 | 0,83 (0,07-9,44) | 0,88 |
| Смерть | — | — | — | — |
| Перевод на ИВЛ | 0,99 (0,09–11,08) | 0,99 | 1,10 (0,10 – 12,46) | 0,94 |
Пациенты с нормальной сатурацией кислорода. Исходно SpO2 в покое была нормальной (>93%) у 127 пациентов. 59 из них получали тофацитиниб в дополнение к стандартному лечению, а 68 – только стандартную терапию. Две группы были сопоставимы по различным параметрам, включая возраст, пол, индекс массы тела, сопутствующие заболевания, SpO2, количество лейкоцитов, нейтрофилов и лимфоцитов, сывороточный уровень креатинина. Как и в когорте 1, пациенты в группе тофацитиниба имели меньший объем зон “матового стекла» и более низкую медиану СРБ по сравнению с контрольной группой. Доля пациентов, получавших лечение глюкокортикостероидами и низкомолекулярными гепаринами, в группе тофацитиниба была значительно выше, чем в контрольной группе.
Первичная комбинированная конечная точка (смерть или перевод на ИВЛ) была достигнута у 1 (1,7%) из 59 пациентов, получавших тофацитиниб со стандартной терапией, и у 3 (4,4%) из 68 пациентов, получавших только стандартное лечение (ОР 0,83; 95% ДИ 0,07-9,44). Ни одному пациенту в группе тофацитиниба не потребовалась ИВЛ, тогда как 3 (4,4%) пациента в контрольной группе были интубированы во время пребывания в больнице (p=0,25). В группе тофацитиниба во время госпитализации умер 1 (1,7%) пациент, а в контрольной группе – 3 (4,4%) больных (ОР 1,10; 95 ДИ 0,10–12,46).
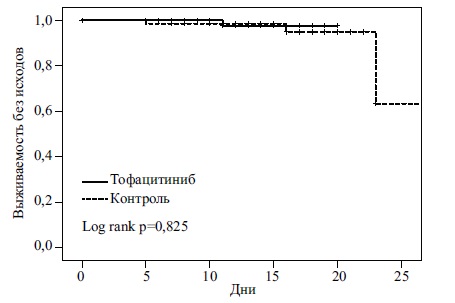
По данным анализа Каплана-Мейера, комбинированная терапия не имела преимуществ перед стандартной терапией по эффективности (рис. 2). При регрессионном анализе Кокса добавление тофацитиниба к стандартному лечению также не привело к снижению риска комбинированной первичной или вторичных конечных точек по сравнению со стандартной терапией (табл. 3).
Пациенты, получавшие глюкокортикоиды. Во время госпитализации 118 пациентов, включенных в исследование TOFA-COV-2, получали дексаметазон внутривенно (табл. 4). Среди 70 пациентов со сниженной SpO2, которым вводили глюкокортикостероиды, первичная конечная точка (смерть или перевод на ИВЛ) была достигнута у 4 (12,9%) из 31 пациента в группе тофацитиниба и у 11 (28,2%) из 39 пациентов в контрольной группе. ИВЛ потребовалась 1 (3,2%) и 10 (25,6%) пациентам, соответственно, а 4 (12,9%) пациента, получавших тофацитиниб и глюкокортикостероиды, и 9 (23,1%) пациентов, получавших только глюкокортикостероиды, умерли. Все различия частоты конечных точек между двумя группами не достигли статистической значимости в однофакторной модели регрессии Кокса.
| Конечные точки | Глюкокортикостероиды и тофацитиниб | Глюкокортикостероиды без тофацитиниба | ОР (95% ДИ) | p |
|---|---|---|---|---|
| Пациенты со сниженной SpO2 | ||||
| Число больных | 31 | 39 | ||
| Смерть или перевод на ИВЛ | 4 (12,9) | 9 (23,1) | 0,722 (0,219-2,385) | 0,593 |
| Перевод на ИВЛ | 1 (3,2) | 10 (25,6) | 0,135 (0,017-1,065) | 0,057 |
| Смерть | 4 (12,9) | 11 (28,2) | 0,517 (0,162-1,651) | 0,266 |
| Пациенты со нормальной SpO2 | ||||
| Число больных | 33 | 15 | ||
| Смерть или перевод на ИВЛ | 1 (3,0) | 2 (13,3) | 0,791 (0,046-13,597) | 0,871 |
| Перевод на ИВЛ | 0 | 2 (13,3) | не применимо | 0,631 |
| Смерть | 1 (3,0) | 2 (13,3) | 0,791 (0,046-13,597) | 0,871 |
Среди 48 пациентов с нормальной SpO2, получавших глюкокортикостероиды, комбинированная первичная конечная точка была достигнута у 1 (3,0%) из 31 пациента группы тофацитиниба, и у 2 (13,3%) из 15 пациентов контрольной группы. Различия частоты первичной и вторичных конечных точек между двумя группами в этой когорте также не достигли статистической значимости в однофакторной модели регрессии Кокса.
| Нежелательные явления | n (%) |
|---|---|
| Повышение активности печеночных ферментов | 14 (10,7) |
| Бактериальная пневмония | 6 (4,6) |
| Инфекция мочевыводящих путей | 2 (1,5) |
| Бактериальный сепсис | 2 (1,5) |
| Бактериальный колит | 1 (0,8) |
| Анемия | 2 (1,5) |
| Лейкопения | 1 (0,8) |
| Тромбоз яремной вены | 1 (0,8) |
| Кожные высыпания | 1 (0,8) |
| Пародонтит | 1 (0,8) |
| Инфаркт миокарда с подъемом сегмента ST | 1 (0,8) |
| Острое повреждение почек, потребовавшее диализа | 1 (0,8) |
| Желудочно-кишечное кровотечение | 1 (0,8) |
Безопасность. Побочные эффекты были выявлены у 34 (26,0%) из 131 пациента, получавшего тофацитиниб (табл. 5). Лечение тофацитинибом было прекращено у 7 (5,3%) пациентов из-за быстрого нарастания гипоксии (n=2) или серьезных побочных эффектов (n=5), которые включали инфаркт миокарда с подъемом сегмента ST (n=1), бактериальный сепсис (n=2), тромбоз яремной вены (n=1) и бактериальный колит (n=1).
Обсуждение
Тем не менее, у больных со сниженной и нормальной SpO2 тофацитиниб по эффективности в профилактике неблагоприятных исходов COVID-19 имел недостоверные преимущества перед контролем. Среди пациентов, нуждавшихся в респираторной поддержке на момент включения в исследования, частота смерти или интубации составила 12,5% и 14,1% в группе тофацитиниба и контрольной группе, соответственно, а среди пациентов с нормальной SpO2 – 1,7% и 4,4%. Эти различия могли быть связаны с более частым применением глюкокортикостероидов в группе тофацитиниба. В исследовании RECOVERY дексаметазон снижал летальность только у госпитализированных пациентов с более тяжелым COVID-19 [7]. Однако благоприятное влияние терапии глюкокортикостероидами на течение COVID-19 нельзя исключить и у пациентов с выраженной воспалительной реакцией даже при отсутствии гипоксии.
Использование глюкокортикостероидов было запрещено протоколом исследования ACTT-2, хотя эти препараты можно было применять по стандартным показаниям, включая септический шок и ОРДС. В исследовании ACTT-2 дексаметазон использовался только у 6,0% пациентов в группе барицитиниба. Напротив, системные глюкокортикостероиды применяли у 82% пациентов, которые были включены в группу тоцилизумаба в исследовании RECOVERY. Добавление тоцилизумаба к глюкокортикостероидам привело к снижению риска смерти от любых причин на 21%, тогда как этого преимущества не наблюдалось у пациентов, не получавших глюкокортикостероиды [12]. Приве денные данные свидетельствуют о том, что у пациентов с COVID-19 тоцилизумаб и, возможно, другие иммуномосупрессивные препараты следует назначать в дополнение к терапии глюкокортикостероидами. В нашем исследовании 31,2% пациентов получали дексаметазон внутривенно. Следует отметить, что набор в исследование TOFA-COV-2 проводился в начале пандемии COVID-19 в России, когда эффективность глюкокортикостероидов еще вызывала сомнение. В выборке больных со сниженной SpO2, которым вводили дексаметазон, добавление тофацитиниба к стандартной терапии сопровождалось более чем двукратным снижением частоты комбинированной конечной точки (смерти или ИВЛ) по сравнению с контрольной группой (12,9% против 28,2%). Как частота интубации, так и общая летальность также были ниже в группе тофацитиниба. Однако различия между двумя группами не достигли статистической значимости, вероятно, из-за ограниченного числа пациентов. Частота первичной и вторичных конечных точек была низкой у пациентов с нормальной SpO2 и не различалась между двумя группами. Терапия тофацитинибом хорошо переносилась пациентами исследуемой когорты и была отменена только у 5,4% пациентов.
Наше исследование имеет несколько ограничений. Во-первых, оно было нерандомизированном, а набор пациентов в контрольную группу осуществлялся ретроспективно на основании медицинской документации. Это не позволяло исключить возможность системной ошибки, связанной с отбором пациентов (selection bias). Чтобы исключить эффект различных факторов, способных повлиять на результаты лечения, в многофакторную модель Кокса была внесена поправка на propensity matching score. Следует отметить, что в обеих выборках в группах тофацитиниба объем поражения легочной ткани был ниже, а частота применения глюкокортикостероидов, наоборот, оказалась выше, чем в контрольных группах. Во-вторых, статистическая сила нашего исследования была ограниченной, особенно среди пациентов с нормальной SpO2, учитывая низкую частоту событий. Тем не менее, мы провели первое достаточно крупное контролируемое исследование с целью изучения эффективности тофацитиниба в профилактике неблагоприятных исходов у госпитализированных пациентов с COVID-19.
Заключение
Применение тофацитиниба в дополнение к стандартной терапии не привело к снижению риска смерти или перевода на ИВЛ у пациентов с COVID-19 средне-тяжелого течения как с пониженной, так и нормальной SpO2. У пациентов группы тофацитиниба, особенно получавших глюкокортикостероиды, частота комбинированной первичной конечной точки (смерть или интубация) и вторичных конечных точек была ниже, чем в контрольной группе, однако все различия между группами сравнения не достигли статистической значимости.