Бактериальный микроценоз что это
Что такое бактериальный вагиноз (дисбактериоз влагалища)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Чурсиной Ю.А., гинеколога со стажем в 7 лет.
Определение болезни. Причины заболевания
Бактериальный вагиноз — это инфекционное невоспалительное заболевание, при котором во влагалище происходит обильный рост определённых микроорганизмов и резкое снижение молочнокислых бактерий, обладающих защитными свойствами.
Причины бактериального вагиноза весьма разнообразны. К ним можно отнести как банальные нарушения интимной гигиены, так и более сложные ситуации.
К факторам, влияющим на микрофлору и способствующим возникновению болезни можно отнести:
Возможен ли бактериальный вагиноз у мужчин
Бактериальный вагиноз у мужчин невозможен. Однако мужчина может быть носителем инфекции, которая станет причиной бактериального вагиноза у женщины.
Бактериальный вагиноз у ребёнка
Биоценоз микрофлоры ребёнка формируется при прохождении через родовые пути матери. Если мама — носитель возбудителей бактериального вагиноза, то такая же флора будет и у ребёнка. В таком случае у девочки может развиться бактериальный вагиноз.
Влияние вагиноза на процесс зачатия и на беременность
Бактериальный вагиноз связан со следующими заболеваниями: бесплодие, невынашивание беременности, замершие беременности, преждевременные роды, хориоамнионит (инфицирование оболочек плода и жидкости, окружающих ребёнка в утробе матери) и истмико-цервикальная недостаточность (преждевременное открытие шейки матки при беременности). В основе этих заболеваний лежит хронический эндометрит, возникающий под влиянием возбудителей вагиноза.
Симптомы бактериального вагиноза
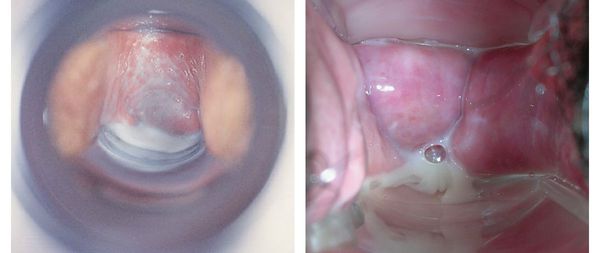
Основной признак бактериального вагиноза — это обильные жидкие однородные выделения из половых путей с неприятным запахом. Они могут быть серого или белого цвета.
Чувство жжения и зуда также характерны для вагинита — воспалительного процесса во влагалище. От бактериального вагиноза его отличает чувство сухости влагалища, а также покраснение и отёк его оболочки.
Патогенез бактериального вагиноза
У бактериального вагиноза нет одного конкретного возбудителя — он может быть вызван различными микроорганизмами. К наиболее частым причинам вагиноза относят не только упомянутые G.vaginalis, но и фузобактерии, пептострептококки, вейлонеллу, вагинальный атопобиум, а также бактерии Peptoniphilus, Prevotella, P. bivia и M. Mulieris. Чаще всего развитие болезни провоцирует сочетание 2-3 микроорганизмов и более.
Как передаётся бактериальный вагиноз
Классификация и стадии развития бактериального вагиноза
На данный момент какая-либо классификация и разделение на стадии заболевания отсутствуют. Кода в МКБ-10 (Международной классификации болезней), который бы соответствовал диагнозу «Бактериальный вагиноз», тоже нет. Для кодирования данного состояния используются другие коды. Чаще всего его относят к «N86. Другие воспалительные заболевания влагалища», что является неправильным и не всегда корректным.
Ранее использовалась классификация, предложенная Е.Ф. Кира в 1995 году. Согласно ей, выделяли четыре типа вагинального микробиоценоза — совокупности микроорганизмов, обитающих во влагалище:
Сегодня такая классификация не используется из-за значительного расширения познаний о микробиоценозе влагалища и появлении современных методов лабораторной диагностики.
Классификация бактериального вагиноза на основании микроскопического исследования:
Осложнения бактериального вагиноза
Чем опасен бактериальный вагиноз
Диагностика бактериального вагиноза
Диагностика бактериального вагиноза обычно не представляет существенных трудностей. Тем не менее при постановке диагноза часто можно встретить ошибки: как гипердиагностику (когда пациентке приписывается болезнь, которой у неё на самом деле нет), так и гиподиагностику.
Чаще всего правильно определить заболевание удаётся уже при первом обращении женщины к врачу. В таких случаях диагноз ставится на основании характерных жалоб, данных осмотра и Рh-метрии влагалищных выделений. Иногда может понадобится достаточно обширное клинико-лабораторное обследование.
Какие показатели важны для диагностики бактериального вагиноза
В диагностике бактериального вагиноза используются критерии R. Amsel. К ним относятся:
Диагноз «Бактериальный вагиноз» устанавливается при наличии минимум трёх признаков.
Также существует полуколичественная оценка мазков влагалищной жидкости, окрашенных по Граму, по шкале от 0 до 10. Сейчас этот метод практически не используется.
Для лабораторной диагностики бактериального вагиноза применяется метод PCR Real Time в рамках комплексного анализа микрофлоры влагалища. Существует ряд тест-систем, самыми распространёнными из которых являются Фемофлор 16+КВМ и Фемофлор скрин. Данные тест-системы позволяют получить достаточно полное представление об особенностях микробиоценоза влагалища женщины и назначить обоснованное лечение.
К клиническим методам диагностики относят различные экспресс-тесты: Fem-exam, BVBlue, Pip-activity TestCard. Однако все они диагностики широко не применяются в клинической практике. В основном это связано с их недостаточной чувствительностью.
Дифференциальная диагностика с трихомониазом, кандидозом и уреаплазмозом
Лечение бактериального вагиноза
К какому врачу обратиться
Лечением бактериального вагиноза занимается гинеколог.
Когда стоит обратиться к врачу
К врачу следует обратиться при появлении симптомов бактериального вагиноза: обильных выделениях из половых путей с неприятным запахом, зуде или жжении во влагалище и в области прямой кишки, нарушении мочеиспускания и болезненных ощущениях во время или после полового акта.
Как лечить вагиноз дома. Народные средства от бактериального вагиноза
Ни в коем случае нельзя заниматься самолечением — его должен назначать врач, иначе это может негативно сказаться на здоровье женщины.
Чем лечить бактериальный вагиноз
Для устранения бактериального вагиноза используют антисептические средства и различные комбинированные препараты. В настоящее время доказана эффективность двухэтапной схемы лечения бактериального вагиноза: первый этап заключается в применении антисептических средств, а второй — в восстановлении микрофлоры влагалища.
Существует достаточно много как зарубежных, так и российских рекомендаций и схем лечения данного заболевания. В соответствии с Евразийскими клиническими рекомендациями по рациональному применению антимикробных средств в амбулаторной практике, при устранении бактериального вагиноза следует использовать следующие препараты [7] :
Средства терапии первой линии:
Средства терапии второй линии:
Продолжительность и кратность приёма этих средств определяется врачом индивидуально. Кроме того, существует значительное количество комбинированных препаратов.
Эубиотики (пробиотики)
Для восстановления вагинальной микрофлоры могут быть использованы вагинальные капсулы с живыми лактобактериями и гель с молочной кислотой.
Особенности лечения у беременных
В первом триместре беременности не применяют препараты системного действия. Лечение проводят только местно, свечами, например «Клиндацином». Со второго-третьего триместра, помимо местного лечения, можно применять метронидазол и клиндамицин в таблетках.
Питание при бактериальном вагинозе
Соблюдение диеты на течение бактериального вагиноза не влияет. При лечении следует исключить алкоголь, так как применяемые препараты могут замедлить расщепление этилового спирта, в результате чего общее самочувствие ухудшится.
Прогноз. Профилактика
Прогноз при своевременно начатом лечении в большинстве случаев благоприятный. Иногда возможны рецидивы заболевания. При их возникновении необходим комплексный подход к пациентке, полное клинико-лабораторное обследование и исключение сопутствующих заболеваний, которые могут увеличивать риск повторного появления бактериального вагиноза. Также нужно проконсультироваться по вопросам питания и образа жизни.
В качестве профилактики возникновения бактериального вагиноза прежде всего нужно исключить такие факторы риска, как:
Существенный вклад в развитие и рецидивы заболевания вносят частые смены половых партнёров, тяжёлые сопутствующие заболевания, злоупотребление алкоголем, курение. Всего этого следует избегать.
Немаловажную роль в профилактике играет здоровый образ жизни, адекватная физическая активность и приверженность к правильному питанию — вегетарианская диета и повышенное потребление «быстрых» углеводов увеличивают риск рецидива.
Для предупреждения бактериального вагиноза нужно следовать рекомендациям по интимной гигиене:
Можно ли заниматься сексом при бактериальном вагинозе
Заниматься сексом при бактериальном вагинозе можно, так как он не относится к заболеваниям, передающимся половым путём. Однако бактериальный вагиноз ассоциирован с уреаплазмозом и микоплазмозом, поэтому клинические проявления могут возникнуть и у сексуального партнёра заражённой женщины. Кроме того, бактериальный вагиноз зачастую сопровождается характерным «рыбным» запахом и обильными выделениями, что может стать психологической преградой для полового акта.
Состояние микроценоза влагалища и способы коррекции его нарушений во время беременности
А.Н.Стрижаков, П.В. Буданов
Московская медицинская академия имени И.М.Сеченова
В норме на протяжении беременности возрастает колонизационная резистентность влагалищного биотопа. В то же время нарушения микроценоза влагалища встречаются у каждой второй беременной. Ранняя своевременная безопасная коррекция вагинальной флоры позволяет снизить частоту связанных с инфекциями осложнений беременности, родов, послеродового периода и улучшить перинатальные показатели. Проведенное исследование показывает высокую эффективность Гексикона для лечения нарушений микроценоза влагалища у беременных. Гексикон не обладает отрицательным влиянием на количество лактобацилл и хорошо переносится. Высокую частоту рецидивов нарушений микроценоза влагалища удается предотвратить при комбинации местного лечения с повышением общей резистентности организма с помощью препаратов интерферонов (интерферон альфа-2) и Вобэнзима.
Ключевые слова: вульвовагинальные инфекции, бактериальный вагиноз, кандидоз, лечение, хлоргексидин, Вобэнзим, Гексикон The state of vaginal microcenosis and ways of correcting its disorders during pregnancy A.N.Strizhakov, P.V.Budanov I.M.Sechenov Moscow Medical Academy
Normally, during pregnancy colonizational resistance of the vaginal biotope increases. On the other hand, disorders of vaginal microcenosis occur in every second pregnant woman. Early safe correction of vaginal flora permits to decrease the incidence of complications of pregnancy, labor, and of the puerperium related to infection and to improve perinatal indices. The study demonstrates a high efficacy of Hexicon for treatment of disorders of vaginal microcenosis in pregnant women. Hexicon does not produce any negative effect on the amount of lactobacilli and has good tolerance. High incidence of relapses of disorders of vaginal microcenosis can be prevented by combining local treatment with an increase of general resistance of the body using interferon medications (interferon alpha-2) and Wobenzym.
Key words: vulvovaginal infections, bacterial vaginosis, candidiasis, treatment, chlorhexidine, Wobenzym, Hexicon
Нарушения микроценоза влагалища встречаются у 45-86% пациенток акушерских и гинекологических стационаров, приводят к инфекционным осложнениям после хирургических вмешательств на органах малого таза, способствуют возникновению воспалительных заболеваний внутренних половых органов, внутриутробной инфекции [1, 2, 10].
Нарушение колонизационной резистентности влагалищного биотопа в несколько раз увеличивает вероятность инфицирования возбудителями, передаваемыми половым путем. Подавляющее большинство инфекционных заболеваний влагалища и шейки матки являются вариантами нарушения микроценоза [2, 10, 11]. Так, бактериальный вагиноз (БВ), генитальный кандидоз (ГК) и трихомонадный вагинит составляют более 90% всех вагинальных инфекций [3, 10].
Инфекционные заболевания нижних отделов половых путей у беременных являются важной проблемой современного акушерства, в связи с высоким уровнем материнской и перинатальной заболеваемости, связанной с восходящим инфицированием фето-плацентарного комплекса [3].
В настоящее время подробное изучение культуральных и биохимических свойств представителей влагалищного биотопа привело к трансформации знаний о вариантах нарушений нормоценоза влагалища и его инфекционной патологии [9, 12, 13].
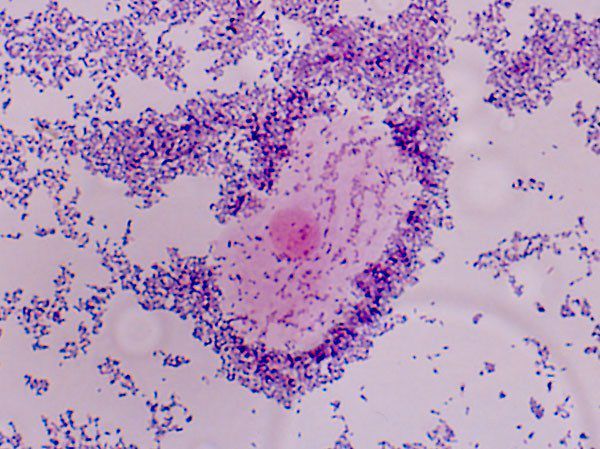
Термин «нормоценоз» отражает типичное состояние нормального биотопа влагалища (преобладание лактобактерий, отсутствие грамотрицательной микрофлоры, спор, мицелия, псевдогифов, лейкоцитов, неизмененные эпителиальные клетки). «Промежуточный тип» биоценоза влагалища является пограничным типом, редко сопровождается субъективными симптомами и клиническими проявлениями (сниженное количество лактобактерий, наличие грамположительных кокков, грамотрицательных палочек). «Дисбиоз» влагалища соответствует микробиологической картине бактериального вагиноза (минимальное количество или полное отсутствие лактобактерий, полиморфная грамотрицательная и грамположительная палочковая и кокковая микрофлора, наличие «ключевых клеток). «Вагинит» соответствует неспецифическому вагиниту (преобладание лейкоцитов над эпителиоцитами, повышенная эксфолиация эпителиоцитов, обнаружение трихомонад, псевдомицелия, спор грибов). При обнаружении трихомонад, мицелия, псевдогифов, спор определяется соответствующий этиологический диагноз [4].
Наряду с этим сопоставление бактериального вагиноза с неспецифическим кольпитом или промежуточным типом микроценоза влагалища и назначение антибактериальной терапии без учета патогенеза заболевания в большинстве случаев не дает положительного эффекта, а приводит к потенцированию патологического процесса [4, 5].
В понимании механизмов естественного барьера для инфекционных осложнений наиболее важен термин «колонизационная резистентность влагалищного биотопа». Это совокупность механизмов, поддерживающих стабильность популяционного и количественного состава компонентов нормального микроценоза [3, 6].
Собственный опыт диагностики, лечения, оценки эффективности и наблюдения отсроченных результатов различной терапии более 300 случаев бактериального вагиноза, генитального кандидоза, трихомониаза, уреаплазмоза и микоплазмоза в различных возрастных группах, в том числе у беременных женщин, показал, что частота положительных результатов лечения зависят не только от качества проведения этиотропной терапии и элиминации возбудителя, а, в основном, от нормализации и восстановления нормальной микрофлоры влагалища [4].
С целью выявления структуры нарушений микроценоза и выбора метода эффективного восстановления колонизационной резистентности влагалищного биотопа проведено обследование 486 беременных на протяжении гестации.
Из них 150 пациенток без инфекционной патологии половых органов составили контрольную группу. В основную группу включили 167 беременных с нарушениями микроценоза влагалища, которые были представлены бактериальным вагинозом, генитальным кандидозом, кольпитом и промежуточным типом микроценоза.
Оценка состояния микроценоза родовых путей у беременных выполнялась в сроки до 12 нед, в 18-20 нед, 28-30 нед и в 37-38 нед. В процессе каждого эпизода обследования выполнялись тесты на бактериальный вагиноз, микроскопия мазков из влагалища, шейки матки и уретры. Обследование для выявления возбудителей инфекций, передающихся половым путем, проводилось до 12 нед, в 18-20 нед и в 37-38 нед.
Ни у одной из 150 пациенток контрольной группы не было обнаружено не только нарушений микроценоза родовых путей и специфических возбудителей, но и промежуточного типа микроценоза влагалища.
Нарушения микроценоза влагалища отмечены в 49,7% наблюдений. Преобладали бактериальный вагиноз и генитальный кандидоз, общая частота которых достигала 76%. Неспецифический кольпит диагностирован всего у 9 женщин. По нашему мнению неспецифический кольпит является результатом несовершенной лабораторной диагностики. Кроме того, у 18,6% беременных выявлялся промежуточный тип микроценоза влагалища.
Пролонгированное наблюдение за беременными позволило установить, что в 1-м триместре беременности в подавляющем большинстве случаев развивается бактериальный вагиноз, а частота кандидозных поражений прогрессивно увеличивается со сроком гестации. Подобная динамика, вероятно, связана с уменьшением влияния эстрогенов во 2-м и 3-м триместрах беременности.
При этом независимо от срока беременности меняется состав вагинального отделяемого. В первую очередь повышается количество лейкоцитов, число которых преобладает над числом эпителиоцитов. Увеличивается количество слущенных эпителиальных клеток и повышается адгезия на них грибковых, а также различных бактериальных объектов. В 77,1% (81) имели место изменения микробного состава вагинального секрета, выражавшиеся в уменьшении количества лактобацилл и увеличении доли условно-патогенных микроорганизмов. Однако выраженное преобладание лейкоцитов над эпителиоцитами, отсутствие ключевых клеток и значительного повышения (на несколько порядков) общего количества микроорганизмов не позволяли квалифицировать данную картину как бактериальный вагиноз.
В то же время, 85 (69,7%) женщин хотя бы однократно в содержимом канала шейки матки имели представительство различных групп микроорганизмов.
Следует отметить, что ни у одной женщины с отрицательным результатом посева из нижней трети цервикального канала не обнаруживались микроорганизмы и в других порциях материала из шейки матки.
Спектр микроорганизмов, выделенных из цервикального канала, соответствовал бактериальному спектру влагалища у каждой женщины. Все выделенные бактерии относились к группе условно-патогенных микроорганизмов.
При повторном исследовании микробной обсемененности содержимого цервикального канала только у 41 из 101 (в 2,5 раза меньше) женщины результаты посевов были положительными. При этом наблюдалась обратная отрицательная зависимость обсемененности цервикального канала от срока беременности. Последнее бактериологическое обследование, проведенное в 37-38 нед, показало, что микроорганизмы выделяются только из нижней трети канала шейки матки у 7 (6,93%) беременных, причем Proteus spp., Peptostreptococcus spp., Klebsiella spp., Lactobacillus spp., Bacteroides spp., Fusobacterium spp., Candida spp. в монокультуре или в ассоциациях занимали 92,3% среди всех обнаруженных штаммов.
В основной группе у 62 беременных было проведено 156 бактериологических посевов содержимого канала шейки матки. У всех женщин результаты посевов были положительными. Обнаружено, что у женщин с нарушениями микроценоза родовых путей отсутствовала тенденция уменьшения микробной обсемененности канала шейки матки с увеличением срока беременности. Напротив, при повторном микробиологическом исследовании отмечено увеличение количества патогенных штаммов в цервикальном секрете.
Из 36 женщин с бактериальным вагинозом и генитальным кандидозом у 34 (94,4%) уже при проведении первого посева имелась высокая обсемененность нижней трети, а у 12 (33,3%) патогенные биотопы определялись и в средней трети канала шейки матки.
При проведении лечения по вышеописанным схемам, частота угрозы прерывания беременности снизилась в 2 раза, самопроизвольного выкидыша в 3,7 раза по сравнению с общими показателями родильного дома.
Проведение коррекции промежуточного типа влагалищного микроценоза с помощью препарата Гексикон позволило снизить частоту возникновения нарушений микроценоза родовых путей и инфекций, передающихся половым путем, у беременных женщин.
В ходе проведения исследования не было зарегистрировано побочных реакций на фоне интравагинального введения Гексикона и отказов от лечения.
Таким образом, нарушение микроценоза родовых путей приводит не только к резкому увеличению риска контаминации условно-патогенными возбудителями, но и повреждает биологический барьер секрета влагалища и канала шейки матки. Применение препарата хлоргексидина для самостоятельного использования пациенткой (Гексикон) высокоэффективно для лечения любых вариантов нарушения микроценоза влагалища. При рецидивирующих нарушениях микроценоза влагалища эффективность терапии повышает комплексное лечение, включающее препараты интерферона (интерферон альфа-2) и Вобэнзим. В отличие от антибактериальных препаратов Гексикон не оказывает отрицательного воздействия на количество лактобацилл.
Микробиоценоз желудочно-кишечного тракта: современное состояние проблемы
Определите значение слов, и вы избавите свет от половины его заблуждений. Декарт Афоризм, вынесенный в эпиграф данной статьи, как нельзя лучше отражает состояние проблемы по дисбиозам, поскольку до сих пор остается множество вопросов.
Определите значение слов,
и вы избавите свет от половины его заблуждений.
Декарт
Афоризм, вынесенный в эпиграф данной статьи, как нельзя лучше отражает состояние проблемы по дисбиозам, поскольку до сих пор остается множество вопросов. Врачи нередко используют в качестве синонимов термины «дисбактериоз», «дисбиоз», «микроэкология кишечника», «микробиоценоз кишечника», которые, в строго научном плане, не эквивалентны. Принципиальный вопрос даже не в используемых терминах, а в понимании сути проблемы и ее общебиологического значения. Его решение позволит более обоснованно и нацеленно проводить терапию, направленную на коррекцию микробиоценоза.
Общие представления о нормальном микробиоценозе ЖКТ
Однако бактерии неравномерно распределены в ЖКТ. Если в желудке плотность микробной колонизации невелика и составляет всего около 103–104 КОЕ/мл, а в подвздошной кишке — 107–108 КОЕ/мл, то уже в области илеоцекального клапана в ободочной кишке градиент плотности бактерий достигает 1011–1012 КОЕ/мл [15]. Несмотря на столь обширное разнообразие видов бактерий, обитающих в ЖКТ, большинство могут идентифицироваться только молекулярно-генетически [13].
Среди бактерий-комменсалов, культивированных из ЖКТ, более 99,9% являются облигатными анаэробами, из которых доминирующими представителями являются: Bacteroides, Bifidobacterium, Eubacterium, Lactobacillus, Clostridium, Fusobacterium, Peptococcus, Peptostreptococcus, Escherichia и Veillonella [16]. Состав обнаруживаемых бактерий в различных отделах ЖКТ весьма вариабелен. В зависимости от частоты и постоянства обнаружения бактерий, вся микрофлора подразделяется на три группы (табл. 1).
Индивидуальность и стабильность микробиоценоза ЖКТ в физиологических условиях у человека является одной из характерных черт. Механизмы поддержания стабильности качественных и количественных параметров индигенной микрофлоры, несмотря на перманентное поступление экзогенных микроорганизмов с водой и пищей, пока до конца не выяснены. Среди ведущих факторов, обеспечивающих такую стабильность, традиционно рассматривают естественные природные защитные системы, которые обеспечивают в том числе и неспецифическую противоинфекционную резистентность (табл. 2).
Хотя структурно-функциональное значение этих систем в обеспечении стабильности микробиоценоза изучено не в равной степени, имеющиеся клинические наблюдения наглядно свидетельствуют о том, что нарушения их функциональной активности закономерно сопровождаются изменением состава флоры. Особенно велико влияние нормальной кислотности желудочного сока, обеспечивающего минимальное поступление экзогенных микроорганизмов в тонкую кишку [17].
Кроме этого, развитие концепции микробного сообщества (микробиоты) подразумевает наличие между микроорганизмами регуляторных влияний, позволяющих им координированно участвовать в процессах, происходящих в определенных биотопах (в частности, в ЖКТ). Одним из ключевых механизмов межклеточного взаимодействия между бактериями является механизм quorum sensing («чувство кворума»), впервые описанный в 1999 г. [18], но фактически совершенно не изученный в индигенной микрофлоре ЖКТ.
Клинические аспекты нарушений микробиоценоза ЖКТ
Современные исследования свидетельствуют, что облигатная микрофлора ЖКТ непосредственно участвует во многих жизненно важных процессах макроорганизма внутри самого пищеварительного тракта, а также оказывает многочисленные и разнообразные системные регулирующие функции, в силу чего индигенную микрофлору (нормальный микробиоценоз) кишечника нередко рассматривают в качестве составной части макроорганизма или как экстракорпоральный орган (табл. 3).
Нарушение микробиоценоза ЖКТ, характеризующееся снижением качественных и количественных показателей облигатной и факультативной микрофлоры, способно оказывать и негативное влияние на здоровье человека. Помимо «выпадения» физиологических функций, связанных со снижением плотности присутствия индигенной микрофлоры, развитие дисбиоза может быть сопряжено: а) с транслокацией бактерий и развитием эндогенных инфекционных процессов (вплоть до гнойно-септических состояний); б) со снижением резистентности организма; в) с развитием аллергических и иммунопатологических состояний; г) формированием патогенных клонов бактерий, обусловленным обилием в просвете кишечника плазмидных и хромосомных генов.
Принципы коррекции дисбиотических нарушений ЖКТ
Проблема изучения микробиоценоза ЖКТ сводится к попыткам его коррекции с помощью микробиологических препаратов. Эти попытки предпринимались и на заре изучения данной проблемы (Л. Г. Перетц), и с нарастающей интенсивностью продолжаются сейчас. На сегодняшний день накоплен обширный опыт применения пробиотиков. Обычно их используют в качестве профилактических препаратов и с целью коррекции дисбиотических нарушений. Однако имеется немало статей, в которых описывают и их терапевтический эффект при ряде патологических состояний [19–24].
Поскольку развитие дисбиоза характеризуется не банальным дефицитом представителей облигатной и/или факультативной микрофлоры, а является индикатором, свидетельствующим о нарушении микроэкосистемы, простого назначения пробиотиков с целью коррекции микробиоценоза бывает явно недостаточно. Главной целью врача должно стать не «засевание» слизистой кишечника пациентов нормальной микрофлорой, а восстановление микробиоценоза ЖКТ и плотности колонизации индигенной микрофлоры. Достижение данной цели возможно:
Пребиотики представляют собой химические компоненты (микробного и немикробного происхождения), способные избирательно стимулировать рост и/или метаболическую активность одной или нескольких групп бактерий, входящих в состав нормальной индигенной микрофлоры. Комбинированные препараты, в состав которых входят бактерийные препараты и стимуляторы роста, обозначают как синбиотики.
Согласно современным представлениям [10], штаммы, используемые в качестве пробиотиков, должны отвечать следующим критериям: а) быть безопасносными для человека; б) быть резистентными к действию кислого содержимого желудка, желчи и ферментам поджелудочной железы; в) обладать выраженными адгезивными свойствами в отношении эпителиальных клеток слизистой оболочки ЖКТ; г) проявлять антимикробную активность; д) ингибировать адгезию патогенных бактерий; е) быть резистентными к действию антибиотиков; ж) сохранять стабильность при хранении препарата.
Наиболее часто в качестве пробиотиков используют различные виды лакто- и бифидобактерий (табл. 4).
Предпочтение, отдаваемое препаратам, содержащим молочнокислые бактерии Lactobacillus spp. и Bifidobacterium spp., обусловлено тем, что они резистентны к действию желудочного сока, желчи и ферментам поджелудочной железы, легко адгезируются и колонизируют слизистую оболочку кишечника.
В целях повышения клинической эффективности пробиотиков в настоящее время предпочтение отдается разработке и использованию комплексных препаратов, в состав которых входит несколько штаммов бифидо- и лактобактерий, витаминные комплексы, пектины, что, как полагают, способствует повышению их адгезивности и колонизации слизистой оболочки кишечника. Капсульные формы также имеют определенные преимущества как в стабильности препарата, так и в сохранении активности штамма при прохождении через кислотный барьер желудка.
К таким препаратам относятся Линекс, Бификол, Ацилакт, Аципол, Бифистим и др. Длительность курса лечения пробиотиками обычно составляет от 2 нед до 1–2 мес. Прием пробиотиков целесообразно сочетать с употреблением щелочных растворов (столовые минеральные воды).
Клиническая эффективность пробиотиков связана с колонизацией слизистой оболочки кишечника и заместительным восстановлением функций нормальной индигенной микрофлоры кишечника (табл. 3), что обеспечивает создание микроэкологической среды, способствующей восстановлению индигенной микрофлоры. Хотя штаммы бактерий, используемые в производстве пробиотиков, отобраны из состава микрофлоры ЖКТ человека, они все же не обладают длительной колонизационной резистентностью и элиминируются из кишечника в течение 3–7 нед.
В последние годы широкое распространение в качестве пробиотиков получил препарат Энтерол, в состав которого входят дрожжи Saccharomyces boulardii. Данные дрожжи не входят в состав нормальной индигенной микрофлоры ЖКТ, однако обладают выраженными антагонистическими свойствами в отношении широкого спектра патогенных и условно-патогенных бактерий, сохраняют жизнеспособность при транзите по ЖКТ, абсолютно резистентны к действию любых антибактериальных препаратов (чувствительны только к противогрибковым препаратам). Спектр их ферментативной активности, по данным современных исследований, обеспечивает им участие в процессах пищеварения и обмена веществ. Saccharomyces boulardii относят к самоэлиминирующимся штаммам, поскольку их элиминация происходит в течение 3–4 дней после прекращения приема препарата. Обычный курс лечения Энтеролом составляет 7–10 дней.
Все большее внимание при восстановлении микробиоценоза кишечника уделяется относительно новому классу препаратов — пребиотикам, важнейшим требованием к которым является селективность действия только на индигенную микрофлору без усиления роста и размножения токсинпродуцирующих клостридий, токсигенных штаммов кишечной палочки и протеолитических бактероидов. Использование этих препаратов возможно только в случае доминирования в составе индигенной микрофлоры кишечника бифидо- и лактобактерий.
Наиболее часто используемыми пребиотиками являются Хилак форте и различные препараты пищевых волокон (кукурузные хлопья, крупы, хлеб).
Хилак форте содержит субстраты продуктов обмена индигенной микрофлоры кишечника, способствующих регенерации эпителиальных клеток слизистой оболочки кишечника и быстрому восстановлению нормофлоры. Препарат обычно назначают по 40–60 капель 3 раза в день в небольшом количестве жидкости (за исключением молока). Дозы и длительность приема препарата определяются индивидуально.
Клиническая эффективность комбинированных препаратов пробиотиков и пребиотиков (синбиотиков) пока остается малоизученной ввиду недостаточно накопленного опыта.
Вопросы безопасности использования пробиотиков
Длительный опыт клинического применения пробиотиков способствовал распространению и укреплению мнения их безопасности. Однако публикуемые в медицинской печати (особенно в последние годы) данные клинических наблюдений свидетельствуют о необходимости более глубокого анализа вопросов безопасности применения пробиотиков [32].
В настоящее время полагают, что оральный прием живых бактерий теоретически может быть ответственен за четыре типа побочных эффектов: а) развитие инфекционных процессов, обусловленных штаммами, входящими в состав пробиотиков; б) развитие метаболических расстройств; в) чрезмерная иммуностимуляция лимфатического аппарата кишечника; г) формирование новых клонов бактериальных штаммов за счет передачи генов, ответственных за экспрессию факторов патогенности.
Наибольшую настороженность вызывает возможность развития инфекционных процессов. Поскольку пробиотические штаммы бактерий отобраны из числа представителей индигенной микрофлоры, риск развития инфекционных процессов оценивается как очень низкий, но возможный. Данный тезис подкреплен целым рядом клинических наблюдений и обзорных статей, в которых описываются случаи развития бессимптомной бактериемии, тяжелого сепсиса, эндокардита, пневмонии и абсцессов, вызванных лакто-, бифидо- или другими бактериями [33, 34]. Поступление бактерий в кровоток возможен вследствие их транслокации через слизистую оболочку кишечника. Чаще всего факторами риска, связанными с бактериемией Lactobacillus, являются патологические процессы ЖКТ, обусловливающие снижение защитных барьерных функций, повышающих проницаемость слизистых оболочек кишечника (опухоли ЖКТ, травмы, операции) и иммуносупрессивные состояния.
Многие авторы отмечают, что бактериемию Lactobacillus очень трудно диагностировать, поскольку данный тип бактерий тяжело культивировать и идентифицировать, а в тех случаях, когда получают рост, это нередко расценивается как контаминация. Наиболее часто инфекционные процессы были обусловлены Lactobacillus rhamnosus, Lactobacillus fermentum и Lactobacillus casei.
Enterococcus faecium и E. faecalis тоже могут обусловить развитие инфекционных процессов. Кроме этого, уже имеются указания на появление ванкомицин-устойчивых штаммов энтерококков.
Определенное беспокойство вызывает и широкое применение препаратов, содержащих дрожжи — Saccharomyces boulardii, что связано с диагностируемой фунгемией [35]. Большинство исследователей отмечают, что развитие фунгемии обусловлено воздействием Saccharomyces boulardii на сосудистые катетеры.
Итак, дисбиотические нарушения ЖКТ — актуальная проблема практического здравоохранения, требующая глубокого теоретического, экспериментального и клинического исследования. Несмотря на то, что применение пробиотиков и является важной составной частью коррекции микробиоценоза, оно не должно являться самоцелью.
По вопросам литературы обращайтесь в редакцию.
В. А. Малов, доктор медицинских наук, профессор
Н. М. Гюлазян, кандидат медицинских наук
ММА им. И. М. Сеченова, Москва