Аутоиммунное заболевание легких что это
Аутоиммунные заболевания легких и сердца
Поражение легких.
Саркоидоз представляет собой хронический гранулематозный процесс, обычно поражающий лимфатические узлы средостения. Кроме поражений легких, нередко отмечается внелегочная симптоматика, такая как поражения глаз (увеит), узловатая эритема, артриты, образование гранулем в ЦНС, напоминающих рассеянный склероз. Этиология саркоидных гранулем не известна. Гранулемы, состоящие из воспалительных клеток метаболически активны и синтезируют медиаторы иммунного ответа. Одним из продуктов саркоидных гранулем является ангиотензин-превращающий фермент (АПФ). Его активность при саркоидозе уравновешивается другими системы регуляции давления. Синтез АПФ зависит от общего числа количества гранулем и его содержание выше при внелегочных проявлениях заболевания.
Механизм поражения при альвеолитах зависит от наличия или отсутствия экзогенного антигена. При экзогенных аллергических альеволитах экзогенный антиген (аллерген) поступает в легкие с вдыхаемым воздухом. Непропорциональный иммунный ответ приводит к постепенному утолщению альвеолярной мембраны. Распространенными экзогенными аллергенами являются антигены грибка Aspergillus fumigatus, который широко распространен в окружающей среде. Выявление антител класса IgG является типичным для экзогенного аллергического альвеолита. При идиопатическом фиброзирующем альвеолите причинный антиген до сих пор не выявлен. В индукции хронического воспаления имеет большое значение активность альвеолярных макрофагов (альвеолоциты 2 порядка). Одним из продуктов этих клеток является альвеоломуцин — полисахарид, выделяемый в просвет альвеолы. При высокой активности альвеолоцитов альвеоломуцин определяется в периферической крови, поэтому определение его содержания может использоваться для диагностики и оценки тяжести альвеолитов.
Повышенная активность ангиотензин-превращающего фермента (дипептидил-карбоксипептидаза) обнаруживается при сердечно-сосудистых заболеваниях и саркоидозе. Повышенная активность фермента является фактором риска инфаркта, а ее мониторинг может использовать для оптимизации дозы ингибитров АПФ. При саркоидозе высокая ферментативная активность отмечается у 70% пациентов, причем чаще при внелегочном поражении. Исследование активности данного фермента также может использоваться для оценки синдрома хронической усталости, болезни Гоше. Неспецифически повышен при инфекциях мочевыводящих путей, СПИДе.
Антитела к Aspergillus fumigatus класса IgG значительно повышены у больных с экзогенным альвеолитом, легчным и внелегочным аспергиллезом. Обнаружение антител подтверждает диагноз, однако учитывая разнообразные причины экзогенного альвеолита отсуствие антител не исключает заболевание.
Воспалительные кардиомиопатии.
Антитела к сократителой ткани миокарда представляют собой группу аутоантител, направленных против сарколеммы, митохондрий и сократительных белков. Их антигенами являются актин, миозин, виментин, ламинин, десмин, тубулин, альфа и бета адренергические рецепторы.
Присутствие антител к ткани сердца выявляется у 25-35% пациентов с доказанным по результатам биопсии диагнозом миокардит, дилатационная кардиомиопатия, и, редко, при ишемической болезни сердца и других заболеваниях сердца.
В связи с разнообразием антигенов антимиокардиальных антител, отмечается два основных типа свечения миокарда – сарколеммный и миофибриллярный. Основные антиген сарколеммного типа свечения расположены на мембране миокарда. К ним относятся адренергические рецепторы, взаимодействие которых с антителами приводи к развитию аритмий. Аутоантитела, направленные против сократительных миофибрилл, приводят к апоптозу клеток миокарда и фиброзу сердечной мышцы.
Предполагается взаимосвязь между индукцией антител к ткани сердца с бактериальной или вирусной инфекцией. Антитела к сердечной мускулатуре могут обнаруживаться также и после операций на сердце (трансплантация, коронарное шунтирование), а также постинфарктном миокардите, который развивается после перенесенного инфаркта – синдроме Дресслера.
Показанием для проведение теста «Диагностика воспалительных миокардиопатий» и «Антитела к миокарду (Mio)» является оценка выраженности аутоиммунного компонента патологического процесса при поствирусных миокардитах, дилатационной кардиомиопатии, синдроме Дресслера (постинфарктный миокардит), ревмакардите, постперикардиотомическом синдроме в целях выбора оптимальной терапии.
Болезни бронхов и легких (аутоиммунные)
Аутоиммунные заболевания — это целый ряд болезней, которые могут поражать как весь организм в целом, так и отдельные органы и системы (ЖКТ, сердце, бронхи и легкие и пр.). В основе заболеваний лежит атака организма собственной иммунной системой. Для современной медицины причины таких процессов в организме остаются загадкой, хотя и существует множество теорий патогенеза.
Прогноз болезни может быть разный, что зависит от таких факторов:
Лечение заключается в подавлении неадекватной активности иммунитета. Для этого применяются медикаменты из группы иммуносупрессантов:
Иммуномодуляторы для лечения аутоиммунных болезней легких и бронхов почти никогда не применяются. В крайне редких случаях могут быть актуальны иммуноглобулины, вводимые внутривенно.
Аутоиммунные болезни сложны для диагностики, может понадобиться консультация нескольких специалистов разных профилей. При диагностики обнаруживают так называемый аутоиммунитет, что означает выработку антител против собственных антигенов организма. Сегодня разработаны специальные противовоспалительные препараты. Но они оказывают не только лечебный, но и негативный эффект на организм. Действие этих лекарств может негативно сказаться на кроветворной системе, способствовать образованию язв ЖКТ, вызывают кровоизлияния и т.д.
Саркоидоз — системная хроническая болезнь, характеризующаяся наличием неказеифицированных (без казеозного некроза, характерного для туберкулеза) гранулем во многих органах и тканях: легких, коже, лимфоузлах, селезенке, печени, глазах и др.
Причины саркоидоза и патогенез
Раньше предполагали, что этиологическим фактором саркоидозa служит Mycobacterium tuberculosis. Однако причины заболевания могут быть разнообразные инфекционные возбудители и неинфекционные факторы:
Образование гранулем возможно и при воздействии кроме микробов, металлической пыли. Ингаляция причинного антигена может запускать патологический, приводящий к саркоидозу. Цитокины активируют Т-хелперы 1 типа (СЭ4+ ТН1). Моноциты/макрофаги продуцируют ИЛ-3, ИЛ-б, ИЛ-8, ИЛ-1 5, ИФН-у, фибрин и фибронектин. Они могут трансформироваться в эпилиолидные клетки, соединяться, образуя многоядерные гигантские клетки. Под влиянием каскада цитокинов формируются саркоидные гранулемы. Неказеозные гранулемы состоят из эпителиоидных клеток, макрофагов, многоядерных гигантских клеток, фибробластов и Т-хелперов. ИЛ-4 и ИЛ-б запускают поликлоальную В-клеточную активацию, что проявляется гипергаммаглобулинемией.
Симптомы саркоидоза
Возможно случайное обнаружение саркоидоза в результате выявления на рентгенограмме двустороннего увеличения медиастинальных лимфоузлов. Острая форма болезни (синдром Лефгрена) характеризуется сочетанием увеличенных внутригрудных лимфоузлов с узловатой эритемой (часто локализуется на голенях), болью в суставах и лихорадкой.
При саркоидозе гранулемы могут формироваться в легких, коже, лимфоузлах, селезенке, печени, глазах, что ведет к их поражению. Поражения глаз представлено иритом, иридоциклитом, склеритом, конъюнктивитом. Возможна потеря зрения. Часто поражаются легкие. Появляются одышка, боль в грудной клетке, утомляемость, артралгия, миопатия. На коже могут отмечаться сыпь, бляшки, узловатая эритема. Лимфоузлы уплотнены, безболезненны, подвижны. Поражаются нервная и сердечно-сосудистая системы.
Лабораторная диагностика саркоидоза
Выявляются лимфоцитопения, эозинофилия и увеличенная СОЭ. Возможны гиперкальциемия, повышенная выработка ангиотензинпревращающего фермента. Реакция на туберкулин обычно отрицательная. При биопсии выявляются неказеифицированные гранулемы, содержащие эпителиоидные клетки, единичные гигантские клетки, лимфоциты и фибробласты.
Лечение саркоидоза
Применение кортикостероидов зависит от стадии саркоидоза. Первоначальная медикаментозная терапия может снизить эффективность последующего лечения. Системное использование кортикостероидов показано в тяжелых случаях. Возможно сочетанное назначение кортикостероидов с иммунодепрессантами (метотрексат, азатиоприн, циклофосфамид). В отдельных случаях применяют противомалярийные препараты (хлорохин).
Идиопатический фиброзирующий альвеолит
У генетически предрасположенных лиц возможна активация альвеолярных макрофагов после контакта с неизвестным инфекционным агентом (рис. 4.19). Вирусы, иммунные комплексы и цитокины Т-лимфоцитов также могут вовлекаться в процесс активации. Альвеолярные макрофаги секретируют ИЛ-8, а также лейкотриены и нейтрофильный хемотаксический фактор, которые вызывают хемотаксис и активацию т профильных гранулоцитов.
Данная патология относится к группе фиброзирующих альвеолитов, среди которых выделяют также экзогенный аллергический альвеолит и токсический фиброзирующий альвеолит, возникающий в результате действия токсических веществ и некоторых лекарственных средств.
Появляются фиброзные изменения, нарушается процесс реэпителизации. Пневмоциты II типа не могут далее замещать поврежденные пневмоциты I типа, что способствует дефектам в выработке сфактантов и спадению альвеол. Морфологический процесс при фиброзирующем альвеолите получил название «ремоделирование альвеолярной выстилки», в терминальной стадии легкие имеют вид пчелиных сот, образуются расширенные полости. Таким образом, данная патология сопровождается развитием интерстициального отека, альвеолита (интерстициального воспаления) и интерстициального фиброза.
Симптомы
Заболевание чаще развивается в возрасте старше 50 лет. При физической нагрузке развивается прогрессирующая одышка и кашель. Ногтевые фаланги приобретают вид «барабанных палочек». Выживаемость больных не превышает 5 лет. Лабораторная диагностика не имеет решающего значения. У больных отмечено увеличение СОЭ и у части из них — повышение показателей ревматоидного и антинуклеарного факторов.
Лечение
Кортикостероиды оказались малоэффективны. Благоприятное воздействие оказывает совместное применение у-интерферона с кортикостероидами. Для антифиброзного эффекта применяют О-пеницилламин, колхицин и интерферон.
Интерстициальная пневмония с аутоиммунными признаками (ИПАП): мультидисциплинарный диагноз в пульмонологии и ревматологии
Диагноз идиопатической интерстициальной пневмонии с аутоиммунными признаками (ИПАП) объединяет пациентов с идиопатической интерстициальной пневмонией и рядом клинических, серологических и/или морфологических проявлений, указывающих на наличие системного аутоиммунного процесса, который, однако, не соответствует современным критериям определенного системного заболевания соединительной ткани. Результаты клинических исследований указывают на значительную неоднородность больных данной группы. В обзоре литературы обсуждаются классификационные критерии ИПАП, а также дальнейшие перспективы их применения для улучшения диагностики и лечения пациентов с данной патологией.
Идиопатические интерстициальные пневмонии (ИИП) представляют собой группу диффузных воспалительных и/или фибротических заболеваний легких, объединенных на основании сходных клинических, рентгенологических и гистологических признаков. Диагноз ИИП требует исключения известных причин интерстициальной пневмонии, таких как воздействие экзогенных факторов, токсические эффекты лекарственных препаратов или системное заболевание соединительной ткани (СЗСТ) [1]. Последние представляют собой группу аутоиммунных заболеваний, таких как ревматоидный артрит, системная красная волчанка, идиопатические воспалительные миопатии, синдром Шегрена, системная склеродермия и смешанное заболевание соединительной ткани. Интерстициальная пневмония (ИП) может быть одним из проявлений СЗСТ, причем в части случаев ее развитие предшествует появлению других симптомов заболевания 3.
У пациентов с ИИП могут наблюдаться отдельные клинические симптомы или серологические маркеры, характерные для аутоиммунной патологии, но не позволяющие установить диагноз какого-либо СЗСТ в связи с отсутствием всех необходимых критериев 6. Ранее исследователи предлагали различные критерии и термины для описания вышеуказанной когорты пациентов 8, в связи с чем длительное время отсутствовала возможность проведения мас штабных исследований, посвященных диагностике и лечению данной патологии.
В 2015 году экспертами Европейского респираторного общества (ERS) и Американского торакального общества (ATS) был предложен термин «интерстициальная пневмонии с аутоиммунными признаками (ИПАП)» [10]. Этим термином обозначают ИИП, сопровождающуюся клиническими, серологическими и/или морфологическими признаками, которые указывают на наличие системного аутоиммунного процесса, но не соответствуют современным критериям конкретного СЗСТ. Следует отметить, что это понятие было введено группой пульмонологов и ревматологов, в первую очередь, для удобства диагностики и унификации критериев включения пациентов в клинические исследовании, однако оно не может служить основанием для выбора метода лечения.
Критерии ИПАП
Классификационные критерии ИПАП распределены на три группы, или домена – клинический, серологический и морфологический (табл. 1) [10]. Для установления диагноза ИПАП 2 необходимы наличие ИП по данным компьютерной томографии органов грудной клетки высокого разрешения (КТВР) и/или хирургической биопсии легкого и тщательное клиническое обследование для исключения известных причин ИП, в том числе СЗСТ. Кроме того, диагноз ИПАП предполагает наличие соответствующих классификационных критериев, относящихся по крайней мере к двум из указанных групп.
| 1. | Наличие интерстициальной пневмонии (по данным КТВР или хирургической биопсии легкого) + |
| 2. | Исключение альтернативных причин ИП + |
| 3. | Несоответствие критериям конкретного СЗСТ + |
| 4. | Наличие по крайней мере одного критерия из 2 или более групп: А) Клинической Б) Серологической В) Морфологической |
| А. | Клиническая группа: |
| 1) | Трещины на коже дистальных фаланг пальцев («рука механика») |
| 2) | Кожные язвы дистальных фаланг пальцев |
| 3) | Артриты или скованность в утренние часы ≥60 мин с поражением нескольких суставов |
| 4) | Телеангиэктазии на коже ладоней |
| 5) | Феномен Рейно |
| 6) | Беспричинный отек пальцев |
| 7) | Беспричинная стойкая сыпь на коже разгибательной поверхности пальцев (симптом Готтрона) |
| Б. | Серологическая группа: |
| 1. | Антинуклеарные антитела (АНА) в титре ⩾1:320 при наличии диффузного, гранулярного или гомогенного паттерна свечения или a) АНА при наличии нуклеолярного паттерна (в любом титре) или б) АНА при наличии центромерного паттерна (в любом титре) |
| 2. | Ревматоидный фактор в титре ⩾2N |
| 3. | Антитела к циклическому цитруллинированному пептиду (АЦЦП) |
| 4. | Антитела к двуспиральной ДНК (анти-дсДНК) |
| 5. | Анти-Ro (SS-A) |
| 6. | Анти-La (SS-B) |
| 7. | Антитела к рибонуклеопротеину |
| 8. | Анти-Smith |
| 9. | Антитела к топоизомеразе (Scl-70) |
| 10. | Антитела к тРНК-синтетазе (Jo-1, PL-7, PL-12 и другие, в том числе EJ, OJ, KS, Zo, tRS) |
| 11. | Анти-PM-Scl |
| 12. | Анти-MDA-5 |
| С. | Морфологическая группа: |
| 1. | Предполагаемый паттерн по данным КТВР: a) Неспецифическая интерстициальная пневмония (НСИП) б) Организующая пневмония (ОП) в) Перекрест НСИП и ОП г) Лимфоцитарная интерстициальная пневмония (ЛИП) |
| 2. | Гистологический паттерн по данным биопсии легкого: a) НСИП б) ОП в) Перекрест НСИП и ОП г) ЛИП д) Интерстициальные лимфоидные узелки с герминативными центрами |
| 3. | Внепаренхиматозные легочные и внелегочные проявления (в сочетании с интерстициальной пневмонией) a) Необъяснимый плевральный выпот или утолщение плевры б) Необъяснимый перикардиальный выпот или утолщение перикарда в) Необъяснимое заболевание дыхательных путей (по данным легочных функциональных тестов визуализационных методов или биопсии) г) Необъяснимая легочная васкулопатия |
В клиническую группу критериев включены симптомы, относительно специфичные для ряда СЗСТ, такие как феномен Рейно, телеангиэктазии кожи ладоней, язвы дистальных фаланг пальцев 12. Тем не менее, сами по себе они не позволяют установить диагноз СЗСТ. В то же время алопеция, фотодерматит, язвы слизистой оболочки полости рта, снижение массы тела, сухой синдром, изолированные миалгия и артралгия не были включены в перечень признаков ИПАП в связи с низкой специфичностью.
Морфологическая группа критериев ИПАП включает в себя такие рентгенологические паттерны ИП, как неспецифическая интерстициальная пневмония (НСИП), организующая пневмония (ОП), перекрест НСИП и ОП, лимфоцитарная пневмония (ЛИП). Данные варианты легочного поражения достаточно часто встречаются при ИП, ассоциированных с СЗСТ (СЗСТ-ИП) 16. Обычная интерстициальная пневмония (ОИП) (рис. 2) также может быть выявлены у пациентов с СЗСТ, хотя и встречается реже [17], поэтому она не является критерием исключения ИПАП. Тем не менее, в отличие от НСИП, ОП и ЛИП, картина ОИП не входит в перечень морфологических признаков ИПАП.
Результаты клинических исследований
С момента введения критериев ИПАП в 2015 г. были опубликованы результаты ряда клинических исследований, в основном ретроспективных, в которых изучались проявления, течение и исходы этого заболевания. Хотя основной целью разработки классификационных критериев ИПАП было выделение относительно однородной группы пациентов, тем не менее, в проведенных исследованиях выборки характеризовались значительной вариабельностью [18].
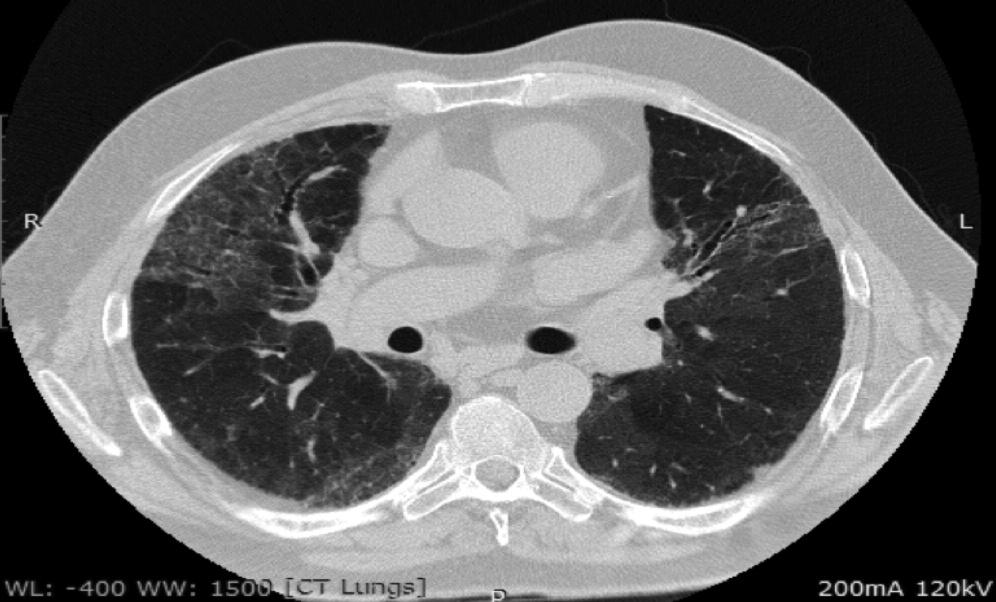
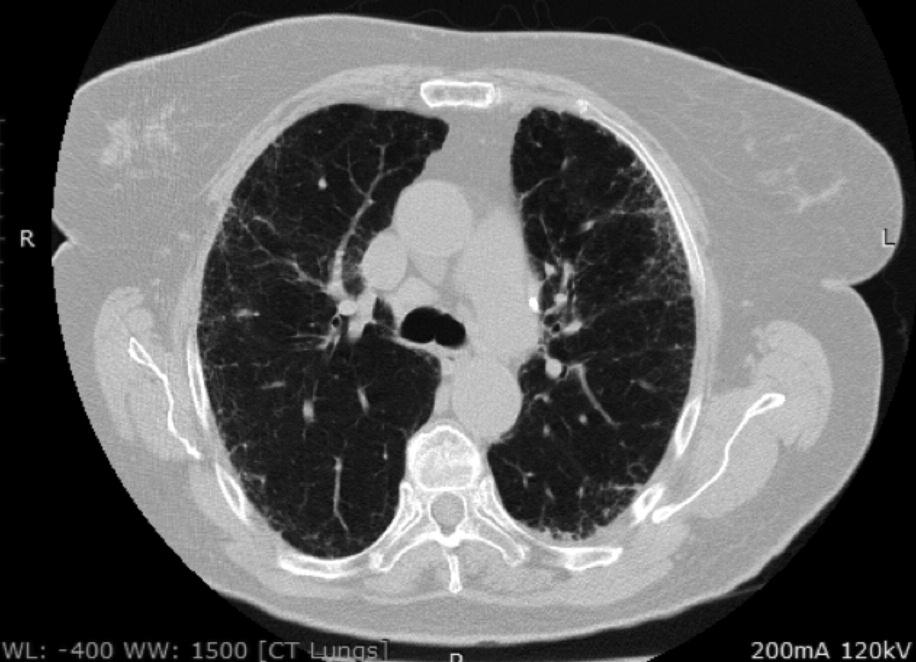
В одном из наиболее крупных исследований J. Oldham с соавт. описали группу из 144 пациентов с ИПАП: средний возраст больных составил 63 года, а приблизительно у половины из них основным рентгенологическим и/или гистологическим паттерном была ОИП [19]. У 14,6% пациентов имелись клинические и серологические критерии диагноза, у 8,3% – клинические и морфологические, у 26,4% – все три критерия. У пациентов с ИПАП и идиопатическим легочным фиброзом (ИЛФ) смертность оказалась сходной. Однако при дополнительном анализе результатов исследования было показано, что выживаемость больных ИПАП зависела от рентгенологического варианта поражения легких. При наличии картины ОИП прогноз был сходным с таковым больных с ИЛФ, тогда как у пациентов с другими рентгенологическими паттернами выживаемость была значительно выше и сопоставимой с таковой при ИП, ассоциирующейся с СЗСТ. По данным многофакторного анализа, независимыми неблагоприятными прогностическими факторами были возраст и снижение диффузионной способности легких для монооксида углерода.
В другом исследовании S. Chartrand и соавт. описали 56 пациентов с ИПАП в возрасте в среднем 54,6 года, большинство из которых были некурящими [20]. Наиболее частым паттерном ИП при КТВР и биопсии легкого была НСИП (51,8%), в то время как ОИП была выявлена всего у 9% пациентов. Более чем у половины пациентов имелись классификационные критерии, относящиеся ко всем трем группам, у 37,5% – серологические и морфологические, у 9% – клинические и морфологические, у 1,5% (1 пациент) – серологические и клинические критерии. Наиболее частым клиническими симптомами были феномен Рейно (39,3%), «рука механика» (28,6%) и симптом Готтрона (17,9%). Среди серологических критериев чаще всего встречались АНА в диагностическом титре (48,2%), анти-Ro/SS-A (42,9%), а также анти-тРНК-синтетазные антитела (АТСА) (35,7%). В исследуемой группе не отмечено ни одного летального исхода в течение периода наблюдения (284±141,3 недель).
К. Ahmad и соавт. наблюдали 57 больных с ИПАП, среди которых у 11,1% выявлены клинические и серологические классификационные критерии, у 7% – клинические и морфологические критерии, у 52,7% – серологические и морфологические критерии, у 29,2% – все три критерия [21]. Средний возраст пациентов с ИПАП составил 64,4±14 лет. Соотношение мужчин и женщин было приблизительно одинаковым. 34% пациентов курили. Наиболее частыми рентгенологическими паттернами были НСИП (42,1%) и ОИП (28%), тогда как основным внепаренхиматозным проявлением среди морфологических критериев оказалась легочная васкулопатия (17,5%). В течение периода наблюдения длительностью 16 месяцев умерли 7 пациентов. Много факторный анализ показал, что только курение было неблагоприятным прогностическим фактором. В то же время следует отметить, что в отличие от исследования J. Oldham и соавт., авторы не выявили различия выживаемости между группами пациентов с паттернами ОИП и НСИП.
В исследование Y. Ito и соавт. были включены 99 пациентов с ИПАП [22]. Один пациент с паттерном ОИП был исключен из анализа. Среди остальных 98 пациентов у 64,3% выявлен морфологический паттерн НСИП, у 20,4% – ОП, у 15,3% – перекрест НСИП и ОП. Пятилетняя выживаемость составила 71,1%, средняя продолжительность жизни после установления диагноза – 12,5 лет. Неблагоприятным прогностическим фактором было наличие паттерна НСИП, в то время как серологических предикторов прогноза выявлено не было. У 12 (12,2%) пациентов с ИПАП в динамике отмечено развитие СЗСТ (в большинстве случаев – ревматоидного артрита).
К. Yoshimura с соавт. выделили подгруппу пациентов с ИПАП среди больных с фибротическими вариантами хронической ИП (ОИП и фиброзным вариантом НСИП) [23]. Среди классификационных критериев ИПАП чаще других встречались морфологические (97% пациентов), реже – серологические (72%) и клинические (53%). У пациентов с ИПАП были отмечены более высокая выживаемость и более низкая обострений основного заболевания. При анализе подгрупп у пациентов с ИПАП, сочетавшейся с паттерном НСИП, выживаемость была выше, чем у больных с идиопатической НСИП. Также следует отметить, что в данном исследовании была выявлена тенденция к более высокой выживаемости пациентов с ИПАП, у которых определялся паттерн ОИП, по сравнению с таковой больных с ИЛФ.
H. Chung и соавт. изучали морфологические предикторы прогноза у пациентов с ИПАП [24]. У большинства из них (65,4%) при КТВР был выявлен паттерн типичной или возможной ОИП. По данным однофакторного анализа, достоверными рентгенологическими признаками, ассоциированными со снижением выживаемости, были ретикулярные изменения, зоны «сотового легкого», мозаичная вентиляция (при отсутствии эмфиземы), а также увеличение диаметра легочной артерии. В то же время наличие паттерна ОИП по данным КТВР, а также степень выраженности фиброзных изменений в легких не позволяли предсказать прогноз. По данным многофакторного анализа, независимыми достоверными предикторами неблагоприятного прогноза оказались только зоны «сотового легкого» и увеличение диаметра легочной артерии.
Таким образом, большинство данных, характеризующих группу пациентов с ИПАП, получены в ретроспективных одноцентровых исследованиях, что не позволяет экстраполироват их на всю популяцию таких больных. Этим также может частично объясняться выраженная неоднородность результатов вышеуказанных работ. В частности, в настоящее время остается до конца не выясненным прогностическое значение паттерна ОИП у пациентов с ИПАП: в ряде исследований прогноз в данной подгруппе пациентов не отличался от такового у пациентов ИЛФ, в то время как авторы других работ не выявили сходной закономерности. Кроме того, следует отметить, что в большинстве исследований не учитывалось влияние проводимой иммуносупрессивной терапии на прогноз пациентов с ИПАП. С одной стороны, это ограничивает прогностическое значение полученных результатов исследований, а, с другой стороны, не позволяет разработать рекомендации относительно рациональной фармакотерапии данной патологии.
Обсуждение
Действующие в настоящее время критерии ИПАП были предложены в 2015 г. группой экспертов в области пульмонологии и ревматологии с целью выделения отдельной когорты пациентов с ИИП и признаками системных аутоиммунных заболеваний, не соответствующих классификационным критериям конкретного СЗСТ. Преимущество предложенной классификации заключается в том, что она заменила множество введенных ранее и различающихся между собой определений ИПАП, а также стала основой для разработки критериев включения пациентов в клинические исследования, необходимые для изучения этой патологии.
С учетом новых данных, полученных в группах пациентов с ИПАП, ряд исследователей предлагают различные варианты пересмотра и доработки существующих критериев заболевания. В частности, G. Sambataro и соавт. [18] указывают на то, что наличие среди критериев ИПАП специфичных или даже патогномоничных признаков СЗСТ (симптом Готтрона [25], «рука механика», антитела к цитруллинированному пептиду, АТСА и ряд других аутоантител) не является рациональным. Это объясняется тем, что классификационные критерии ИПАП пересекаются с таковыми недифференцированного заболевания соединительной ткани 27 или с критериями, предложенными для ранней диагностики некоторых СЗСТ. Таким образом, в дебюте часть СЗСТ могут ложно классифицироваться как ИПАП. Примером могут служить критерии ранней диагностики системной склеродермии (very early diagnosis of systemic sclerosis, VEDOSS) [28], которые позволяют идентифицировать пациентов с высоким риском развития этого заболевания. Данная группа пациентов представляет большой интерес, особенно учитывая тот факт, что наличие явных «склеродермических» признаков позволяет не только установить диагноз, но и начать лечение на ранней стадии заболевания.
Кроме того, критериям ИПАП может соответствовать часть пациентов с антисинтетазным синдромом. Принимая во внимание отсутствие единых международных критериев этого синдрома, пациентам с ИП и антисинтетазными антителми (АТСА) может был установлен диагноз как антисинтетазного синдрома, так и ИПАП, несмотря на высокий риск развития у них остальных клинических проявлений классической триады симптомов (артрит и/или миозит) [29]. В отношении антисинтетазного синдрома существует еще одна проблема: с одной стороны, у всех пациентов с ИП необходимо определять антитела, ассоциированные с воспалительными миопатиями, однако на практике в большинстве клинических лабораторий полный перечень данных аутоантител рутинно не исследуется, поэтому антисинтетазный синдром может остаться недиагностированным.
Рядом исследователей были предложены дополнения к существующему определению ИПАП, в частности в серологическую группу критериев рекомендовано включение дополнительных антител, таких как АНЦА [30] и анти-Ku антитела [31]. Уже описаны когорты пациентов с АНЦА-позитивной ИП. Тем не менее, на настоящий момент количество данных относительно этой группы больных весьма ограничено. H. Yamada описал группу из 92 пациентов с ИП, которую ранее классифицировали как ИЛФ с наличием АНЦА [32]. В данной когорте у 35,8% отмечалось наличие АНЦАассоциированного васкулита в дебюте заболевания, еще у 17,4% пациентов он развился в течение нескольких лет после установления диагноза, а у оставшихся 46,8% пациентов ИП оставалась единственным клиническим проявлением заболевания. У части пациентов при биопсии легкого определялись признаки васкулита с поражением интерстиция и/или бронхов. Авторами статьи предложено два возможных механизма формирования интерстициальных изменений в легких при наличии АНЦА. Первый предполагает развитие интерстициального фиброза в результате субклинических альвеолярных геморрагий. В соответствии со второй гипотезой в ответ на образование воспалительных цитокинов миелопероксидаза экспрессируется на поверхности нейтрофилов, что может приводить к фиксации циркулирующих АНЦА с последующей дегрануляцией нейтрофилов и высвобождением активных форм кислорода, которые вызывают повреждение легочной ткани и развитию фиброза. Второй механизм, в частности, способен объяснить развитие АНЦА-ассоциированной ИП без признаков системного васкулита.
Таким образом, текущие диагностические критерии ИПАП охватывают весьма неоднородную группу пациентов, в связи с чем в большинстве исследований проводился поиск прогностических факторов выживаемости пациентов с ИПАП. Особый интерес вызывает морфологический паттерн ОИП, относительно значения которого в настоящее время нет единого мнения. Отсутствие ОИП в группе морфологических критериев ИПАП, с одной стороны, и более низкая выживаемость в данной подгруппе пациентов по результатам ряда исследований, с другой стороны, ставят вопрос о том, не должны ли пациенты с ОИП исключаться из клас сификационной группы ИПАП. Тем не менее, до появления данных проспективных исследований, подтверждающих внутригрупповую неоднородность ИПАП, выявления достоверных предикторов прогноза выживаемости и ответа на различные варианты терапии, пациентов с ОИП следует включать в группу ИПАП при наличии клинических и/или серологических критериев данного диагноза [33].
В ближайшем будущем необходимо проведение проспективных клинических исследований с целью изучения эффективности иммуносупрессивных, и возможно, антифибротических препаратов у пациентов с ИПАП. При большинстве вариантов СЗСТ-ИП и не-ОИП вариантах идиопатической ИП основной медикаментозной терапии являются глюкокортикостероиды, которые в части случаев сочетают с иммунодепрессивными и генно-инженерными биологическими препаратами, однако они неэффективны при ИЛФ, который представляет собой вариант идиопатической ИП с рентгенологическим паттерном ОИП [34,35]. Учитывая доказанную эффективность антифибротической терапии у пациентов с ИЛФ, не исключена возможность ее применения у части пациентов с ИПАП.
Заключение
Диагноз ИПАП был введен с целью унификации группы пациентов с ИП, у которых определяются отдельные симптомы системных аутоиммунных заболеваний. Тем не менее, данные клинических исследований указывают на то, что текущее определение ИПАП, вероятно, не позволяет выделить однородную популяцию больных. Уточнение классификационных критериев ИПАП может оказаться полезным для выделения отдельных вариантов этого состояния, отличающихся по клиническому течению, ответу на терапию и прогнозу, в том числе вероятности развития определенных системных заболеваний соединительной ткани. Для подтверждения данной гипотезы требуется проведение многоцентровых проспективных исследований с междисциплинарным подходом к диагностике и выбору терапии пациентов с ИПАП.
