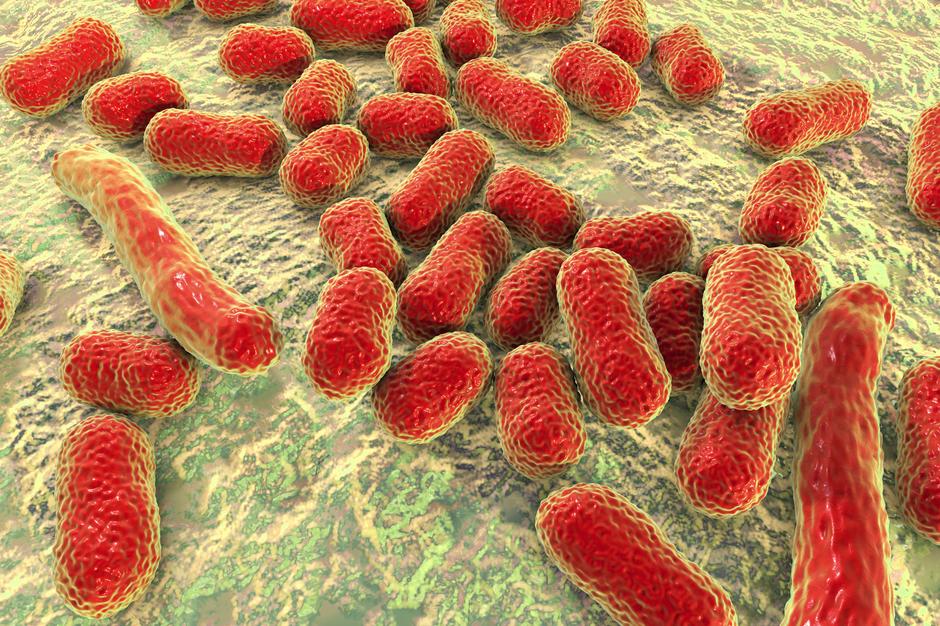
Ацинетобактер баумании что это такое простыми словами
После открытия пенициллина человечество решило, что с инфекционными болезнями покончено. Но были проигнорированы правила эволюции и дрейфа генов. Человек изобретает всё новые антибиотики, а микроорганизмы укрепляют свои стенки, ускоряют процессы репликации и маскируются под клетки хозяина.
Проблема нозокомиальных инфекций, устойчивых к антибиотикам, стала настолько серьёзной, что недавно ей посвятили заседание Генеральной Ассамблеи ООН. Согласно представленным данным, из-за лекарственно-устойчивых инфекций ежегодно умирают более 700 000 человек. Не поддающиеся системам биологической защиты и лекарствам микробы встали в один ряд с глобальным изменением климата.
Во многих странах наблюдается рост заражения внутрибольничными инфекциями в стационарах лечебных учреждений, что существенным образом связано с распространением штаммов микроорганизмов, устойчивых к различным антибактериальным препаратам и системам биологической защиты.
В отделениях реанимации и интенсивной терапии, а также в ожоговых отделениях данный микроорганизм может явиться причиной развития разнообразных инфекционных осложнений: от госпитальной пневмонии до сепсиса.
Эта бактерия обладает механизмами, обеспечивающими устойчивость к подавляющему большинству антибиотиков, к дезинфицирующим средствам, высушиванию, а также к ультрафиолетовому облучению. Ее патогенность обусловлена суммарным действием ряда факторов на системы биологической защиты. Одним из таких факторов являются капсульные полисахариды – поверхностные структуры, формирующие толстую клеточную стенку.
Ученые исследовали литические бактериофаги, которые после заражения бактериальной клетки и периода размножения разрушают бактерию изнутри. Литические фаги не влияют на нормальную микрофлору, не активируют системы биологической защиты, соответственно, не вызывают развития дисбактериозных процессов. Бактериофаги способны реплицироваться до уничтожения всех бактерий.
Актуальность проблемы заражения внутрибольничными инфекциями заставляет искать новые и эффективные методы решения этой проблемы на международном уровне. При совместной работе российских и белорусских микробиологов была изучена организация геномов vB_AbaP_AS11 и vB_AbaP_AS12, описана стратегия взаимодействия систем биологической защиты, вирусов и бактериальных клеток. В результате были найдены эффективные с широким спектром природной и приобретенной резистентности бактериофаги (AS11 и AS12) рода Fri1virus, подсемейства Autographivirinae семейства Podoviridae. Литическая активность бактериофагов была протестирована на 100 клинических антибиотикоустойчивых штаммах Acinetobacter baumannii из 53 больниц и 32 городов России и Белоруссии. Для этих фагов характерны быстрая адсорбция к бактериальной клетке-хозяину и высокая плодовитость.
Для лечения внутрибольничных инфекций необходимы самые современные лекарства, к которым опасная бактерия еще «не привыкла». Таким образом, антибактериальная терапия превращается в бесконечную гонку, в которой, как показывает совместная работа российских и белорусских ученых, у человечества есть шанс одержать победу.
Ацинетобактер
Автор: врач – клинический фармаколог Трубачева Е.С.
Автор: врач – клинический фармаколог Трубачева Е.С.
Если еще каких-то 7 лет назад ацинетобактер была зверем, о котором знали реаниматологи крупных больниц да клинические фармакологи, то менее пяти лет назад ситуация кардинально изменилась – теперь про ацинетку знают все, кто в том или ином виде работает в стационарах. Она очень быстро заместила собой всю предыдущую внутрибольничную микрофлору и фактически вышла на первый план самых проблемных внутрибольничных микробов, заняв чуть ли не основную нишу ВБИ.
Автор сразу хотел бы предупредить, что речь здесь пойдет не столько об Acinetobacter baumannii, сколько о семействе ацинетобактеров, ибо клиническую значимость имеет не только вышеупомянутый возбудитель.
Ацинетобактеры являются представителями тройки основных опасных возбудителей согласно определению ВОЗ. Двух других представителей из этого списка мы уже обсудили: это синегнойная палочка и энтеробактерии (клебсиелла, кишечная палочка, энтерококки). Именно для этой могучей тройки в первую очередь и должны разрабатываться новые антибиотики, но пока с этим как-то не очень.
Микробиологические аспекты
Ацинетобактер (или ацинетка, как любит обзывать ее автор), является фактически «кровной родней» другого общеизвестного неферментера – синегнойной палочки. Но, в отличие от синегнойки, природно-устойчивого ацинетобактера вам могут принести прямо с улицы. То есть в природе имеются штаммы, и в очень большом количестве, которые изначально природно-устойчивы фактически ко всему арсеналу имеющихся в медицине антибиотиков. А еще таких же, но уже внутрибольничных мутантов не менее «удачно» выращивают в отделениях с высокой частотой использования антибактериальных препаратов. И это при том, что принести такого микроба в больницу, а также занести его в больного, может вообще любой человек, так как изначально ацинетка, как и синегнойка, является почвенным микробом, а потому горшки с цветами, садоводы-огородники, зимой растящие рассаду, летом ковыряющиеся на даче, а потом, нормально не отмыв руки, начинающие перевязывать раны или менять катетеры, да просто посетители с пылью на ботинках – все они в каждый момент времени приносят в больницы миллиарды подобных микробов. И это как раз то, о чем автор упоминал в разговоре о клебсиелле – вывести ацинетку, в отличие от синегнойки, несопоставимо труднее. Напомню, синегнойка предпочитает мокрую теплую грязь, поэтому ее проще отсечь от заноса в чистые отделения и внутри самой больницы проще выбить. А теперь представьте, чего будет стоить избавиться от пыли, комнатных растений, любителей-огородников и ломящихся, теперь уже даже в реанимации, посетителей. Практически нереально, если это только не ламинарный бокс.
Поэтому будем изучать врага в лицо
Общее представление о том, что из себя представляют дикие и непуганые антибиотиками ацинетобактеры, можно составить на EUCAST. Для тех, кто никогда не пользовался данным ресурсом, небольшая подсказка – тыкаем мышкой (или пальцем, смотря откуда читаете этот опус) в плашку «Species», выбираем один из 25-ти ацинетобактеров и наслаждаемся изучением. Общую антибиотикочувствительность семейства Acinetobacter spp. можно рассмотреть тут. Небольшое пояснение для тех, кто здесь впервые, – клинически значимыми минимальными подавляющими концентрациями (MIC), которыми можно и нужно пользоваться в клинической практике (а также как маркер того, какие антибиотики будут работать, а какие нет – их MIC указаны с чисто исследовательскими целями), являются показатели, отмеченные синими клеточками. На эти же показатели настроены аппараты для определения антибиотикочувствительности, с помощью которых продемонстрированы антибиотикограммы в наших статьях.
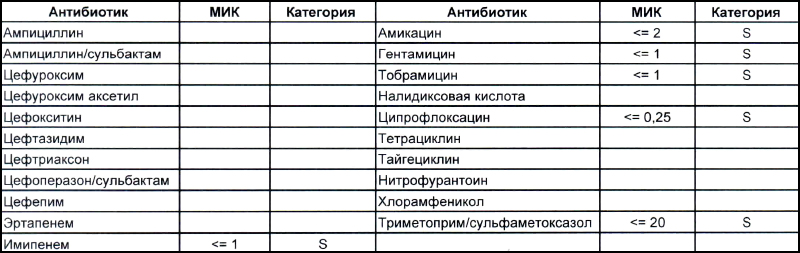
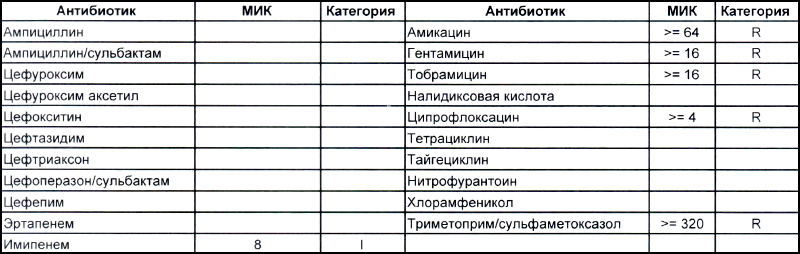
Теперь посмотрим на, можно сказать, типичных представителей семейства Acinetobacter spp. Необходимо отметить, что продемонстрированные ниже возбудители выделены из ран, полученных в результате ДТП в летнее время, причем у пациентов, которые длительное время не лечились антибиотиками, то есть оба зверя являются дикими.
На первом фото лечащему врачу повезло, так как ему достался возбудитель, чувствительный ко всему возможному арсеналу антибиотиков, которые в принципе могут повлиять на данный микроб.
На второй антибиотикограмме возбудитель тоже получен из раны, ни разу не леченной антибиотиками, а также сам больной длительное время ничего антибактериального не употреблял. Данный случай очень хорошо демонстрирует то, что мы обсудили раньше, – только по антибиотикограмме в случае ацинеток трудно сказать, внутрибольничный возбудитель вызвал гнойно-воспалительный процесс или дикий уличный.
В научно-исследовательском институте, который может провести генетическое исследование возбудителя, смогут выяснить полностью, дикий это штамм или внутрибольничный, а мы, работающие на земле, скорее всего, не ответим на этот вопрос. Правда, у нас теперь СК все про всех знает, и автор уже давно ждет, когда очередного несчастного еще и в такого рода заражении обвинят.
Следует отметить, что обе эти картинки не отменяют факта наличия внутрибольничного заражения как первым штаммом (горшки с цветами помним?), так и вторым, в который под действием использующихся в больнице антибиотиков может выродиться первый. Ациентка, как и предыдущие обсуждаемые возбудители ВБИ, так же не имеет крылышек и ножек, ее точно так же переносят на руках и плохо обработанном медицинском оборудовании (эндоскопы, точнее, бронхоскопы, это просто бич крупных стационаров). Поэтому только внутриведомственный микробиологический надзор и работа над соблюдением санэпидрежима помогает удержать и эту зверюгу в хоть каких-то приемлемых рамках.
Клинические аспекты
Что способен вызвать ацинетобактер?
В общем, как вы можете видеть, ацинетка способна загубить на корню любой врачебный труд, так как инфекции, ей вызванные, имеют высокий процент летальности у пациентов, имеющих факторы риска развития подобной инфекции.
К факторам риска относятся:
Чем лечить?
Хороший вопрос. Точно такой же, как «чем лечить внутрибольничную клебсиеллу», которым мы задавались ранее.
Как вы могли убедиться, лечить ацинетку эмпирически (а это возможно только при тщательном внутрибольничном мониторинге), и даже с использованием диско-диффузионного метода, не очень-то и получится. Точнее, не получится совсем. Нужны аппаратные методы диагностики, чтобы точно знать, с чем вы имеете дело. И внутрибольничный мониторинг тоже крайне необходим, особенно если неферментеры сеются массово, чтобы знать — заполз ли возбудитель с улицы или уже свой зверинец развели. Во втором случае только мыть-мыть и еще раз мыть всю больницу полностью, а не только одно отделение, а также переходить на полностью одноразовые расходники, и к аппаратам ИВЛ тоже. Автор понимает, что при этих словах или в монитор захочется плюнуть, или помидором тухлым швырнуть, благо сезон пока не закончен.
Так как лечить?
В рамках клинических рекомендаций по той нозологии, которая у вашего пациента имеется, выложенных здесь, всегда только комиссионно, с привлечением клинических фармакологов и клинических микробиологов. И мойте руки после каждого подобного пациента очень тщательно — это ваша личная техника безопасности.
Выбор для Acinetobacter baumannii: умереть от бактериофага или от антибиотика
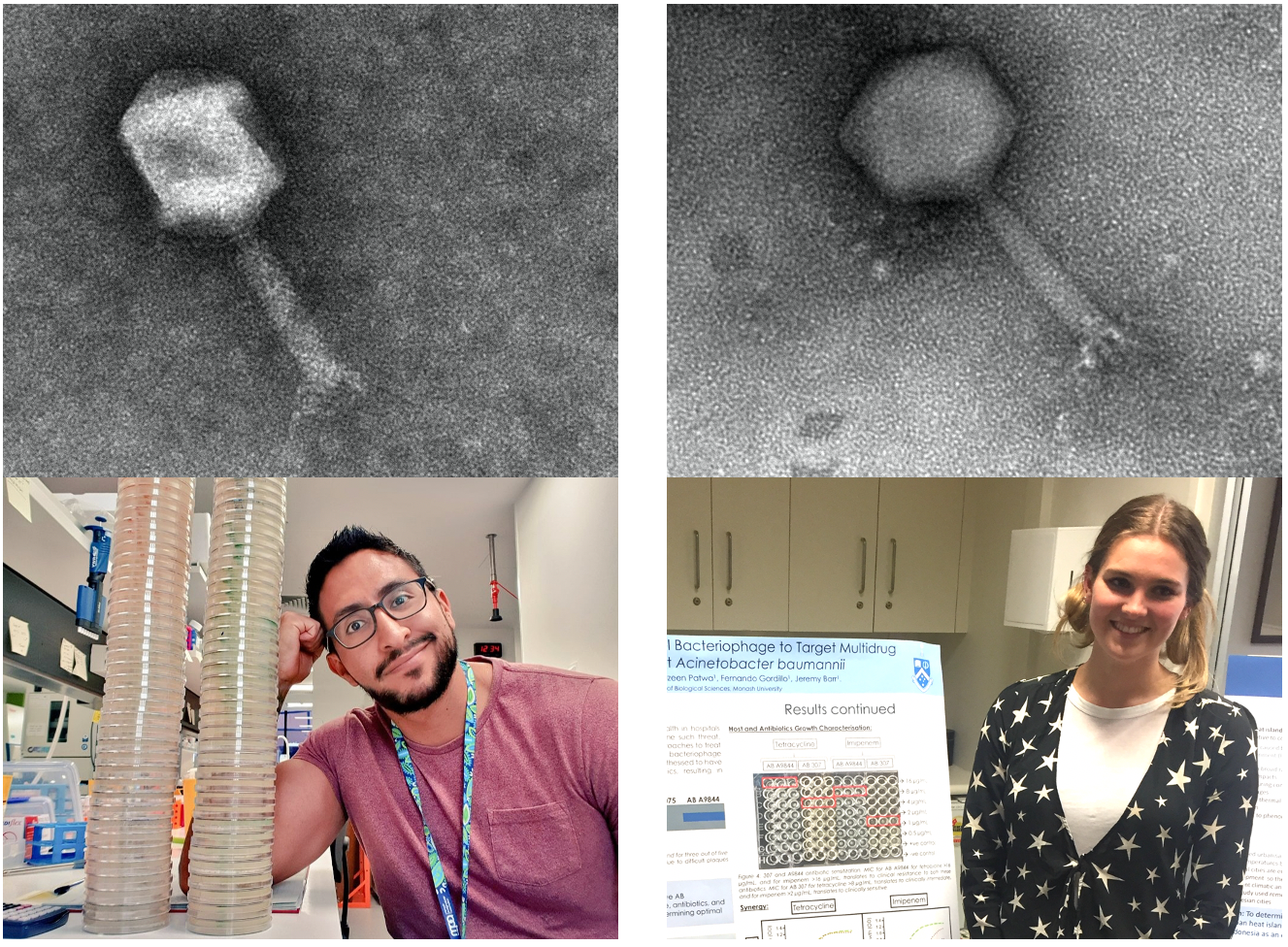
Acinetobacter baumannii — опасный противник. Известный своей устойчивостью к высыханию, истощению запаса питательных веществ и дезинфектантам, A. baumannii тяжело поддается уничтожению, когда бактерия приживается на медицинских объектах [1]. Способный избегать воздействия многих антибиотиков, A. baumannii представляет серьезную проблему для врачей и медперсонала, которые лечат зараженных пациентов и ухаживают за ними [2]. Всемирной организацией здравоохранения эта угроза признана, а A. baumannii получил статус важнейшего приоритета для исследований и разработки новых противомикробных препаратов [3]. В статье «Устойчивые к бактериофагам Acinetobacter baumannii получили повторную чувствительность к противомикробным препаратам» авторами продемонстрировано, что фаги могут дать второе дыхание для применения антибиотиков, которые уже есть в распоряжении врачей.
Идея, лежащая в основе этого проекта, возникла после того, как первый автор, Джереми Барр, ныне заведующий лабораторией в Школе биологических наук университета Монаша в Австралии, принял участие в первом клинически успешном применении фаговой терапии против системного A. baumannii, зарегистрированного в США [4, 5]. После последовательного приема смесей фагов командой ученых были осуществлены три, казалось бы, не связанных между собой наблюдения. Во-первых, изолят A. baumannii, полученный от пациента, приобрел устойчивость к смеси фагов. Во-вторых, он потерял устойчивость к антибиотику миноциклину. В-третьих, было выявлено, что бактерии потеряли полисахаридную капсулу. Могут ли быть связаны эти обнаруженные явления? И если да, то как? Это и стало отправной точкой в исследовании ученых.
Чтобы собрать вместе детали головоломки, ученые использовали два филогенетически отдаленных клинических штамма A. baumannii и два разных бактериофага, выделенных из неочищенных сточных вод. Как сказал один из авторов, Фернандо Гордиллио Альтамирано, эта работа является свидетельством того, как часто его любовь к микробиологии подвергалась проверке на прочность при работе с образцами неочищенных сточных вод (их помещали в инкубатор на ночь, добавляя в пробирки богатую питательными веществами среду). Фернандо Альтамирано приносит коллегам свои извинения за то, что запах смесей из сточных вод часто вынуждал их покидать лабораторию. Выделение фагов может оказаться сложной задачей, и, похоже, Фернандо Альтамирано положил начало тенденции в качестве награды в их исследовательской лаборатории давать фагам имена людей, которые их выделяют. В статье присутствуют изображения фагов øFG02 (Фернандо Альтамирано) и øCO01 (Коди Оливьера).
Исследователи обнаружили, что открытые ими фаги используют полисахаридные молекулы капсулы A. baumannii в качестве своего основного рецептора. Ученые пришли к такому выводу после наблюдения следующего:
То, что казалось простым процессом, на самом деле оказалось самым сложным шагом в исследовании. Ученые выявили, что с бактерией A. baumannii сложно проводить генетические манипуляции, а многочисленные попытки трансформации (естественной, химической и электропорацией) оказались безуспешными. Успешные же попытки экспериментов ученые связывают с фактором везения и настойчивостью соавторов Джона Форсайта и Рузин Патва.
Бактериальная капсула — основной фактор вирулентности A. baumannii, защищающий ее от иммунной системы, снижая проницаемость для антибиотиков [6]. Опираясь на фактические сведения, ученые полагают, что толстая капсула исследуемых штаммов дикого типа также играет роль в их очень низкой степени трансформации. В любом случае, исследователи были взволнованы, узнав, что капсуло-дефицитный, устойчивый к фагам A. baumannii стал повторно чувствительным к системе комплемента человека и пострадал от снижения до минимальных ингибирующих концентраций семи антибиотиков, в первую очередь β-лактамов, но также и миноциклина. Выделенные учеными фаги поставили A. baumannii перед дилеммой: умереть от фага или от антибиотика. Результаты исследования подчеркивают важность для терапии идентификации бактериальных рецепторов, которые используются любым фагами; они также вдохновили ученых на статью о перспективах, в которой они размышляют на эту тему [7].
Только в течение последнего десятилетия среди патогенных штаммов микробов, таких как Pseudomonas aeruginosa [8], Enterococcus faecalis [9], Staphylococcus aureus [10] и Klebsiella pneumoniae [11], было выявлено подобное взаимодействие между механизмами устойчивости к фагам и бактериальной адаптацией. Авторы данной работы добавляют в этот список бактерий A. baumannii, что еще раз подчеркивает многогранный потенциал фаговой терапии в борьбе с антибиотикорезистентностью.
Ацинетобактеры баумании, джонсон, питии: описание, в моче и полости рта, лечение
Acinetobacter – повсеместно распространенный, свободно живущий, сапрофитный микроорганизм, обитающий у здоровых людей на коже, в кишечнике и урогенитальном тракте. Эти микробы обычно колонизируют участки кожного покрова на ногах и в паху. Чаще всего бактерии вызывают внутрибольничные инфекции, имеющие вялотекущий характер, а также пищевые токсикоинфекции и диарею путешественников. Большинство микробов рода Acinetobacter чрезвычайно устойчивы к проводимой терапии.
Микроорганизмы рода Acinetobacter — это плеоморфные грамотрицательные палочки, которые легко спутать с микроорганизмами рода Neisseria. Тяжелые инфекции, вызванные этими микроорганизмами, включая менингит, бактериальный эндокардит, пневмонию, бактериемию, описывают с возрастающей частотой.
Ацинетобактеры — что это за бактерии?
Виды родов Acinetobacter являются строго аэробными, неферментирующими, грамотрицательными бациллами. На неселективном агаре они демонстрируют в основном коккобациллярную морфологию. Палочки преобладают в жидких средах, особенно в период раннего роста.
Болезни, вызываемые Acinetobacter (АВ)
Наиболее распространенными проявлениями заболеваний, вызванных Acinetobacter, являются:
Инфекции AB, как правило, выявляют у пациентов, госпитализированных в критическом состоянии. Внебольничные инфекции (преимущественно, пневмония) чаще возникают в тропическом климате. Уровень смертности, связанный с инфекцией AB, составляет 19–54%.
Acinetobacter часто колонизирует места трахеостомы и может вызывать внебольничный бронхиолит и трахеобронхит у здоровых детей и трахеобронхит у взрослых с ослабленным иммунитетом. Приобретенные в больнице пневмонии, вызванные Acinetobacter, часто многодолевые и осложненные. Характерны вторичная бактериемия и септический шок, что предопределяет неблагоприятный прогноз.
Вид Acinetobacter может также вызывать раневые инфекции и гнойные инфекции (например, абсцессы) в любой системе организма, включая легкие, мочевыводящие пути, кожу и мягкие ткани; возможна бактериемия.
В редких случаях эти микроорганизмы вызывают менингит (прежде всего после нейрохирургических процедур), флегмону или флебит у пациентов с постоянным венозным катетером, глазные инфекции, эндокардит нативного или искусственного клапана, остеомиелит, септический артрит или абсцессы поджелудочной железы и печени.
Значимость Acinetobacter изолятов из клинических образцов, таких как секрет из органов дыхания у интубированных пациентов или из открытых ран, определить трудно, потому что они часто представлены колониями.
Эпидемиология
Ацинетобактерии охотно заселяют любые биотопы с минимально подходящими для них условиями и контаминируют самые разнообразные объекты. Штаммы бактерий обнаруживают во всех образцах почвы и воды, на коже и слизистых оболочках верхних дыхательных путей здоровых людей.
Бактерии рода Acinetobacter выделяют также из пастеризованного молока, замороженных продуктов, воздуха стационаров и смывов с различного медицинского оборудования. Они обладают низкой вирулентностью и являются нормальными обитателями организма человека. Появление микробов в большом количестве на коже, в мокроте или моче указывает не на развитие инфекционного процесса, а на колонизацию или контаминацию.
Источником и резервуаром инфекции являются инфицированные и больные люди, а также контаминированные предметы. Распространение бактерий осуществляется воздушно-капельным, контактно-бытовым, гематогенным путями.
Факторы, предрасполагающие к развитию инфекции:
Для ацинетобактерной инфекции характерна сезонность вспышек в летний сезон, что связано с увеличением колонизации кожи микробами за счет потливости.
A. baumannii – микроб, обитающий преимущественно в водных объектах: искусственных и естественных водоемах. На сухой поверхности бациллы сохраняют свою жизнеспособность в течение месяца. В лечебно-профилактических учреждениях ацинетобактер колонизирует растворы многоразового использования.
Acinetobacter spp. вызывают назокомиальные инфекции у истощенных, физически ослабленных или умственно отсталых больных. Микробы обладают тропностью к эпителию респираторного и урогенитального трактов, ликвору, крови, перитонеальной жидкости. У иммуноскомпрометированных больных обычно развиваются пневмонии, бактериемия, септицемия, менингит, эндокардит, абсцессы мозга и легких, эмпиема плевры, медиастенит, перитонит.
В стационарных условиях A. baumannii колонизирует:
Симптоматика
Ацинетобактерии – условно-патогенный микроорганизм, вызывающий инфекционный процесс только при снижении иммунной защиты.
A. calcoaceticus — возбудитель воспалительных процессов в легочной ткани, урогенитальном тракте, крови. A. junii вызывает у больных бактериемию и сепсис, гнойное воспаление подкожно-жировой клетчатки. A. lwoffii и A. pittii — возбудители гастрита и колита, а A. haemolyticus — кровавой диареи.
Инфекции кровотока, вызванные A. baumannii протекают в форме бактериемии или сепсиса. Входными воротами являются внутрисосудистые катетеры. Микробы могут проникать в кровь из имеющихся очагов – мочевыводящих путей, инфицированных мягких тканей, ожоговых поверхностей, органов брюшной полости и ЦНС. Молниеносная бактериемия проявляется выраженной лихорадкой, сосудистым коллапсом, петехиями, массивными подкожными кровоизлияниями. При отсутствии эффективной терапии у 30% пациентов развивается инфекционно-токсический шок.
При инфицировании дыхательных путей развиваются нозокомиальные пневмонии, которые характеризуются одновременным поражением нескольких сегментов, формированием полостей, плевральным выпотом, образованием бронхоплевральной фистулы. У больных на фоне тяжелой интоксикации появляется удушающий кашель с гнойной мокротой, одышка, дыхание становится шумным с влажными хрипами. Ацинетобактерная пневмония имеет тяжелое течение и с трудом поддается лечению. Нередко она заканчивается смертью больных.
A. baumannii – значимый патоген, инфицирующий ожоговые поверхности и послеоперационные раны. Инфекции кожи и мягких тканей часто осложняются бактериемией. Этот микроб является возбудителем назокомиального менингита и абсцедирования мозгового вещества. У больных возникают характерные признаки: интоксикация, очаговая симптоматика, менингеальные знаки. На коже появляется петехиальная сыпь, в ликворе — плейоцитоз, увеличение уровня белка и молочной кислоты, снижение глюкозы.
Ацинетобактерии в более редких случаях вызывают:
Диагностика
Основным диагностическим методом ацинетобактерной инфекции является бактериологический. Он заключается в правильном заборе материала, быстрой его доставке в лабораторию, идентификации выделенного возбудителя, определении его этиологической значимости и чувствительности к антибактериальным средствам.
Материал отбирают до начала противомикробной терапии непосредственно из очага инфекции с соблюдением правил асептики, предупреждающих его контаминацию посторонней микрофлорой. Отбор осуществляют стерильным ватным тампоном, который помещают в специальные транспортные среды. Жидкий биоматериал помещают в стерильные и плотно закрывающиеся контейнеры. Пробы доставляют в лабораторию не позднее 1,5–2 ч от момента отбора.
Материал засевают на жидкие и плотные питательные среды, инкубируют в термостате и учитывают результаты. На плотных средах образуются гладкие, непрозрачные, блестящие, мелкие колонии. На КА через 48 ч формируются выпуклые серовато-белые колонии, иногда окруженные зоной гемолиза.
Микроскопическое исследование заключается в изучении окрашенного препарата под световым микроскопом. В мазках из нативного материала доминируют кокки и коккобациллы, а в мазках из культур — палочковидные формы. Ацинетобактерии относятся к грамотрицательным микробам. После выделения чистой культуры проводят идентификацию возбудителя по биохимическим свойствам. Ацинетобактер не ферментирует лактозу и окисляет глюкозу до кислоты.
Обнаружение ацинетобактерий в мокроте в количестве 106 КОЕ/мл – диагностически значимый критерий. В бронхиальном смыве это количество составляет 104 КОЕ/мл, а в моче 105 КОЕ/мл.
Лечение
Лечение ацинетобактерной инфекций — серьезная проблема, актуальность которой растет с каждым днем. Это связано с увеличением частоты встречаемости микробов, повышением их резистентности к лекарствам и снижением эффективности проводимой терапии.
Этиотропное противомикробное лечение заключается в применении следующих препаратов:
При необходимости используют комбинации:
Выбор антибиотика основывается на результатах антибиотикограммы.
При локализованных абсцессах, вызванных этими микроорганизмами, необходимо применять хирургическое дренирование.
Acinetobacter spp. – достаточно проблематичный возбудитель тяжелых состояний и заболеваний, встречающихся в пульмонологической и терапевтической практике. Бактерии вызывают нозокомиальную пневмонию и муковисцидоз, а также целые ряд внебольничных патологий. Эти микроорганизмы обладают природной устойчивостью и приобретенной резистентностью.
Большинство штаммов имеют мультирезистентность — устойчивость к основным группам антибиотиков. Члены научного медицинского общества ведут активное наблюдение за состоянием чувствительности таких микробов, создают формуляры и стандарты применения противомикробных средств.
Победить паразитов можно!
Сейчас действует льготная программа на бесплатную упаковку. Читать мнение экспертов.
Как аскарида использует в процессе дыхания кислород, дыхание аскариды
Демодекс под микроскопом, фото под увеличением, описание и внешний вид
Амеба в ротовой полости, какие заболевания вызывает и как ее лечить
Легионелла: возбудитель легочной пневмонии, симптомы и лечение
Какие бактерии возбудители инфекционных болезней
Болезни, вызванные лямблиями: симптомы и методы лечения
Список литературы
Лучшие истории наших читателей
Тема: Во всех бедах виноваты паразиты!
От кого: Людмила С. ([email protected])
Кому: Администрации Noparasites.ru
Не так давно мое состояние здоровья ухудшилось. Начала чувствовать постоянную усталость, появились головные боли, лень и какая-то бесконечная апатия. С ЖКТ тоже появились проблемы: вздутие, понос, боли и неприятный запах изо рта.
Думала, что это из-за тяжелой работы и надеялась, что само все пройдет. Но с каждым днем мне становилось все хуже. Врачи тоже ничего толком сказать не могли. Вроде как все в норме, но я-то чувствую, что мой организм не здоров.
Решила обратиться в частную клинику. Тут мне посоветовали на ряду с общими анализами, сдать анализ на паразитов. Так вот в одном из анализов у меня обнаружили паразитов. По словам врачей – это были глисты, которые есть у 90% людей и заражен практически каждый, в большей или меньшей степени.
Мне назначили курс противопаразитных лекарств. Но результатов мне это не дало. Через неделю мне подруга прислала ссылку на одну статью, где какой-то врач паразитолог делился реальными советами по борьбе с паразитами. Эта статья буквально спасла мою жизнь. Я выполнила все советы, что там были и через пару дней мне стало гораздо лучше!
Улучшилось пищеварение, прошли головные боли и появилась та жизненная энергия, которой мне так не хватало. Для надежности, я еще раз сдала анализы и никаких паразитов не обнаружили!