Ацетат аммония гидролиз по чему
Гидролиз ацетата аммония
Общие сведения о гидролизе ацетата аммония
Формула – CH3COONH4. Представляет собой бесцветные кристаллы. Молярная масса – 56 г/моль.
Гидролиз ацетата аммония
Гидролизуется по катиону и аниону. Характер среды – нейтральный. Уравнение гидролиза выглядит следующим образом:
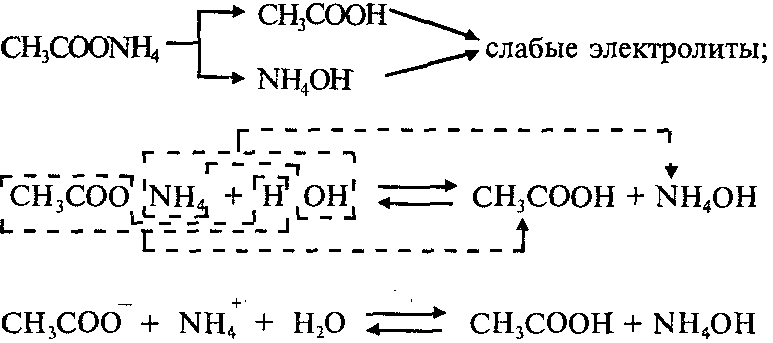
NH4 + +HOH↔NH4OH + H + (гидролиз по катиону);
CH3COO — + HOH↔ CH3COOH + OH — (гидролиз по аниону);
Примеры решения задач
| Задание | Какие продукты образуются, если ацетат аммония нагреть до 200 0 С. Запишите уравнение реакции. |
| Решение | При нагревании многих солей происходит их разложение, однако, в случае с ацетатом аммония это не так. Имеет место перегруппировка. В ходе реакции образуется ацетамид (амид уксусной кислоты) и вода: |
| Задание | Укажите основные области применения ацетата аммония. |
| Ответ | Ацетат аммония применяется в качестве пищевой добавки, известной под названием Е264 и представляющей собой консервант. Это вещество также используют при производстве противогололедных материалов, которыми обрабатывают автомагистрали. Ацетат аммония один из компонентов ацетатного буферного раствора. Его применяют в органическом синтезе, например в реакции Кнёвенагеля. |
Копирование материалов с сайта возможно только с разрешения
администрации портала и при наличие активной ссылки на источник.
Гидролиз
По катиону, по аниону или нет гидролиза?
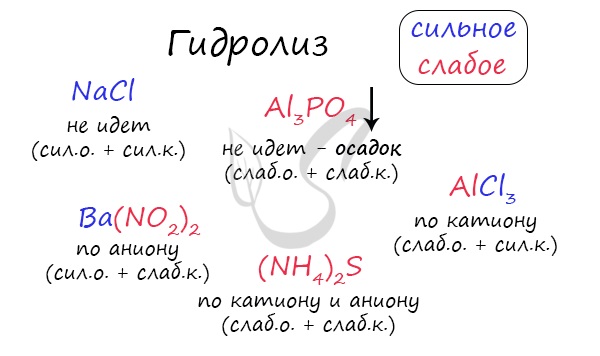
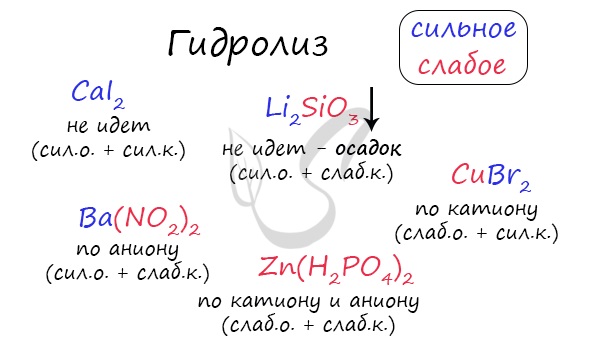
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
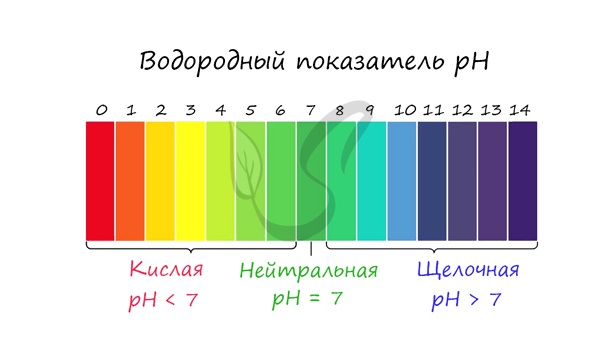
С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
Гидролиз солей
Водные растворы солей имеют разные значения рН и показывают различную реакцию среды — кислую, щелочную, нейтральную.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение).
Гидролиз — одно из важнейших химических свойств солей.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами ОН — или ионами водорода Н + из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо.
Гидролиз — процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой HClO и сильным основанием NaOH.
В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа:
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу
Рассмотрим примеры гидролиза различных типов солей.
I. Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по аниону. Эти соли образованы катионом сильного основания и анионом слабой кислоты, который связывает катион водорода Н + молекулы воды, образуя слабый электролит (кислоту).
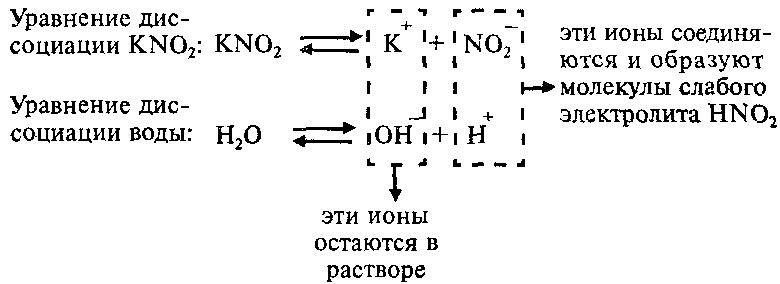
Пример: Составим молекулярное и ионные уравнения гидролиза нитрита калия KNO2.
Соль KNO2 образована слабой одноосновной кислотой HNO2 и сильным основанием KОН, что можно изобразить схематически так:
Напишем уравнение гидролиза соли KNO2:
Каков механизм гидролиза этой соли?
Вывод: Соли, образованные сильным основанием и слабой кислотой, при растворении в воде показывают щелочную реакцию среды, pН > 7.
II. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид-ион ОН — воды, образуя слабый электролит (основание).
Пример: Составим молекулярное и ионное уравнения гидролиза йодида аммония NH4I.
Соль NH4I образована слабым однокислотным основанием NH4OH и сильной кислотой НI:
Пример 1: Составим уравнения гидролиза ацетата аммония CH3COONH4. Эта соль образована слабой уксусной кислотой СН3СООН и слабым основанием NH4ОH:
Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Kд(СН3СООН)=Kд(NH4ОH).
Пример 2: Составим уравнения гидролиза цианида аммония NH4CN. Эта соль образована слабой кислотой HCN и слабым основанием NH4ОH:
Реакция раствора соли NH4CN — слабощелочная (pН > 7), потому что Kд(NH4ОH)> Kд(HCN).
Как уже было отмечено, для большинства солей гидролиз является обратимым процессом. В состоянии равновесия гидролизуется только небольшая часть соли. Однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз является необратимым.
Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах, К ним, например, относятся:
Пример: Составим уравнение гидролиза сульфида алюминия Al2S3:
Гидролиз сульфида алюминия протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S.
Поэтому в результате обменных реакций между водными растворами некоторых солей не всегда образуются две новые соли. Одна из этих солей может подвергаться необратимому гидролизу с образованием соответствующего нерастворимого основания и слабой летучей (нераствориой) кислоты. Например:
Суммируя эти уравнения, получаем:
IV. Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, потому что катионы и анионы этих солей не связываются с ионами Н + или ОН — воды, т. е. не образуют с ними молекул слабых электролитов. Равновесие диссоциации воды не смещается. Среда растворов этих солей — нейтральная (рН = 7,0), так как концентрации ионов Н + и ОН — в их растворах равны, как в чистой воде.
Вывод: Соли, образованные сильной кислотой и сильным основанием, при растворении в воде гидролизу не подвергаются и показывают нейтральную реакцию среды (рН = 7,0).
Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато. Рассмотрим случаи ступенчатого гидролиза.
Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водном растворе таких солей на первых ступенях гидролиза образуются кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуюгся соли Na2SO3, Rb2CО3, K2SiO3, Li3PO4 и др.
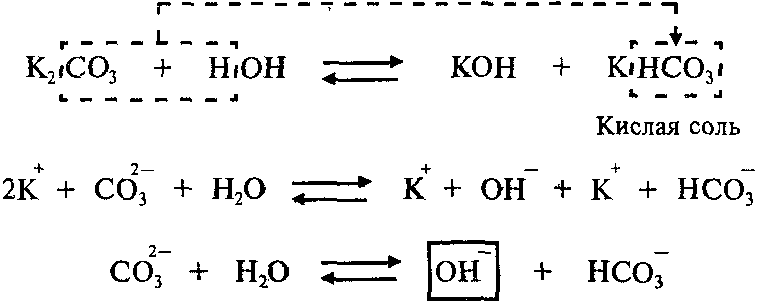
Пример: Составим молекулярное и ионное уравнения гидролиза карбоната калия K2СО3.
Гидролиз соли K2СО3 протекает по аниону, потому что соль карбонат калия образована слабой кислотой Н2СО3 и сильным основанием KОН:
Так как Н2СО3 – двухосновная кислота, гидролиз K2СО3 протекает по двум ступеням.
Продуктами первой ступени гидролиза K2СО3 являются кислая соль KHCO3 и гидроксид калия KОН.
Вторая ступень (гидролиз кислой соли, которая образовалась в результате первой ступени):
Продуктами второй ступени гидролиза K2СО3 являются гидроксид калия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени.
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Ступенчато гидролизуются соли MgSО4, CoI2, Al2(SO4)3, ZnBr2 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза хлорида никеля (II) NiCl2.
Гидролиз соли NiCl2 протекает по катиону, так как соль образована слабым основанием Ni(OH)2 и сильной кислотой НСl. Катион Ni 2+ связывает гидроксид-ионы ОН — воды. Ni(OH)2 — двухкислотное основание, поэтому гидролиз протекает по двум ступеням.
Продуктами первой ступени гидролиза NiCl2 являются основная соль NiOHCl и сильная кислота HCl.
Вторая ступень (гидролиз основной соли, которая образовалась в результате первой ступени гидролиза):
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (II) и сильная хлороводородная кислота НCl. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Гидролизу подвергаются не только соли, но и другие неорганические соединения. Гидролизуются также жиры, углеводы, белки и другие вещества, свойства которых изучаются в курсе органической химии. Поэтому можно дать более общее определение процесса гидролиза:
Гидролиз — это реакция обменного разложения веществ водой.
Химия. 11 класс
§ 27.1. Гидролиз солей
Понятие о реакциях гидролиза
В водном растворе частицы растворённого вещества взаимодействуют с молекулами воды. Такое взаимодействие нередко приводит к реакции гидролиза (от др.-греч. hydro — вода + lysis — разложение).
Гидролиз — это химическая реакция взаимодействия вещества с водой, при которой происходит разложение молекул этого вещества и воды с образованием новых соединений.
Гидролиз соединений различных классов — солей, углеводов, галогеналканов, белков, сложных эфиров (в том числе жиров) и др. существенно различается. С гидролизом галогеналканов, белков (полипептидов), ди- и полисахаридов (на примере сахарозы, крахмала и целлюлозы), а также сложных эфиров вы познакомились в курсе органической химии. В этом разделе мы рассмотрим гидролиз неорганических веществ — солей.
Гидролиз солей — это обменное взаимодействие между молекулами воды и катионами или анионами соли, приводящее к образованию слабых электролитов.
Анионы слабых кислот, взаимодействуя с катионами водорода, могут образовывать слабо диссоциирующие молекулы кислоты. Катионы слабых оснований, взаимодействуя с гидроксид-ионами, могут образовывать малодиссоциирующие основания.
Отличие среды раствора соли от нейтральной — один из признаков гидролиза соли. Насколько велико это отличие, а также кислым или щелочным является раствор соли, зависит от силы основания и кислоты, из которых эта соль образуется по реакции нейтрализации.
§ 27.1. Гидролиз солей
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 27.1. Гидролиз солей |
| Напечатано:: | Гость |
| Дата: | Четверг, 2 Декабрь 2021, 14:37 |
Оглавление
Понятие о реакциях гидролиза
В водном растворе частицы растворённого вещества взаимодействуют с молекулами воды. Такое взаимодействие нередко приводит к реакции гидролиза (от др.-греч. hydro — вода + lysis — разложение).
Гидролиз — это химическая реакция взаимодействия вещества с водой, при которой происходит разложение молекул этого вещества и воды с образованием новых соединений.
Гидролиз соединений различных классов — солей, углеводов, галогеналканов, белков, сложных эфиров (в том числе жиров) и др. существенно различается. С гидролизом галогеналканов, белков (полипептидов), ди- и полисахаридов (на примере сахарозы, крахмала и целлюлозы), а также сложных эфиров вы познакомились в курсе органической химии. В этом разделе мы рассмотрим гидролиз неорганических веществ — солей.
Гидролиз солей — это обменное взаимодействие между молекулами воды и катионами или анионами соли, приводящее к образованию слабых электролитов.
Анионы слабых кислот, взаимодействуя с катионами водорода, могут образовывать слабо диссоциирующие молекулы кислоты. Катионы слабых оснований, взаимодействуя с гидроксид-ионами, могут образовывать малодиссоциирующие основания.
Отличие среды раствора соли от нейтральной — один из признаков гидролиза соли. Насколько велико это отличие, а также кислым или щелочным является раствор соли, зависит от силы основания и кислоты, из которых эта соль образуется по реакции нейтрализации.
Классификация солей по их подверженности реакции гидролиза
Любая соль может быть представлена как продукт реакции нейтрализации (от лат. neuter — ни тот, ни другой) при взаимодействии кислоты и основания. Кислоты и основания могут быть как сильными, так и слабыми электролитами.
Реакция нейтрализации — это реакция обмена между кислотой и основанием с образованием соли и воды:
В зависимости от силы основания и кислоты можно выделить четыре типа солей (рис. 60.1).
Рассмотрим гидролиз солей всех четырёх типов.
Соли, образованные сильным основанием и слабой кислотой. В качестве примера можно привести ацетат натрия CH3COONa. Эта соль образована сильным основанием NaОН и слабой кислотой CH3COOH:
В водном растворе ацетата натрия происходят два процесса:
а) полная диссоциация сильного электролита — соли CH3COONa на катион и анион:
б) взаимодействие ацетат-ионов с молекулами воды с образованием слабого электролита — уксусной кислоты:
Уравнение гидролиза ацетата натрия показывает, что:
Равновесие гидролиза в данном примере сильно смещено влево — в сторону образования исходных веществ, так как вода — значительно более слабый электролит, чем уксусная кислота СH3COOH.
Гидролиз является реакцией, обратной нейтрализации.
Примеры анионов слабых кислот, соли которых гидролизуются водой:
Рассмотрим гидролиз карбоната натрия Na2СO3 — соли сильного основания NaOH и слабой двухосновной кислоты H2CO3. Гидролиз протекает по аниону в соответствии с уравнением в полной ионной форме:
Уравнение в сокращённой ионной форме выглядит так:
В растворе Na2СO3 образуется избыток гидроксид-анионов и создаётся щелочная среда. Раствор Na2CO3 с концентрацией 0,1 моль/дм 3 имеет рН около 11,5.
Соли, образованные сильной кислотой и слабым основанием. Рассмотрим гидролиз хлорида аммония NH4Cl. Это соль сильной кислоты — HCl и слабого основания — гидрата аммиака NH3 · H2O.
В водном растворе соли происходят два процесса:
а) полная диссоциация сильного электролита — соли NH4Cl:
б) взаимодействие ионов аммония с молекулами воды с образованием слабого электролита — гидрата аммиака NH3 · H2O:
Это уравнение показывает, что:
Рассмотрим гидролиз нитрата меди(II) Сu(NO3)2. Это соль сильной кислоты — HNO3 и слабого основания — Cu(OH)2.
Уравнение гидролиза в сокращённой ионной форме:
Поэтому сульфид алюминия Al2S3 нельзя получить реакцией обмена между водными растворами двух солей, например, нитрата алюминия Al(NO3)3 и сульфида калия K2S.
Возможны и другие случаи необратимого гидролиза. Их нетрудно предсказать, ведь для необратимости процесса необходимо, чтобы хотя бы один из продуктов гидролиза уходил из сферы реакции. Приведём пример совместного необратимого гидролиза катионов Al 3+ и анионов :
Для солей, подвергающихся необратимому гидролизу, в таблице «Растворимость кислот, оснований и солей в воде» вы найдёте примечание: «не существуют в водном растворе».
Подведём итог тому, что вы узнали о гидролизе и по катиону, и по аниону:
Обобщим информацию о гидролизе различных катионов и анионов в составе средних солей по катионам и анионам в таблице 19.1.
Таблица 19.1. Гидролиз катионов и анионов
Не гидролизуются: растворимые галогениды (кроме фторидов), нитраты, перхлораты, сульфаты и перманганаты щелочных и щёлочноземельных металлов.
Отметим, что реакции обратимого гидролиза подчиняются принципу Ле Шателье, поэтому гидролиз соли можно как усилить, так и ослабить.
Гидролиз солей обусловлен протеканием реакций ионного обмена с участием молекул воды и ионов соли с образованием слабого электролита.
Гидролиз по аниону, как правило, обратим и протекает в небольшой степени. При разбавлении растворов солей равновесие гидролиза смещается вправо, реакция среды в растворах солей слабых кислот слабощелочная, изредка сильнощелочная.
Гидролиз по катиону, как правило, обратим и протекает в небольшой степени. При разбавлении растворов солей равновесие гидролиза смещается вправо, реакция среды в растворах солей слабых оснований слабокислая, изредка сильнокислая.
Гидролиз одновременно по катиону и аниону протекает в значительно большей степени, чем гидролиз этих ионов по отдельности. Положение равновесия реакции гидролиза по катиону и аниону не зависит от концентрации соли, а реакция среды раствора не сильно отклоняется от нейтральной.
Соли слабых кислот и оснований необратимо гидролизуются по катиону и аниону при удалении из раствора одного из продуктов реакции в виде газа.
Вопросы, задания, задачи
1. Соли каких типов подвержены гидролизу?
2. Какие из солей, формулы которых: K3PO4, Al2(SO4)3, MgSO4, NH4NO3, Pb(NO3)2, Na2CO3, подвергаются гидролизу по катиону? Составьте уравнения гидролиза этих солей, укажите реакцию среды.
3. Какие из солей, формулы которых: Na2S, AlCl3, K2SO3, Cr2(SO4)3, (CH3COO)2Ba, AgF, Mg(NO3)2, Na2SiO3, KMnO4, Na3PO4, подвергаются гидролизу по аниону? Составьте уравнения гидролиза этих солей, укажите реакцию среды и окраску лакмуса в растворе.
4. Реакция нейтрализации сильных кислот или оснований протекает с выделением теплоты. Используя принцип Ле Шателье, обоснуйте, почему при нагревании равновесие гидролиза смещается вправо.
5. Степень диссоциации воды возрастает в 7,5 раза при её нагревании от 25 °С до 100 °С и уменьшается в 3 раза при охлаждении воды от 25 °С до 0 °С. Дайте объяснение этим фактам с учётом того, что диссоциация воды — эндотермическая реакция. Куда смещается равновесие гидролиза при повышении и понижении температуры и как оно зависит от степени диссоциации воды?
6. Какие из приведённых солей подвергаются гидролизу и по катиону, и по аниону: NH4F, (CH3COO)3Al, (CH3COO)2Cu, (NH4)2CO3, KNO2, AgNO3, Na3PO4, CrCl3? Составьте уравнения гидролиза этих солей (все реакции обратимы) в полной ионной форме.
7. Добавление каких из указанных веществ к раствору сульфата железа(III) усилит гидролиз соли: НСl, NH3, HNO3, Н2O, K2CO3? Дайте объяснение.
8. Стеарат натрия C17H35COONа (твёрдое мыло) гидролизуется в воде по аниону. Составьте уравнение гидролиза в полной и сокращённой ионной формах и укажите, какую среду имеет раствор. Как влияют температура и разбавление раствора мыла на равновесие реакции гидролиза? Почему сода Na2CO3 препятствует гидролизу мыла?
10. При сливании растворов FeCl3 и Na2CO3 выпадает осадок бурого цвета и наблюдается выделение газа. Какое вещество выпадает в осадок и какой газ выделяется? Напишите уравнение протекающей реакции и рассчитайте объём (н. у.) выделившегося газа, если к раствору Na2CO3 объёмом 100 см 3 с массовой долей растворённого вещества 7,85 % и плотностью 1,080 г/см 3 прилили избыток раствора FeCl3.
1. Щелочную среду имеют растворы солей:
2. рН >7 имеют водные растворы:
3. Лакмус окрасит в красный цвет раствор:
4. Равновесие реакции гидролиза в растворе медного купороса
Cu 2+ + H2O Cu(OH) + + H +
можно сместить влево («подавить гидролиз»):
5. Не образуется соль при сливании растворов: