Ацеклофенак и диклофенак в чем разница таблетки
Разумный выбор НПВП при сочетанной патологии: заболеваниях суставов и гипертонической болезни
Нестероидные противовоспалительные препараты (НПВП) являются одной из основных групп лекарственных средств, применяемых при лечении ревматоидного артрита (РА). Противовоспалительный и анальгетический эффект данной группы препаратов связан с подавлением а
Нестероидные противовоспалительные препараты (НПВП) являются одной из основных групп лекарственных средств, применяемых при лечении ревматоидного артрита (РА). Противовоспалительный и анальгетический эффект данной группы препаратов связан с подавлением активности циклооксигеназы-2 (ЦОГ-2) в очаге воспаления — ключевого фермента синтеза простагландинов провоспалительной активности, а подавление изоформы ЦОГ-1 приводит к нарушению физиологических реакций: в частности, к нарушению синтеза простагландинов класса Е в слизистой оболочке желудка и развитию НПВП-гастропатии.
Большинство «стандартных» НПВП способно подавлять активность обеих изоформ ЦОГ, поэтому их применение часто ограничено из-за развития побочных эффектов, в первую очередь — со стороны желудочно-кишечного тракта (ЖКТ). Субъективные симптомы со стороны ЖКТ встречаются примерно у трети больных, а в 5% случаев представляют серьезную угрозу жизни пациентов. Именно поэтому в последние годы особо пристальное внимание привлекает проблема безопасного применения НПВП. Полагают, что препараты более селективные в отношении ЦОГ-2 реже вызывают развитие НПВП-гастропатии. Изучение механизмов действия НПВП послужило толчком к созданию новых препаратов, обладающих всеми положительными свойствами стандартных НПВП, но менее токсичных, — это специфические ингибиторы ЦОГ-2 [3, 4, 13].
В последние годы особую актуальность приобрела проблема взаимодействия НПВП и гипотензивных препаратов, а также связи между применением НПВП и развитием гипертонической болезни (ГБ). Неселективные НПВП могут привести к повышению АД (преимущественно диастолического) не только у больных артериальной гипертензией (АГ), но и у лиц с нормальным АД за счет ингибиции системного и локального, внутрипочечного синтеза простагландинов. Известно, что постоянный прием НПВП вызывает у пациентов увеличение АД в среднем на 5,0 мм рт. ст. Характерным свойством НПВП является также взаимодействие с гипотензивными препаратами, в основе гипотензивного действия которых лежат преимущественно простагландин-зависимые механизмы. Назначение НПВП пациентам, получающим по поводу АГ β-адреноблокаторы, ингибиторы АПФ и диуретики, приводит к снижению гипотензивного эффекта [8, 9].
Нимесулид был разработан еще в 1985 г. и является одним из первых НПВП, при изучении которого продемонстрирована более высокая селективность в отношении ЦОГ-2 и накоплен большой клинический опыт. В многочисленных исследованиях in vitro и in vivo было показано, что нимесулид примерно в 5–20 раз более селективно ингибирует ЦОГ-2, чем ЦОГ-1. Большой интерес представляет и тот факт, что нимесулид обладает широким спектром ЦОГ-независимых эффектов, которые могут определять его противовоспалительную, анальгетическую и хондропротективную активность [1, 2, 5, 7, 11, 12].
Нимесулид хорошо переносится больными и редко вызывает развитие серьезных побочных эффектов, требующих отмены препарата. По результатам ряда исследований, частота побочных эффектов, развивающихся на фоне приема нимесулида, достоверно не отличается от плацебо или ниже, чем при приеме других НПВП. Например, по данным мета-анализа, у больных, получавших нимесулид, общая частота побочных реакций со стороны ЖКТ была значительно ниже (8,7%), чем при назначении других НПВП (16,8%). Низкую частоту поражения ЖКТ на фоне лечения нимесулидом связывают не только с ЦОГ-2-селективностью препарата, но и с антигистаминным действием, приводящим к снижению секреции соляной кислоты в желудке [6, 10, 13].
Таким образом, нимесулид относится к селективным ингибиторам ЦОГ-2, сравним по эффективности с «классическими» НПВП, но отличается более благоприятным профилем токсичности. Фармакоэкономический анализ свидетельствует о преимуществах нимесулида по сравнению с диклофенаком, в первую очередь в связи с более низкой частотой поражения ЖКТ.
Целью нашего исследования явилось изучение эффективности и переносимости найза (нимесулида) у больных РА в сравнении с ортофеном (диклофенаком).
Материалы и методы
Оба НПВП назначались случайным способом 40 больным с момента первого установления диагноза РА, согласно критериям Американской коллегии ревматологов. Найз применялся в виде таблеток по 100 мг дважды в день, ортофен — в виде таблеток по 25 мг в суточной дозе 150 мг. Одновременно всем больным проводилась базисная терапия, преимущественно метотрексатом или сульфасалазином. Эффективность и переносимость НПВП оценивались через 3 нед. от начала лечения, т. е. в те сроки, когда эффект базисных препаратов еще не имел клинической значимости.
В I группе из 20 пациентов, получавших найз, было 14 женщин и 6 мужчин, средний возраст пациентов составил 55,1 года, длительность суставного синдрома к моменту установления диагноза — от 3 до 14 мес., в среднем — 7,25 мес. Во II группе из 20 больных, получавших ортофен, было 18 женщин и 2 мужчин, средний возраст больных — 42,75 года, длительность суставного синдрома — от 2 до 14 мес., в среднем — 5,65 мес. Клиническая характеристика обеих групп представлена в таблице 1.
Результаты лечения оценивались по динамике показателей суставного синдрома (суставной индекс Ричи (СИ), счет болезненных суставов (СБС), счет припухших суставов (СПС), продолжительность утренней скованности (мин), выраженность боли по визуально-аналоговой шкале (ВАШ)) и на основании общей оценки эффективности лечения, по мнению врача и больного. Кроме того, у всех больных оценивалась динамика АД на фоне лечения НПВП.
Результаты
В I группе на фоне лечения найзом в суточной дозе 200 мг за 3 нед. лечения достигнута достоверная динамика показателей суставного синдрома. При этом эффективность терапии оценена 17 пациентами (85%) как хорошая и 3 (15%) — как удовлетворительная. По мнению врача, в 16 случаях (80%) наблюдалась хорошая эффективность препарата, в 4 случаях (20%) — удовлетворительная (рис. 1). Переносимость найза у 85% была хорошей, только у 2 больных (10%) отмечались изжога и гастралгии, у 1 больного (5%) — чувство тяжести в эпигастральной области. Однако при фиброгастроскопии у этих пациентов не выявлено эрозивного повреждения слизистой оболочки желудка. В группе больных, принимавших найз, не потребовалось отмены препарата ни у одного больного.
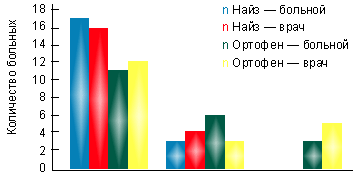 |
| Рисунок. Оценка эффективности препаратов на основании мнения больного и врача |
Во II группе на фоне терапии ортофеном в суточной дозе 150 мг через 3 нед. также отмечена существенная динамика показателей суставного синдрома. Однако оценка эффективности терапии показала, что только 11 пациентов (55%) оценили эффективность препарата как хорошую, 6 (30%) — как удовлетворительную и трое больных (15%) признали ее неудовлетворительной. По мнению лечащего врача, достаточная эффективность ортофена, соответствующая градации «хорошая», отмечалась в 12 случаях (60%), удовлетворительная — в 3 (15%) и неудовлетворительная — в 5 (25%) случаях (рис.).
Переносимость препарата ортофен была хуже, чем у найза: у 9 пациентов (45%) отмечались симптоматические побочные эффекты, причем у 3 больных (15%) потребовалась отмена препарата через 2 нед. от начала лечения в связи с выявленным при ФГДС эрозивным поражением слизистой оболочки антрального отдела желудка. В целом из побочных эффектов чаще отмечались изжога — у 7 (35%) пациентов, гастралгии — у 8 (40%), тошнота — у 4 (20%) и диарея — у 2 (10%) больных.
Особый интерес представляет влияние исследуемых НПВП на уровень АД, так как из 40 больных у 15 имелась сопутствующая ГБ, по поводу которой проводилась гипотензивная терапия. Динамика уровня АД в обеих группах на фоне лечения найзом и ортофеном представлена в таблице 2. Следует отметить, что терапия найзом не требовала усиления проводимой гипотензивной терапии (β-блокаторами, ингибиторами АПФ, диуретиками) и не вызывала повышения АД у ранее нормотензивных пациентов. В то же время лечение ортофеном потребовало коррекции доз гипотензивных препаратов у 4 (66,7%) из 6 больных ГБ и вызвало повышение АД у 5 (25%) женщин в постменопаузе с исходно высоконормальным АД. Данный эффект неселективного НПВП — ортофена — следует считать предсказуемым, особенно с учетом характера проводимой гипотензивной терапии. Все больные ГБ получали в разных комбинациях β-адреноблокаторы, ингибиторы АПФ и диуретики; при этом ни одному пациенту не был назначен дигидропиридиновый антагонист Са — амлодипин, который является препаратом выбора для лечения АГ в условиях терапии НПВП.
Таким образом, результаты открытого клинического исследования показали, что препарат найз у больных РА проявляет выраженную противовоспалительную активность, превосходящую диклофенак. При этом найз характеризуется хорошей переносимостью, малым числом симптоматических побочных эффектов и превосходит с этой точки зрения наиболее широко применяемый в клинической практике ортофен. Дополнительным преимуществом препарата найз можно считать менее выраженное влияние на уровень АД. При назначении найза не требовалось увеличения дозы гипотензивных препаратов. С учетом высокой распространенности эссенциальной гипертензии в популяции, взаимодействие НПВП с наиболее часто используемыми гипотензивными средствами представляется актуальной проблемой. Ревматические заболевания, требующие постоянной терапии НПВП, часто сочетаются с АГ. При этом у большинства больных ГБ коррекция АД может достигаться только благодаря комбинированной антигипертензивной терапии, а монотерапия дигидропиридиновыми антагонистами Са признается недостаточно эффективной. Следовательно, в большинстве случаев при лечении воспалительных ревматических заболеваний у лиц, страдающих ГБ, невозможно полностью нивелировать отрицательное взаимодействие «стандартных» НПВП с основными кардиологическими препаратами — β-адреноблокаторами, ингибиторами АПФ и диуретиками. В такой ситуации представляется рациональным выбор для проведения противовоспалительной терапии специфических ингибиторов ЦОГ-2, представителем которых является найз.
Литература
И. М. Марусенко, кандидат медицинских наук
Н. Н. Везикова, кандидат медицинских наук, доцент
В. К. Игнатьев, доктор медицинских наук, профессор
Петрозаводский университет, кафедра госпитальной терапии
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Институт ревматологии РАМН, Москва
А цеклофенак (дериват фенилуксусной кислоты) – новый препарат из группы нестероидных противовоспалительных (НПВП), недавно зарегистрированный в России под названием «Аэртал» (фирма Никомед). Небезынтересно, что в одном из первых обзоров по ацеклофенаку Huskisson озаглавил передовую статью «Ацеклофенак: очко или еще одно попадание в цель?» [1], в которой он выделяет ряд особенностей: 4–часовой период полураспада и поэтому отсутствие угрозы аккумуляции; удобный двукратный прием (по 100 мг утром и вечером); фармакокинетика не меняется с возрастом, что очень важно для пожилых больных, биодоступность не снижается при приеме с пищей, не отмечено взаимодействия с другими лекарствами, в частности, с диуретиками и антикоагулянтами. Во–вторых, при клинических испытаниях ацеклофенак по эффективности был сравним с диклофенаком, пироксикамом и напроксеном при ревматоидном артрите (РА), остеоартрозе (ОА) и анкилозирующем спондилоартрите (АС). При этом отмечен быстрый анальгетический эффект, на что обращается особое внимание. Не менее важна лучшая ЖКТ переносимость, чем у сравниваемых НПВП, и менее выраженное повреждающее действие на хрящ при ОА. Не удивительно, что Huskisson оценивает ацеклофенак, как «имеющий смысл шаг в развитии процесса» (т.е. синтеза новых НПВП).
За прошедшие годы произошло дальнейшее накопление клинического материала, который не только подтвердил полученные ранее данные по механизмам действия, эффективности и безопасности ацеклофенака, но показал новые важные фактические данные.
Особенно интересны исследования, касающиеся влияния на процессы деградации матрикса хряща за счет ингибиции активности IL–1 b и стимулирующего эффекта на синтез глюкозаминогликанов (ГАГ) в остеоартротическом хряще [5]. Ацеклофенак также показал стимулирующее влияние на синтез антагониста рецепторов IL–1 b в человеческих хондроцитах, а его метаболит 4–гидрокси–ацеклофенак подавлял продукцию металлопротеиназ [6].
Ацеклофенак быстро всасывается (пиковая концентрация достигается уже через 1–3 часа после приема), поэтому активно связывается с белками плазмы (>99%). Максимальная концентрация в плазме после однократной дозы и недельного приема схожи, при этом не отмечено статистически достоверного различия в плазменной концентрации у молодых и пожилых людей [7]. В синовиальной жидкости концентрация ацеклофенака составляет 50% плазменной. Ацеклофенак превращался в несколько метаболитов, из которых наиболее значимый 4–гидрокси–ацеклофенак, и элиминируется преимущественно (до 66%) с мочой [8].
Исследование фармакокинетики ацеклофенака после однократной дозы (100 мг) и повторных приемов (по 200 мг в течение 7 дней) сравнивали в двух возрастных группах: 18–31 год и 60–80 лет. Прежде всего, не отмечено больших различий в фармакокинетике после однократной дозы и при повторных приемах, в разных возрастных группах, но она чуть короче у пожилых людей (7). Также не отмечено изменений в клиренсе креатинина или мочевой N–ацетил–глюкозаминидазы по возрастным группам. Некоторое замедление фармакокинетики ацеклофенака у больных циррозом печени обосновало рекомендацию назначать таким больным половину нормальной дозы ацеклофенака и проводить тщательный мониторинг. Фармакокинетика ацеклофенака также была исследована у больных с умеренной почечной недо статочностью. И хотя больших изменений не было обнаружено, но поскольку ацеклофенак экскретируется преимущественно почками, при скомпроментированной клинической картине необходим тщательный контроль за динамикой функциональных нарушений со стороны почек.
Поскольку ацеклофенак достаточно быстро и в значительной мере связывается с белками плазмы, было изучено его взаимодействие с другими лечебными препаратами. При сочетанном назначении ацеклофенака и диуретиков не отмечено изменений в артериальном давлении и осмолярности мочи. Также не отмечено каких–либо клинических эффектов при совместном приеме ацеклофенака с антидиабетическими препаратами, однако имеется редкое описание гипо– и гипергликемии, что требует индивидуального подбора дозировок гипогликемических препаратов. Совместный прием ацеклофенака и варфарина приводил к некоторому повышению плазменной концентрации последнего, но не отмечено существенного влияния на свертываемость крови. Также не выявлено каких–либо изменений при совместном приеме с метотрексатом у больных РА.
Эффективность ацеклофенака при ОА коленных суставов сравнивалась в двойных слепых рандомизированных исследованиях с пироксикамом [9], с диклофенаком [10] и напроксеном [11]. Длительность лечения колебалась от 2–х до 3–х месяцев. Показано сопоставимое снижение болей в суставах (в покое и при движении), уменьшение припухлости суставов и улучшение функциональной активности. Отмена из–за недостаточной эффективности отмечена у 4,2% [11] и 4,5% леченных больных [10].
Несколько двойных слепых рандомизированных исследований в конце 96–х годов было проведено при ревматоидном артрите (РА). При этом ацеклофенак в дозе 200 мг в день сравнивали с диклофенаком в дозе 150 мг в день [12], индометацином 100 мг в день [13] и кетопрофеном 150 мг в день [14]. Все больные продолжали прием болезнь–модифицирующих средств и стабильную дозу глюкокортикостероидов (ГК). Исследование продолжалось в течение 3–6 месяцев и показало, что уменьшение болей и воспаления у принимающих ацеклофенак достоверно не отличалось от тех больных, которые принимали сравниваемые НПВП. В целом глобальная оценка эффективности, основанная на данных исследователей, и со стороны больных, леченных ацеклофенаком не отличалась от принимавших сравниваемые НПВП, достигая 62,1–76,3% (по группам). При этом не отмечено разницы в начале действия лекарств, положительной динамики симптомов, индекса Ричи и др. В то же время среди леченных ацеклофенаком от 4,6% до 8% больных прекратили его прием из–за недостаточной эффективности, что близко к данным по контрольным группам – от 5,5% до 13%.
В перечисленных исследованиях серьезное внимание уделялось безопасности применения ацеклофенака. В первую очередь изучались побочные эффекты со стороны ЖКТ, среди которых учитывались все симптомы, которые могли быть связаны с этой патологией, и объективные признаки. Среди первых – тошнота, диарея, метеоризм, запоры, язвенный стоматит, по которым не было отмечено существенных различий между ацеклофенаком и сравниваемыми НПВП, о чем говорилось выше. Частота этих побочных эффектов у принимавших ацеклофенак колебалась от 8% до 28%, в контрольных группах от 15% до 36% [10,11,13]. Тем не менее в подавляющем числе наблюдений не было оснований для отмены препаратов. Лишь в двух клинических испытаниях ацеклофенака и кетопрофена было прекращено лечение, соответственно у 1,1% против 11% [14].
Кишечные кровотечения при лечении ацеклофенаком наблюдались у 1,2–9% и от 0 до 8,8% в группах больных, принимавших диклофенак, пироксикам или индометацин.
Но особое внимание необходимо привлечь к исследованиям SAMM (Safety Assessment of Marketed Medicines), охватившим 10142 больных, страдавших РА, ОА, АС [16].
В SAMM–исследование не включались больные с обострением язвенной болезни, поражением почек при уровне креатинина >360 мкмоль/л, беременные, страдающие бронхиальной астмой, крапивницей, гиперчувствительностью к НПВП или ацетилсалициловой кислоте. Предшествующая терапия (за исключением ибупрофена) отменялась за 30 дней до начала настоящего опыта. Ацеклофенак назначался по 100 мг дважды в день, а диклофенак по 75 мг также дважды, период лечения продолжался 12 месяцев. Плановые визиты к врачу осуществлялись на 1, 6 и 12–м месяцах исследования.
В SAMM–исследовании принимали участие 1078 врачей, включившие 10142 больных, из которых 7890 принимали ацеклофенак, а 2252 – диклофенак (соотношение 3,5:1) в возрасте > 50 лет, страдавших преимущественно ОА (91,4%).
1. Huskisson E.C. Editorial. Aceclofenac: Ace or just another Jack? Europ.J.Rheum.Inform. 1996, 16,1,1–2.
2. Lidburg P.S., Vojnovic J., Warner T.D. COX 2/COX–1 selectivity of aceclofenac in comparison with celecoxib and rofecoxib in the human whole blood assay/ Fifth world Congress of the OARS. Barcelona, Spain,4–6 October,2000,v.8, Supplement B. TH053.
3. Martel–Pelletier J. Cloutier J–M, Pelletier J–K. Effects of aceclofenac and diclofenac on synovial inflammatory factors in human osteoarthritis. Clin.Drug Invest., 1997,14,226–232.
4. Gonzales E., de la Cruz C, et al. Long–term effect of nonsteroidal anti–inflammatory drugs on the production of cytokines and other inflammatory mediators by blood cells of patients with osteoarthritis. Agents Action 1994,41,171–178.
Как защитить желудок от НПВП — советы эксперта
Что вы делаете, когда болит голова, поднялась высокая температура или беспокоит боль в суставах? 90% опрошенных ответят: «Пью таблетку».
«Волшебные» пилюли
Существует группа препаратов, под общим названием нестероидные противовоспалительные (НПВП), которые мы все хотя бы раз в жизни, а многие регулярно, принимали. Это препараты, обладающие обезболивающим противовоспалительным и / или жаропонижающим действием. В качестве примера можно назвать Аспирин, Нурофен, Найс, Кетанов, Кетопрофен и прочие. Учитывая «волшебные эффекты» от их действия — снятие воспаления, боли и жара, — их назначают практически все, всем и всегда. Назначают травматологи, ревматологи, терапевты, лоры, стоматологи. Плюс, их можно совершенно свободно приобрести в любой аптеке. Но, наряду с «волшебными свойствами» эти лекарства обладают рядом побочных действий, которые можно разделить на 2 группы: кардиориски и гастро риски. Собственно о гастрорисках и пойдёт речь в данной статье.
НПВП-гастропатия
В научной литературе эта проблема называется «НПВП-гастропатия». Впервые термин был предложен в 1986 году для разграничения специфического поражения слизистой оболочки желудка, возникающего при длительном употреблении НПВП, от классической язвенной болезни.
Отличие НПВП-гастропатии от язвенной болезни можно проследить и по зоне поражения. Чаще всего язвы можно увидеть в желудке, а не в кишке. Плюс, изменения встречаются чаще у пожилых, а не у молодых людей.
Немного цифр
Немного статистики. В Великобритании назначается около 24 млн. НПВС в год. 70% лиц старше 70 лет принимают НПВС 1 раз в неделю, а 34% ежедневно. В США продается НПВС на сумму до 6 млрд. в год. Как следствие, риск развития желудочно-кишечных кровотечений (ЖКК) возрастает прободения — в 6 раз, риск смерти от осложнений до 8 раз. До всех случаев острых ЖКК связаны с НПВС.
Проблема эта актуальна и в нашей стране, к примеру по данным Научного Центра сердечно-сосудистой хирургии им. А.Н. Бакулева из 240 больных, ежедневно принимающих аспирин даже в малых дозах, на гастроскопии поражения желудка и 12 п.к выявлены у 30% (из них язвы — у 23,6%, эрозии — у 76,4%). Аналогичная картина у коллег из ВНИИ ревматологии РАМН — у 2126 пациентов, принимающих НПВС без «прикрытия» (защиты) желудка, эрозии и язвы гастродуоденальной зоны найдены в 33,8% случаев. Это очень впечатляющие и драматические цифры осложнений от приема НПВС, учитывая количество употребляющих эти препараты людей в развитых странах.
Как это работает?
Как же действуют эти препараты в наших желудках? Всё очень просто, негативное воздействие реализуется за счёт дисбаланса защитных и агрессивных сил. У нас в желудке существует ряд защитных механизмов, позволяющих противостоять натиску агрессоров. Среди последних:
Защищается желудок за счет мощного слоя слизи и бикарбонатов, которые нейтрализуют кислоту, адекватного кровоснабжения, способности очень быстро регенерировать. Когда мы используем НПВС препараты, баланс сил изменяется в сторону агрессивных механизмов и происходит поражение слизистого и подслизистого слоя желудка и кишки.
Диагностика
Для диагностики подобных изменений используется гастроскопия, являющаяся «золотым стандартом». Интересный факт, дело в том, что порядка 40% больных с эрозивно-язвенными изменениями, принимающих эти препараты длительно (более 6 недель) не ощущают никакого дискомфорта или неприятных, болезненных ощущений. Проблемы с желудком диагностируются лишь при походе к другим врачам, а не к гастроэнтерологу. И, наоборот, у 40% пациентов, на фоне жалоб, которые они предъявляют, ничего не находят.
Что же делать в таком случае?!
Алгоритм действий для пациентов, не имеющих проблем с желудком, и тех, у кого в анамнезе была язвенная болезнь или эрозивные изменения, различен. Для первой группы, при назначении нестероидных противовоспалительных препаратов более, чем на 5 дней, обязательно назначение препаратов из группы ингибиторов протонной помпы (ИПП). Таких как, омепразол, пантопразол, рабепразол и т. д. (на весь курс приема). Для второй группы, любые назначения из группы НПВС, независимо от срока приёма, требуют параллельного назначения ингибиторов протонной помпы. Так же обязателен прием ИПП пациентам, принимающих длительно аспирин.
Мифы, с которыми мы сталкиваемся в ежедневной практике
Миф 1. Использование НПВС препаратов в виде свечей является менее агрессивным для желудка, нежели приём таблеток
Это 100% миф. Патогенное, разрушительное действие лекарства реализуется через кровь, доставляющую его по сосудам в желудок.
Миф 2. В качестве «гастропротекторов» можно использовать лекарства из группы антацидов — Ренни, Маалокс, Фосфалюгель и H2-блокаторы (Ранитидин и Фамотидин)
В данном случае они не эффективны.
Миф 3. Принимать ингибиторы протонной помпы можно нерегулярно
Дело в том, что если пожилому человеку назначили на всю жизнь противовоспалительный препарат, абсолютно бессмысленно назначать гастропротекцию на месяц. В подобных случаях лекарства должны приниматься строго параллельно.
Миф 4. В качестве «гастропротекторов» могут выступать пищевые продукты (кисели и пр.)
Этот миф, как абсолютно фантастический, мы оставим без комментариев.
Как выбрать лекарство
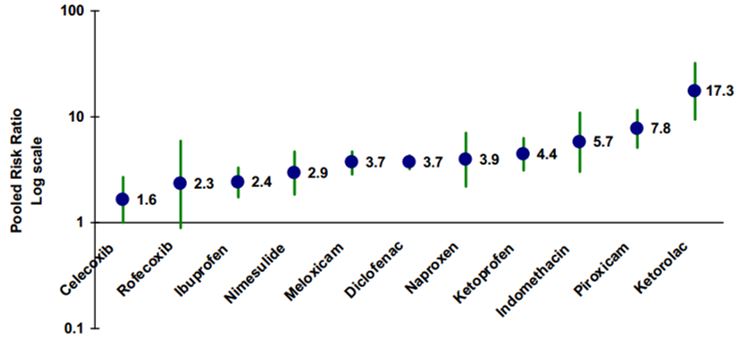
На самом деле, самым важным моментом является то, какие именно лекарства мы принимаем. На рисунке можно увидеть шкалу агрессивности различных препаратов из группы НПВС по отношению к желудку.
Самыми агрессивными препаратами являются Аспирин, Кеторолак, Пироксикам, Индометацин. По возможности рекомендуется использовать селективные препараты, которые обладают минимальными гастро-рисками. Их применение всегда более желательно, к ним относится Целекоксиб и Рофекоксиб. Но несмотря на их относительную безопасность, назначать их должен строго по показаниям лечащий доктор, не забывайте об этом.
Про Helicobacter pylori
Еще одним очень важным компонентом профилактики осложнений, является диагностика инфекции Helicobacter pylori у пациента планирующего длительно принимать НПВС (особенно аcпирин). Наличие бактерии увеличивает риски эрозивно-язвенных поражений ЖКТ и кровотечения в При её выявлении должна в обязательном порядке проводится эрадикация (уничтожение этой бактерии).
Резюме
Итак делаем выводы: