Атомная орбиталь это что
Атомные орбитали, из чего они состоят, как они символизируются и типы
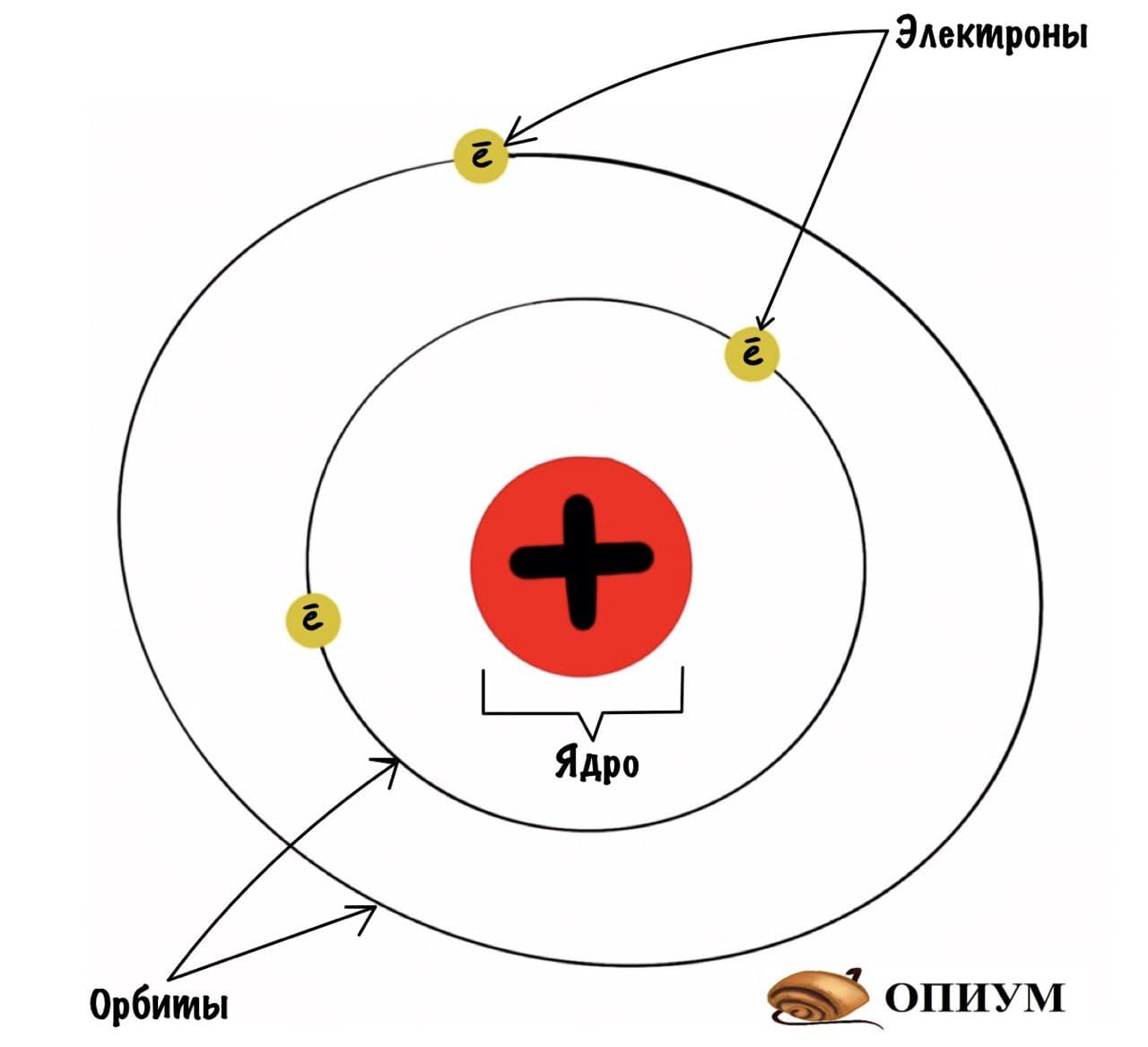
Эта физическая концепция, применяемая химиками для понимания связи и периодической таблицы, рассматривает электрон как волну и частицу одновременно. Поэтому изображение солнечной системы отбрасывается, где электроны представляют собой планеты, вращающиеся на орбитах вокруг ядра или Солнца..
Эта устаревшая визуализация полезна при иллюстрации энергетических уровней атома. Например: круг, окруженный концентрическими кольцами, представляющими орбиты, и их статические электроны. На самом деле, это образ, с помощью которого атом вводится детям и молодежи..
Однако истинная атомная структура слишком сложна, чтобы даже приблизительное изображение.
Рассматривая тогда электрон как волну-частицу и решая дифференциальное уравнение Шредингера для атома водорода (простейшая из всех систем), были получены знаменитые квантовые числа.
Эти числа показывают, что электроны не могут занимать какое-либо место атома, а только те, которые подчиняются уровню дискретной и квантованной энергии. Математическое выражение вышесказанного известно как волновая функция.
Таким образом, из атома водорода была оценена серия энергетических состояний, управляемых квантовыми числами. Эти энергетические состояния были названы атомными орбиталями.
Но они только описали местонахождение электрона в атоме водорода. Для других атомов, полиэлектроники, начиная с гелия, делалось орбитальное приближение. Почему? Поскольку разрешение уравнения Шредингера для атомов с двумя или более электронами очень сложно (даже с современной технологией).
Каковы атомные орбитали?
Хотя на первый взгляд это может показаться сложным, обратите внимание, что квантовые числа N, L и мл Они обозначены маленькими буквами. Это означает, что эти три числа описывают орбиталь. Rп(г), более известный как радиальная функция, зависит от N и L; пока YLML(θφ), угловая функция, зависит от L и мл.
В математическом уравнении также есть переменные r, расстояние до ядра, а также θ и φ. Результатом всей этой системы уравнений является физическое представление орбиталей. Что? Тот, который показан на изображении выше. Есть ряд орбиталей, которые будут объяснены в следующих разделах.
Его формы и конструкции (а не цвета) происходят из-за построения в пространстве волновых функций и их радиальной и угловой составляющих..
Радиальная волновая функция
Как видно из уравнения, Rп(г) это так сильно зависит от N по состоянию на L. Затем радиальная волновая функция описывается основным энергетическим уровнем и его подуровнями..
Если бы можно было сфотографировать электрон без учета его направления, можно было бы наблюдать бесконечно малую точку. Затем, сделав миллионы фотографий, вы можете подробно описать, как меняется облако точек в зависимости от расстояния до ядра..
Таким образом, плотность облака можно сравнить по расстояниям и близости к ядру. Если бы та же самая операция была повторена, но с другим энергетическим уровнем или подуровнем, образовалось бы другое облако, которое окружит предыдущее. Между ними есть небольшое пространство, где электрон никогда не находится; это то, что известно как радиальный узел.
Также в облаках есть области с более высокой и низкой электронной плотностью. Поскольку они становятся больше и удаляются от ядра, у них появляется больше радиальных узлов; а также расстояние р где электрон вращается чаще и с большей вероятностью его найдет.
Угловая волновая функция
Опять же, из уравнения известно, что YLML(θφ) в основном описывается квантовыми числами L и мл. На этот раз он участвует в магнитном квантовом числе, поэтому направление электрона в пространстве определено; и этот адрес может быть построен из математических уравнений, которые включают переменные θ и φ.
Теперь мы не приступаем к съемке, а к записи видео пути электрона в атоме. В отличие от предыдущего эксперимента, неизвестно, где именно электрон, но куда он идет.
При движении электрон описывает более определенное облако; на самом деле, сферическая форма или форма с лепестками, подобная тем, которые видны на изображении. Тип фигур и их направление в пространстве описываются L и мл.
Есть области, близкие к ядру, где электрон не проходит и фигура исчезает. Такие регионы известны как угловые узлы.
Например, если наблюдается первая сферическая орбиталь, быстро делается вывод, что она симметрична во всех направлениях; Однако это не относится к другим орбиталям, формы которых показывают пустые пространства. Их можно наблюдать в начале декартовой плоскости и в мнимых плоскостях между долями.
Вероятность нахождения электронной и химической связи
Чтобы определить истинную вероятность нахождения электрона на орбите, необходимо рассмотреть две функции: радиальную и угловую. Поэтому недостаточно предположить угловую составляющую, то есть проиллюстрированную форму орбиталей, а также то, как изменяется ее электронная плотность по отношению к расстоянию до ядра..
Тем не менее, потому что адреса (мл) отличать одну орбиту от другой, целесообразно (хотя, возможно, и не совсем правильно) рассматривать только ее форму. Таким образом, описание химической связи объясняется перекрытием этих фигур.
Например, сравнительное изображение трех орбиталей показано выше: 1 с, 2 с и 3 с. Обратите внимание на его радиальные узлы внутри. У орбиты 1 с нет узла, а у двух других есть один и два узла.
При рассмотрении химической связи легче иметь в виду только сферическую форму этих орбиталей. Таким образом, орбита ns приближается к другому, и на расстоянии р, электрон сформирует связь с электроном соседнего атома. Отсюда возникает несколько теоретических (TEV и TOM), которые объясняют эту ссылку.
Как они символизируются?
Явные атомные орбитали явно обозначаются как: пмл.
Квантовые числа принимают целые значения 0, 1, 2 и т. Д., Но для символизации орбиталей оставляют только N числовое значение В то время как для L, целое число заменяется соответствующей буквой (s, p, d, f); и для мл, переменная или математическая формула (за исключением мл= 0).
Например, для орбиты 1 с: N= 1, с = 0 и мл= 0 То же самое относится ко всем ns-орбиталям (2s, 3s, 4s и т. Д.).
Чтобы символизировать остальные орбитали, необходимо обратиться к их типам, каждый из которых имеет уровни энергии и свои собственные характеристики..
тип
S орбитали
Квантовые числа L= 0 и мл= 0 (в дополнение к его радиальной и угловой составляющим) описывают орбиталь сферической формы. Это тот, который возглавляет пирамиду орбиталей исходного изображения. Кроме того, как видно на изображении радиальных узлов, можно ожидать, что орбитали 4, 5 и 6 имеют три, четыре и пять узлов..
Они характеризуются симметричностью, и их электроны испытывают больший эффективный заряд ядра. Это потому, что их электроны могут проникать во внутренние слои и зависать очень близко к ядру, что оказывает на них положительное притяжение.
Орбитали р
Обратите внимание, что каждая гантель расположена вдоль декартовой оси. х, и и Z. Следовательно, эта орбита p, расположенная на оси x, обозначается как pх; один на оси у, ри; и если он указывает перпендикулярно плоскости ху, то есть на оси z, то это рZ.
Все орбитали перпендикулярны друг другу, то есть они образуют угол 90º. Кроме того, угловая функция исчезает в ядре (начало декартовой оси), и существует только вероятность обнаружения электрона внутри лепестков (чья плотность электронов зависит от радиальной функции)..
Плохой экранирующий эффект
Электроны этих орбиталей не могут проникать во внутренние слои с той же легкостью, что и s-орбитали. Сравнивая их формы, p-орбитали кажутся ближе к ядру; однако ns электроны чаще всего встречаются вокруг ядра.
Каковы последствия вышесказанного? Что NP-электрон испытывает меньший эффективный заряд ядра. И, кроме того, последнее дополнительно уменьшается за счет эффекта экранирования орбиталей. Это объясняет, например, почему атом с гибридной орбитальной sp 3 она менее электроотрицательна, чем у sp-орбиталей 2 или зр.
Также важно отметить, что каждая гантель имеет угловую узловую плоскость, но не имеет радиального узла (2p орбитали больше ничего). То есть, если бы он был разрезан, внутри него не было бы слоев, подобных орбите 2s; но начиная с 3p орбиты, радиальные узлы начали бы наблюдаться.
Эти угловые узлы ответственны за то, что внешние электроны испытывают плохой экранирующий эффект. Например, электроны 2s экранируют электроны 2p-орбиталей в большей степени, чем электроны 2p по сравнению с электронами 3p.
Px, Py и Pz
г орбитали
Их формы делают их еще менее эффективными в защите эффективной ядерной нагрузки. Почему? Потому что у них больше узлов, с помощью которых ядро может притягивать внешние электроны.
Следовательно, все d-орбитали способствуют увеличению атомных радиусов, которые менее выражены от одного уровня энергии к другому..
F-орбиталей
Каждая из угловых функций представляет собой лепестки сложной формы и несколько узловых плоскостей. Поэтому они еще меньше экранируют внешние электроны, и это явление объясняет то, что известно как сокращение лантаноида.
По этой причине для тяжелых атомов нет выраженного изменения их атомных радиусов уровня N другому n + 1 (От 6n до 7n, например). На сегодняшний день 5f орбитали являются последними найденными в естественных или искусственных атомах.
Имея все это в виду, пропасть открывается между тем, что известно как орбита и орбитали. Хотя дословно они похожи, на самом деле они очень разные.
Концепция атомной орбитали и орбитальный подход позволили объяснить химическую связь и то, как это может, так или иначе, повлиять на молекулярную структуру.
Атомная орбиталь
Волновая функция рассчитывается по волновому уравнению Шрёдингера в рамках одноэлектронного приближения (метод Хартри — Фока) как волновая функция электрона, находящегося в самосогласованном поле, создаваемым ядром атома со всеми остальными электронами атома.
Сам Э.Шрёдингер рассматривал электрон в атоме как отрицательно заряженное облако, плотность которого пропорциональна квадрату значения волновой функции в соответствующей точке атома. В таком виде понятие электронного облака было воспринято и в теоретической химии.
Однако большинство физиков не разделяли убеждений Э.Шрёдингера — доказательства существования электрона как «отрицательно заряженного облака» не было. Макс Борн обосновал вероятностную трактовку квадрата волновой функции. В 1950 г. Э.Шрёдингер в статье «Что такое элементарная частица?» вынужден согласиться с доводами М.Борна, которому в 1954 году присуждена Нобелевская премия по физике с формулировкой «За фундаментальное исследование в области квантовой механики, особенно за статистическую интерпретацию волновой функции».
Название «орбиталь» (а не орбита) отражает геометрическое представление о стационарных состояниях электрона в атоме; такое особое название отражает тот факт, что состояния электрона в атоме описывается законами квантовой механики и отличается от классического движения по траектории. Совокупность атомных орбиталей с одинаковым значением главного квантового числа n составляют одну электронную оболочку.
Содержание
Квантовые числа и номенклатура орбиталей
Буквенные обозначения атомных орбиталей произошли от описания спектральных линий в атомных спектрах: s (sharp) — резкая серия в атомных спектрах, p (principal)— главная, d (diffuse) — диффузная, f (fundamental) — фундаментальная.
В литературе орбитали обозначают комбинацией квантовых чисел, при этом главное квантовое число обозначают цифрой, орбитальное квантовое число — соответствующей буквой (см. таблицу ниже) и магнитное квантовое число — выражением в нижнем индексе, показывающем проекцию орбитали на декартовы оси x, y, z, например 2px, 3dxy, 4fz(x²-y²). Для орбиталей внешней электронной оболочки, то есть в случае описания валентных электронов, главное квантовое число в записи орбитали, как правило, опускают.
Геометрическое представление
Геометрическое представление атомной орбитали — область пространства, ограниченная поверхностью равной плотности (эквиденситной поверхностью) вероятности или заряда. Плотность вероятности на граничной поверхности выбирают исходя из решаемой задачи, но, обычно, таким образом, чтобы вероятность нахождения электрона в ограниченной области лежала в диапазоне значений 0,9-0,99.
Поскольку энергия электрона определяется кулоновским взаимодействием и, следовательно, расстоянием от ядра, то главное квантовое число n задаёт размер орбитали.
Для линейных комбинаций Ylm приняты следующие обозначения:
| Значение орбитального квантового числа | 0 | 1 | 1 | 1 | 2 | 2 | 2 | 2 | 2 |
|---|---|---|---|---|---|---|---|---|---|
| Значение магнитного квантового числа | 0 | 0 |  |  | 0 |  |  |  |  |
| Линейная комбинация |  |  |  |  |  |  |  |  |  |
| Обозначение |  |  |  |  |  |  |  |  |  |
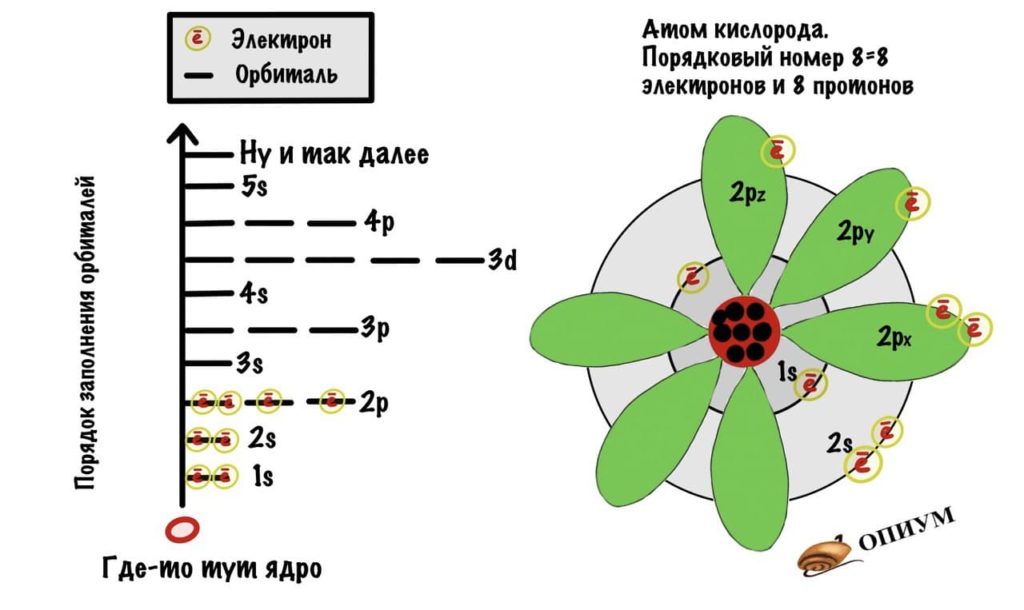
Заполнение орбиталей электронами и электронная конфигурация атома
На каждой орбитали может быть не более двух электронов, отличающихся значением спинового квантового числа s (спина). Этот запрет определён принципом Паули. Порядок заполнения электронами орбиталей одного уровня (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется Правилом Хунда.
Краткую запись распределения электронов в атоме по различным электронным оболочкам атома с учётом их главного и орбитального квантовых чисел n и l называют электронной конфигурацией атома.
Атомы и электроны
Атомно-молекулярное учение
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
Правила заполнения электронных орбиталей и примеры
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Внешний уровень и валентные электроны
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
Строение атома. Гибридизация орбиталей
Обычно в начале статьи пишут краткий план того, о чем пойдет речь в статье. Еще добавляют зачем и почему на нее нужно тратить время. Но здесь такого не будет, потому что я не уверен — нужна ли она вообще.
Но я расскажу историю. Вообще статья должна была быть про белок, как формируется первичная, вторичная структура, ну и так далее. И вот идет подготовка материала, а там довольно большую роль играет электроотрицательность. На самом деле не очень и большую, но все-таки роль у нее есть. И вот мне стало интересно, а как она формируется? Ты конечно знаешь, что она растет в периодической таблице слева направо и зависит от радиуса атома. Но почему? В общем-то эти вопросы привели меня к строению атома и закону Кулона. Поэтому сейчас мы устроим маленькое путешествие в химию и физику. Начнем со строения атома. А уже в следующей статье будем разбираться с электроотрицательностью.
Планетарная модель строения атома от Резерфорда
Это модель ключевая, потому что на ее основе строились все остальные. Вообще Резерфорд крутой мужик, который очень любил всякие опыты. Вот один из них:
Какие выводы делает Резерфорд из этого опыта? Он предполагает, что основная масса атома сосредоточена в его ядре — когда альфа-частицы попадают в него, то отскакивают в обратную сторону. Ядро очень маленькое и заряжено положительно, а вокруг него по орбитам летают отрицательно заряженные электроны. Он называет это планетарной моделью. Очень красиво, согласитесь? Мы живем в мире, который находится в солнечной системе. А атомы, из которых состоит все вокруг, имеют строение такой же системы.
Это все очень поэтично и красиво, но есть парочка проблем:
Были и еще проблемы, но это основные. Как же их решить?
Полуклассическая модель атома по Бору
Появляется второй крутой мужик. Может быть, он даже круче первого, потому что говорит такое — от чего волосы у физиков встают дыбом. Бор взял модель атома по Резерфорду и сказал что-то вроде: «Давайте предположим, что электроны движутся по орбитам, но никакую энергию они не излучают. Но если электрон перепрыгивает с одной орбиты на другую, то он выделяет энергию — фотоны. Это и есть спектр!»
Бор назвал состояние атома, когда его электроны движутся по свои орбитам, стационарным состоянием. При перепрыгивании одного электрона на другую орбиту атом становится возбужденным и может выделять энергию. Атом становится возбужденным не просто так — он поглощает какую-то энергию извне, она представляет собой фотон или фотоны.
Переведем Бора на язык физиков: “Вся ваша физика полная туфта. Атому на нее плевать, он живет по другим законам”. И все как бы в шоке, но больше всех Эйнштейн — он становится главным хейтером Бора. Но экспериментально модель Бора подтверждается.
Модель Бора чем-то похожа на дом. Представьте себе панельку. Если электрон упадет с 7 этажа на первый, то он выделит энергию — это и есть фотон. А вот если зарядить как следует атом, то электрон может прыгнуть с первого этажа на пятый. Чем больше зарядишь, тем выше прыгнет. Чем с большей высоты упадет, тем больше выделит энергии. Примерно так. Оказалось, что Бор был прав и дальше мы это увидим.
Резерфорд, кстати, сделал предположение, что ядро состоит из положительно заряженных протонов. Но Резерфорд и Бор еще не знали, от чего зависит количество электронов и протонов, но с этим разберутся попозже.
Современная модель атома
Ну а дальше началось самое интересное — физики взяли модель атома по Бору и добавили к ней своего добра. Так получилась современная модель атома. Конец! Ну или не совсем. Атом состоит из ядра и электронной оболочки. Начинаем с ядра.
Ядро атома
У атома есть ядро, которое состоит из протонов и нейтронов. Протоны заряжены положительно, а у нейтронов заряда нет. Количество протонов и электронов равно — зависит от порядкового номера в таблице Менделеева. Если это атом азота, то у него 7 протонов и 7 электронов. Нейтрон такому правилу не подчиняется — их может быть больше, а может и меньше. Протон и нейтрон весят в примерно 1800 раз больше, чем электрон. Поэтому основная масса атома находится в ядре.
На самом деле протон и нейтрон состоят из других частиц, но не будем слишком глубоко копать. Можешь почитать, если интересно.
Электронная оболочка
Электронная оболочка — это все электроны атома. Она состоит из слоев, на которых располагается какая-то часть электронов.
Каждый слой состоит из орбиталей. Заметили? Не орбит, а орбиталей. Орбита — это траектория движения тела, на которой в какой-то момент времени можно его встретить. Помните круговые поливалки в деревне? Вода из них движется по определенной траектории. Можно встать и подождать пока тебя польют в жаркий день. Орбиталь — это другое дело, на ней электрон проводит 90 процентов времени, но как он там движется — одному ему известно. Поэтому можно стоять очень долго, но так и не дождаться пока тебя польют. Пример не очень, согласен. Лучше бы привел Луну или какую-нибудь планету, но вы поняли…
Есть 4 вида орбиталей: s, p, d и f. S- это сфера, p — бесконечность или гантелька, d и f сложнее. Я их рисовать не буду, потому что они нас не интересуют. P-орбиталей всегда 3 — px, py, pz.
Слои электронной оболочки
Теперь подробнее про слои. Первый слой состоит только из одной орбитали — s. Второй слой: одна s и три p орбиталей. Третий слой — одна s, три p и пять d орбиталей. Ну а на четвертом за 5d орбиталями добавятся еще 7f. Количество слоев зависит от количества электронов, а значит от порядкового номера атома.
Тут есть определенные правила:
Добавим к атому лития, который я показывал до этого, орбитали и получим что-то такое.
Можно еще попробовать свести орбитали в один рисунок, смотрите.
Химические связи чаще всего образуются за счет неспаренных электронов, но подробнее об этом поговорим в следующей статье. А сейчас нас интересует углерод и гибридизация его орбиталей.
Гибридизация орбиталей
Сначала посмотрим на электронную формулу углерода и вспомним о Боре. В стационарном состоянии у углерода всего два электрона на 2p-орбиталях. Однако, если атом углерода поглотит энергию фотона, то электрон с 2s-орбитали может перейти на 2p-орбиталь — атом углерода становится возбужденным. В таком состоянии он может образовать 4 связи, т.к. у него 4 неспаренных электрона.
И тут встал вопрос. Атом углерода в возбужденном состоянии может образовать четыре связи, так как у него четыре неспаренных электрона. Но энергия связей будет разной, потому что эти электроны располагаются на разных орбиталях (у p орбитали энергия побольше). Это не очень хорошо сказывается на стабильности системы. Как выйти из этого положения? Атом придумал интересную штуку — он изменил форму и размеры орбиталей. Это и есть гибридизация.
У азота есть одна неподеленная электронная пара на втором энергетическом слое, а именно на 2s-орбитали — там находится два электрона и третий туда уже не засунуть. Но азот может отдать протону водорода один электрон по донорно-акцептерному механизму и образовать связь. Так возникает ион аммония. Такая же тема с водой, но кислород не может отдать по электрону от каждой электронной пары — только с одной! Так образуется ион гидроксония.
sp 2 и sp-гибридизация
Куда пропала p-связь? Ну ладно, держите формулу этилена со всеми связями.
На рисунке видно, что p-орбитали без гибридизации находятся над и под плоскостью, они образуют сигма-связь — эта связь более жесткая, чем пи-связь. Поэтому вращение вокруг нее ограничено.
sp-гибридизацию нарисовать не смогу, сорян. Но смысл вы поняли: без изменений останутся две p-орбитали, а две sp-орбитали будут похожи на палочку — угол между ними будет 180 градусов. Одна p-орбиталь будет идти над плоскостью, а другая смотреть в лицо. Надеюсь, что у тебя получилось представить. Едем дальше.
Атомный остов
Электронный слой бывает завершенным или незавершенным:
Заряд ядра атома (количество протонов) + заряд завершенных слоев (количество электронов) = атомный остов. Картинка….
У кислорода заряд атомного остова больше, чем у натрия. Это нам понадобится, когда будем считать электроотрицательность.
Фух, со строением атома закончили. Поздравляю всех, кто дочитал до этого момента. Дальше можно переходить к электроотрицательности, но это уже в следующей статье.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.