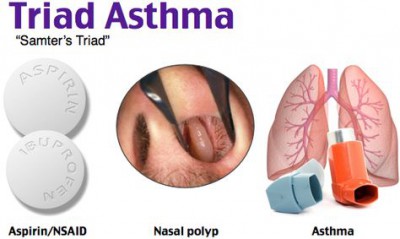
Аспириновая триада что это такое
Аспириновая астма. Аспириновая триада.
Возникает в возрасте 30-50 лет, у женщин в 2 раза чаще. Составляет 9-22 % от всех случаев бронхиальной астмы. Среди больных, одновременно страдающих бронхиальной астмой, синуситами и полипами носа, непереносимость аспирина встречается у 30-40%.
Классическая аспириновая триада включает непереносимость аспирина, полипы носа и бронхиальную астму. Аспириновая бронхиальная астма может протекать без ринита, синусита и полипов носа. Складываясь из триады симптомов, аспириновая астма может порой не проявляться одним из своих симптомов, и тогда говорят о неразвёрнутой астматической триаде.
Причины возникновения и механизм развития аспириновой астмы
Механизм развития бронхоспазма и связанных с ним приступов удушья при аспириновой астме обусловлен нарушением метаболизма арахидоновой кислоты под действием НПВС. При этом в избытке образуются медиаторы воспаления – цистеиниловые лейкотриены, которые усиливают воспалительный процесс в дыхательных путях и приводят к развитию бронхоспазма, провоцируют избыточную секрецию бронхиальной слизи, повышают сосудистую проницаемость. Это позволяет считать данную патологию респираторной псевдоаллергией.
Аспириновая бронхиальная астма имеет тяжелое течение, слабо реагирует на введение бронхолитиков и требует раннего назначения ингаляционных глюкокортикостероидов для предотвращения осложнений.
Причина возникновения аспириновой бронхиальной астмы обусловлена повышенной чувствительностью к аспирину и другим НПВС. Возможна гиперреакция и на природные салицилаты, желтый краситель тартазин, а также различные консервированные продукты, в состав которых входят производные салициловой и бензойной кислоты.
Степени тяжести АБА
Клиническое течение аспириновой бронхиальной астмы
• в раннем возрасте предшествует хронический ринит, который может обостряться при применении аспирина;
• позже появляются полипы носа, гипертрофический синусит, гнойный синусит, эозинофилия, бронхиальная астма.
Симптомы непереносимости НПВС
• боли в животе, сопровождающиеся тошнотой и рвотой.
Диагностика АБА
Диагноз «астма» пациенту выставляют на основании данных анамнеза, клинической картины и т.д. Несколько отличается в этом плане диагностика гиперчувствительности к аспирину. Есть специальный тест, при котором пациент получает нестероидные вещества в постепенно возрастающих дозах. Если организм пациента не отвечает на попадание в него 650 мг препарата, то считается, что пациент не имеет гиперчувствительности.
Эта процедура должна проводиться строго в условиях стационара и под контролем медиков. У них должны быть все необходимые средства для оказания первой медицинской помощи пациенту, ведь ответ на раздражитель со стороны организма может быть очень выраженным.
Дифференциальная диагностика аспириновой астмы проводится с:
• хронической обструктивной болезнью легких;
• острой респираторной инфекцией;
• туберкулезными и опухолевыми поражениями бронхов;
Лечение аспириновой астмы
Основа лечения аспириновой астмы не будет существенно отличаться от терапии заболевания обычной формы. Единственной поправкой будет полный отказ от приема НПВС.
Средства, применяемые для терапии астмы, делят на такие группы:
1. Препараты профилактического действия (помогают избегать возможных обострений):
• системные стероиды, применяются в случае неэффективности ингаляционных;
• антагонисты лейкотриеновых рецепторов.
2. Препараты для оказания скорой помощи (для устранения признаков обострения болезни, в том числе, признаков удушья):
• бронхорасширяющие препараты b2-агонисты быстрого действия;
• стероиды для приема перорально (внутрь);
• терапия О2 (кислородолечение);
Профилактика АБА
Для успешного контроля течения патологии важно, чтобы больной не принимал:
• препараты пиразолонового ряда (анальгин, амидопирин, реопирин, спазмалгон, темпалгин, баралгин, теофедрин и др.); ацетилсалициловую кислоту и препараты ее содержащие (плидол, томапирин, цитрамон и др.); другие НПВС и средства, имеющие их в своем составе (диклофенак, индометацин, ибупрофен, сулиндак, пироксикам, напроксен и др.);
• желтый краситель тартразин, который используют для оболочек медикаментов или кондитерских изделий и украшений желтого цвета;
• некоторые пищевые продукты, содержащие красители и консерванты, противопоказанные при аспириновой астме, употребляемые в пищевой промышленности (сульфиты, бензоаты, тартразин и др.);
• все продукты, содержащие промышленные или природные салицилаты (консервы, гастрономические изделия, малина, черная смородина, вишня, абрикосы, сливы, апельсины, томаты, огурцы).
Прогноз при аспириновой астме
Аспириновая астма, как и другие виды данной патологии, является весьма опасным заболеванием, которое нередко может привести к реанимации или летальному исходу. Однако при корректном и своевременном лечении жизнь пациента может быть вполне комфортной.
Аспириновая бронхиальная астма
Кафедра госпитальной терапии п/ф РГМУ
Эти симптомы обычно сопровождаются распространенной, но вариабельной обструкцией бронхиального дерева, которая частично или полностью обратима (спонтанно или под влиянием лечения).
Термин «аспириновая астма» (АА) обозначает определенный клинико-патогенетический вариант, когда одним из бронхоконстрикторных факторов у больного являются нестероидные противовоспалительные препараты (НПВП).
Аспирин внедрен в клиническую практику в 1899 г. как анальгезирующее и жаропонижающее средство. И уже в 1903 г. Dr. Franke (Германия) описал у себя аллергическую реакцию на прием аспирина в виде ларингоспазма и шока. В 1905 г.
Barnett описал и опубликовал два случая затрудненного дыхания на фоне приема аспирина. В 1919 г. Francis выявил зависимость между полипозным ринитом и гиперчувствительностью к аспирину. В 1922 г. Widal впервые установил зависимость между непереносимостью аспирина, полипозным ринитом и бронхиальной астмой.
В 1968 г. Samter и Beers снова описали этот симптомокомплекс, который назвали «аспириновой триадой». С этого времени стало известно много нового об эпидемиологии, клинических проявлениях и патофизиологии непереносимости аспирина и других НПВП у больных бронхиальной астмой. Ключевым является ворос о том, почему только у части больных бронхиальной астмой наблюдается непереносимость НПВП. Открытие цистенил-лейкотриенов и их участие в патогенезе бронхиальной астмы во многом объясняет патогенез аспириновой триады.
Течение риносинусита у данной категории больных бронхиальной астмой имеет свои особенности. Наиболее часто АА дебютирует длительным ринитом, который у 20-25% больных постепенно переходит в полипозную риносинусопатию.
Назальные симптомы, как правило, резко выражены и плохо поддаются терапии. Обычно используются топические, а иногда и системные глюкокортикостероиды, но они часто недостаточно эффективны, и больным регулярно проводится хирургическое лечение.
Больные АА не переносят аспирин и другие НПВП, и эта непереносимость проявляется покраснением лица, потерей сознания, приступами удушья, кашля, ринита и конъюнктивита, уртикарными высыпаниями, отеком Квинке, подъемом температуры, диареей, болью в животе, сопровождающейся тошнотой и рвотой. Наиболее тяжелыми проявлениями реакции на аспирин являются астматический статус, остановка дыхания и шок.
Нет убедительных данных о наследственной предрасположенности к АА, однако исследования в этой области проводятся, так как имеются наблюдения нескольких семей, в которых бронхиальная астма сочетается с непереносимостью аспирина. Заболевание возникает в возрасте от 30 до 50 лет, чаще болеют женщины.
Клетки, участвующие в воспалении и находящиеся в дыхательных путях, вырабатывают различные медиаторы, которые оказывают непосредственное воздействие на гладкие мышцы бронхов, сосуды и секретирующие слизь клетки, а также посылают «сигналы» другим клеткам, тем самым привлекая и активируя их. Среди различных медиаторов, вызывающих сокращение гладких мышц бронхов, наиболее важное значение имеют цистеиновые лейкотриены. Эти вещества могут оказывать и другие существенные воздействия, например, вызывать отек, гиперреактивность бронхов и изменять секрецию слизи.
Лейкотриены синтезируются из арахидоновой кислоты, которая высвобождается при иммунологической или неиммунологической стимуляции различных клеток, участвующих в воспалении. Арахидоновая кислота может подвергаться дальнейшим метаболическим превращениям как с помощью циклооксигеназной системы (с образованием простагландинов и тромбоксанов), так и с помощью системы ферментов 5-липоксигеназы (с образованием лейкотриенов). Для функционирования 5-липоксигеназ требуется связанный с мембраной белок, называемый 5-липоксигеназактивирующим белком. Первоначально предполагалось, что этот фермент необходим для связывания с энзимами 5-липоксигеназы, однако теперь считается, что он, по-видимому, является контактным белком для арахидоновой кислоты.
Соотношение между ЛТВ4 и цистеиновыми лейкотриенами колеблется от клетки к клетке. Синтезировать ЛТС4 способны эозинофилы, базофилы, тучные клетки и альвеолярные макрофаги: нейтрофилы синтезируют преимущественно ЛТВ4.
Рецепторы для ЛТВ4 и для цистеиновых лейкотриенов различны. Основное действие ЛТВ4, по-видимому, состоит в привлечении и активации клеток, участвующих в воспалении, в первую очередь нейтрофилов и эозинофилов. ЛТВ4, как считается, играет важную роль в развитии гнойного воспаления, возможно, он также имеет существенное значение в развитии воспалительных заболеваний, в том числе ревматоидного артрита.
Однако его роль в патогенезе бронхиальной астмы вызывает сомнение и остается неясной. Показано, что антагонисты рецепторов к ЛТВ4 не оказывают влияния на нарушения функции дыхания, возникающие во время ранней отсроченной реакции больных бронхиальной астмой на «провокацию» антигеном.
В патогенезе АА в настоящее время ключевая роль отодится нарушению метаболизма арахидоновой кислоты. В нем принимают участие три группы ферментов циклоксигеназы (ЦО), липоксигеназы (ЛО) и моноксигеназы. Продуктами 5-липоксигеназного пути расщепления арахидоновой кислоты являются лейкотриены ЛТС4, ЛТД4 и ЛТЕ4, которые считаются наиболее мощными бронхоконстрикторами (в совокупности они составляют медленно реагирующую субстанцию анафилаксии). ЛТС4, ЛТД4 и ЛТЕ4 играют ключевую роль в воспалительной реакции при бронхиальной астме. Они не только являются бронхоконстрикторами, но и увеличивают сосудистую проницаемость, усиливая отек слизистой бронхов, вызывают повышенную секрецию слизи бронхиальными железами с нарушением клиренса бронхиального содержимого. Конкретный биохимический дефект у больных АА до настоящего времени не обнаружен, однако известно, что при приеме аспирина или других НПВП, являющихся ингибиторами ЦО, происходит «переключение» метаболизма арахидоновой кислоты преимущественно на липоксигеназный путь. Установлено также, что интенсивность приступа удушья, вызванного приемом НПВП, в значительной степени обусловлена выраженностью циклоксигеназного действия данного препарата.
Подчеркивая роль цистенил-лейкотриенов в патогенезе АА, следует отметить повышенное содержание ЛТЕ4 (приблизительно в 3-6 раз) в моче и ЛТС4 в назальном секрете в сравнении с другими вариантами бронхиальной астмы. Провокация аспирином резко повышает количество ЛТЕ4 и ЛТС4 в моче, назальном секрете и в бронхиальном лаваже.
Представляет также большой интерес тромбоцитарная теория развития АА. Было обнаружено, что тромбоциты больных АА в отличие от тромбоцитов здоровых активируются in vitro под действием НПВП, что проявляется увеличением хемилюминесценции и дегрануляции клеток с выбросом цитотоксических и провоспалительных медиаторов. Другие же клетки периферической крови не активировались под действием НПВП in vitro. Как известно, блокада ЦО, вызванная НПВП, приводит к угнетению продукции простагландина (ПГ) Н2. Авторы тромбоцитарной теории предполагают, что снижение уровня данного ПГ играет важную роль в активации тромбоцитов у больных АА.
В подавляющем большинстве работ не было выявлено участие реагинового механизма в развитии аспиринового удушья. Имеются лишь единичные сообщения об обнаружении специфических lgE-антител к дериватам аспирина.
Важное значение в постановке диагноза АА имеют данные анамнеза о реакции больного на прием обезболивающих или жаропонижающих препаратов. У части пациентов могут быть четкие указания на развитие приступа удушья после применения НПВП. Отсутствие у ряда больных АА указаний на непереносимость НПВП, как правило, обусловлено слуедующими причинами: относительно низкой степенью гиперчувствительности к препаратам с антициклоксигеназным действием, одновременным приемом медикаментов, нейтрализующих бронхоконстрикторное действие НСПВП, например антигистаминных, симпатомиметических средств, препаратов теофиллина, замедленной реакцией больного на НПВП, редким приемом НПВП.
Однако определенная часть больных АА не принимает НПВП, и приступы удушья у них могут быть связаны с употреблением в пищу природных салицилатов, а также консервированных с использованием ацетилсалициловой кислоты продуктов. Следует отметить, что значительная часть больных не осведомлена о том, что различные НПВП входят в состав таких часто используемых комбинированных препаратов, как цитрамон, пенталгин, седалгин, баралгин и др.
Важно задать больному бронхиальной астмой вопрос об эффективности применения теофедрина для купирования приступа удушья. Больные АА обычно указывают на неэффективность теофедрина, либо отмечаеют его двухстадийное действие: вначале наступает некоторое уменьшение бронхоспазма, а затем бронхоспазм вновь нарастает из-за присутствия в теофедрине амидопирина и фенацетина.
Интенсивность реакции на НПВП зависит от степени чувствительности больного к препарату, она также тесно коррелирует с антициклоксигеназной активностью данного препарата. По данным ряда авторов, наибольшую ингибиторную активность в отношении ЦО среди НПВП проявляет индометацин. Чем сильнее антициклоксигеназное действие НПВП, тем интенсивнее симптомы непереносимости данной группы препаратов. Интенсивность реакции также коррелирует с дозой принятого медикамента. Важную роль играет и способ применения НПВП. При ингаляционном, внутривенном или внутримышечном введении интенсивность реакции обычно максимальная.
Таким образом, в постановке диагноза АА большая роль отводится сбору анамнеза и анализу клинических проявлений болезни.
Для подтверждения диагноза АА в настоящее время могут применяться провокационные тесты in vivo или же in vitro.
В настоящее время разрабатывается методика лабораторной диагностики АА, основанная на определении ЛТЕ4 в моче и ЛТС4 в назальном лаваже.
Следует отметить, что при проведении провокационных тестов с лизин-аспирином у больных АА резко повышается содержание ЛТЕ4 в моче и ЛТС4 в назальном лаваже.
По-видимому, в ближайшее время будут рекомендованы определенные стандарты в диагностике данного варианта бронхиальной астмы.
В настоящее время в лечении бронхиальной астмы, в том числе и аспириновой, основная роль отводится длительному приему противоастматических противовоспалительных лекарств. Для подбора адекватной противовоспалительной терапии важно определить тяжесть течения бронхиальной астмы. Ни один тест не позволяет точно классифицировать степень тяжести бронхиальной астмы, однако комбинированная оценка симптомов и показателей функции внешнего дыхания дает представление о тяжести заболевания. Было показано, что оценка течения бронхиальной астмы, основанная на клинических проявлениях болезни, связана с показателями степени воспаления дыхательных путей.
В зависимости от уровня обструкции и степени ее обратимости астму по степени тяжести подразделяют на интермиттирующую, легкую персистирующую (хронического течения), средней тяжести (умеренную) и тяжелую. При лечении астмы в настоящее время применяют «ступенчатый» подход, при котором интенсивность терапии повышается по мере увеличения степени тяжести астмы. Наиболее часто используемыми препаратами вне обострения бронхиальной астмы являются ингаляционные кортикостероиды, доза которых зависит от степени тяжести астмы, недокромил-натрий и кромогликат натрия, теофиллины длительного действия и пролонгированные симпатомиметики.
Обычно больным АА необходимы высокие поддерживающие дозы ингаляционных кортикостероидов: назальные симптомы также требуют длительного лечения топическими стероидами. В данной группе больных часто приходится прибегать к назначению системных стероидов, поэтому разрабатываются различные патогенетические подходы к терапии АА.
Одним из патогенетических методов лечения АА является проведение десенситизации аспирином. Метод основан на феномене развития толерантности больного АА к повторному воздействию НПВП в период 24-72 ч после удушья, вызванного приемом НПВП. Stevenson показал, что десенситизация аспирином позволяет контролировать симптомы риносинусита и бронхиальной астмы. Десенситизацию аспирином проводят также больным при необходимости назначать НПВП по поводу других заболеваний (ИБС, ревматические болезни и др.). Десенситизация проводится по различным схемам, которые подбираются индивидуально, в стационаре и только врачом, владеющим данной методикой. Десенситизацию начинают с дозы 5-10 мг и доводят ее до650 мг и выше, поддерживающие дозы составляют 325-650 мг/сут.
Противопс сазанием к проведению десенситизаци i аспирином являются обострение бронхиальной астмы, кровоточивость, язвенная болезнь желудка и двенадцатиперстной кишки, тяжелые заболевания печени и почек, беременность.
Исследования последних лет показали, что мехнизм десенситизации связан с нечувствительностью рецепторов воздухоносных путей к биологическим эффек- там лейкотриенов. Поэтому в настоящее время в терапии больных АА большое значение придается антагонистам лейкотриеновых рецепторов. Доказана клиническая эффективность препаратов сингуляр монтелукаст и зафирлукаст в терапии больных АА.
В проведенных исследованиях добавление антагонистов лейкотриенов к терапии бронхиальной астмы приводит к выраженному в сравнении с плацебо возрастанию ОФВ1 улучшению показателей пиковой скорости выдоха в утренние и вечерние часы, уменьшению ночных приступов удушья. Показан также хороший эффект антагонистов лейкотриенов при использовании в комбинации со стероидами и /или пероральными стероидами.
Таким образом, в настоящее время мы можем сказать, что появился класс препаратов, которые влияют на патогенетическое звено АА и дают выраженный клинический эффект.
2. Чучалин А.Г. Бронхиальная астма. М., 1997.
3. Bousquet J, et al. Eosinophilic inflammation in asthma. NEnglJMed 1990; 32’3:1033- 89.
4. British Thoracic Sosiety, et al. Guidelines on the management of asthma. Thorax 1993;48 (2 suppl):SI-S24.
5. Burney PGJ. Current questions in the epidemiology of asthma, in Holgate ST, et al (eds), Asthma: Physiology. Immunology, and Treatment. London Academic press, 1993; pp 3-25.
6. Holgate S., Dahlen S-E. SRS-A to Leukotrienes, 1997.
Опубликовано с разрешения администрации Русского Медицинского Журнала.
Тяжелая бронхиальная астма (Согласительный доклад объединенной группы экспертов)
Общая информация
Краткое описание
ТЯЖЕЛАЯ БРОНХИАЛЬНАЯ АСТМА
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Этиология и патогенез
Эпидемиология
Диагностика
Обострения бронхиальной астмы. Для ТБА характерен более высокий риск частых жизнеугрожающих обострений. Обострения астмы представляют собой эпизоды нарастающей одышки, кашля, свистящих хрипов, или заложенности в грудной клетке, но чаще всего обострение проявляется некупирующимся или плохо купирующимися приступами удушья, требующими изменений обычного режима терапии. Тяжёлое обострение, это – ухудшение течения бронхиальной астмы, требующее применения системных кортикостероидов (в случае пациентов на стабильной поддерживающей дозе – увеличения дозы системных кортикостероидов) в целях предотвращения серьезных последствий [28].
К обострению БА могут привести различные триггеры, индуцирующие воспаление дыхательных путей или провоцирующие острый бронхоспазм. Данные триггеры могут значительно различаться у разных больных. К основным триггерам относятся инфекции респираторного тракта (в основном, вирусы, чаще всего − риновирусы) аллергены, аэрополлютанты, физическая нагрузка, метеорологические факторы, прием некоторых лекарственных препаратов (бета-блокаторы, у больных с «аспириновой триадой» – НПВП), эмоциональные реакции и др. Другими факторами, которые способны привести к обострению БА, являются обострение риносинусита, гастроэзофагеальный рефлюкс, беременность, и недостаточная терапия.
Дифференциальный диагноз
Лечение
При сохранении контроля над ТБА в течение ≥3 месяцев и низком риске обострений, рекомендуется уменьшение объема поддерживающей терапии с целью установления минимального сочетания медикаментозных средств и оптимальных доз препаратов, достаточных для контроля. Основные принципы назначения фармакотерапии при ТБА, изложенные в международных рекомендациях, и поддерживаемые во многих странах мира, изложены на рис 2.
Таблица 3. Уровни контроля БА. 

Рисунок 2. Основные принципы назначения фармакотерапии при ТБА
Рис. 3. Мишени для биологических препаратов, применяемых в лечении БА
Аллергическая БА развивается с участием аллергического воспаления 1 типа (по классификации Gell, Coombs, 1975), одним из основных участников которого является IgE. Он связывается с высоко аффинными рецепторами, расположенными на поверхности тучных клеток, базофилов, антигенпрезентирующих дендритных клеток, формируя сенсибилизацию к причиннозначимому для данного пациента аллергену. При поступлении в сенсибилизированный организм аллергена, происходит его связывание с IgE, фиксированными на рецепторах эффекторных клеток, что, в свою очередь, стимулирует выброс из них провоспалительных цитокинов и развитие симптомов. Именно поэтому связывание моноклональными антителами свободного IgE в крови пациента с БА стало первой и значимой целью для создания биологической молекулы противоастматического направления.
Омализумаб – рекомбинантное гуманизированное моноклональное антитело, связывающее свободный IgE и препятствующее его взаимодействию с рецепторами тучных клеток, базофилов и др. участников аллергического воспаления 1 типа [10]. Препарат дозируется индивидуально, в зависимости от веса пациента и исходного уровня общего IgE, назначается в виде подкожных инъекций 1 раз в 2-4 недели. Лечение омализумабом приводит к уменьшению симптомов астмы, увеличению спирометрических показателей, снижению потребности в использовании препаратов неотложной терапии, повышению качества жизни, снижает риск развития обострений и госпитализаций [11, 12].
Наиболее частыми побочными реакциями, описанными при использовании омализумаба, являются местные реакции, встречающиеся до 45% случаев. Как правило, эти реакции проходят самостоятельно и не требуют дополнительной терапии [12]. Описан также минимальный риск развития анафилаксии, оцениваемый разными авторами до 0,2%. Большинство системных реакций на омализумаб развивается в течение первых 60-90 минут от момента введения препарата, что диктует необходимость пребывания пациента под наблюдением медицинского персонала в учреждении, оборудованном для оказания помощи при анафилаксии, в течение этого времени [10].
В настоящее время разработаны три молекулы моноклональных антител против ИЛ-5. Две из них – Меполизумаб и Реслизумаб взаимодействуют со свободным ИЛ-5, одна – Бенрализумаб – взаимодействует с альфа-цепью высоко аффинного рецептора для ИЛ-5.
Долгосрочное наблюдение за пациентами продемонстрировало, что препарат Реслизумаб переносится хорошо. К наиболее частым НЯ (общим как для групп больных, получавших плацебо, так и для пациентов на реслизумаба) следует отнести НЯ, связанные с ухудшением течения БА и аллергического ринита, назофарингиты, синуситы и инфекции верхних дыхательных путей, головную боль, бронхиты и инфекции мочевыводящих путей [16]. В клинических исследованиях у 0,3% пациентов, страдающих ТБА, зарегистрирована реакция, расцененная как анафилактическая, в связи с приемом препарата Реслизумаб. Проявления включали кожные реакции или реакции со стороны слизистой оболочки, диспноэ, хрипы, желудочно-кишечные симптомы и озноб. Данные нежелательные явления наблюдались во время или сразу по завершении инфузии реслизумаба и были полностью устранены без последствий при помощи соответствующего стандартного лечения. Ни у одного из пациентов не наблюдалось развитие иммунной реакции в виде образования антител на Реслизумаб [14, 15].
или утрачивающий контроль над астмой при отмене высоких доз ИГКС или СКС [27].
Каждому пациенту, являющемуся кандидатом на назначение биологической терапии, необходимо пройти все диагностические ступени, изложенные ранее, а также знать актуальные значения уровня эозинофилии периферической крови и общего IgE. В зависимости от анамнестических указаний, клинических особенностей течения болезни, наличия гиперчувствительности к одному из круглогодичных аллергенов и значения лабораторных маркеров, врач – специалист определяет точный диагноз с указанием фенотипа БА (аллергическая БА или неаллергическая БА), а в дальнейшем выбирает соответствующий препарат для больного БА. Контроль эффективности назначенного лечения предполагается не ранее, чем через 16 недель от начала биологической терапии. Критериями эффективности проводимого лечения являются клинические характеристики течения БА, спирометрические показатели, кратность и тяжесть обострений БА. Уровень общего IgE в сыворотке крови в процессе лечения омализумабом не определяют, так как он изменяется существенно под действием назначенного препарата и не является в дальнейшем значимым маркером для оценки эффективности проводимой терапии.
Информация
Источники и литература
Информация
Барановская Татьяна Васильевна 1 (Беларусь), Белевский Андрей Станиславович 2 (Россия), Восканян Андраник Гайкович 3 (Армения), Гаджиев Кямал Мудафаевич 4 (Азербайджан), Давлеталиева Нуриля Эмильбековна 5 (Кыргызстан), Емельянов Александр Викторович 6 (Россия), Курбачева Оксана Михайловна 7 (Россия), Княжеская Надежда Павловна 8 (Россия), Мукатова Ирина Юрьевна 9 (Казахстан), Ненашева Наталия Михайловна (Россия) 10