Аспирация секрета ротоглотки что значит
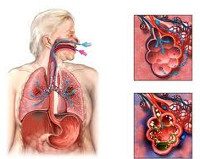
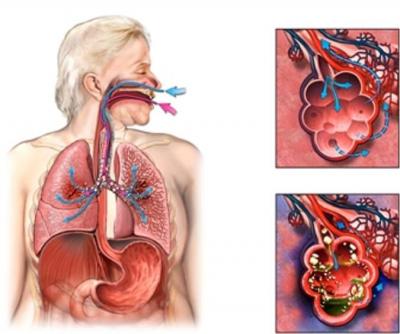
Аспирационная пневмония
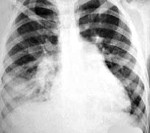
Аспирационная пневмония – это инфекционно-токсическое повреждение легочной паренхимы, развивающееся вследствие попадания в нижние дыхательные пути содержимого ротовой полости, носоглотки, желудка. Аспирационная пневмония проявляется кашлем, тахипноэ, цианозом, тахикардией, болью в груди, лихорадкой, появлением зловонной мокроты. Диагностика аспирационной пневмонии опирается на аускультативные и рентгенологические данные, результаты бронхоскопии, микробиологического исследования содержимого нижних дыхательных путей и плеврального выпота. Лечение аспирационной пневмонии требует проведения оксигенотерапии, антибиотикотерапии, эндоскопической санации трахеобронхиального дерева; при необходимости проводится дренирование развившихся абсцессов или эмпиемы плевры.
МКБ-10
Общие сведения
Под аспирационной пневмонией в пульмонологии понимается воспаление легких, возникшее в результате установленного эпизода случайного попадания в нижние дыхательные пути содержимого ротоносоглотки или желудка. Среди различных форм пневмоний аспирационная пневмония имеет довольно большой удельный вес: на ее долю приходится около 23% случаев тяжелых форм легочной инфекции. Аспирационный синдром нередко встречается у практически здоровых лиц во время сна. Так, при исследованиях с ирригацией носоглотки раствором, меченным радиоактивными изотопами, аспирация была зафиксирована у 45-50% здоровых людей и у 70% пожилых пациентов в возрасте старше 75 лет с нарушением сознания.
Причины
Аспирационные пневмонии развиваются на фоне случайного попадания твердых частиц или жидкости в воздухоносные пути. Тем не менее, одного лишь факта аспирации недостаточно для возникновения аспирационной пневмонии. В механизме развитии пневмонии играет роль количество аспирированного содержимого и его характер, число микроорганизмов, попадающих в терминальные бронхиолы, их вирулентность, состояние защитных факторов организма.
Факторы риска
Чаще всего преморбидным фоном для аспирационных пневмоний служат:
Нарушения сознания, обусловленные различными факторами:
Заболевания периферической и центральной нервной системы:
Заболевания, сопровождающиеся нарушением акта глотания (дисфагией) и регургитацией:
Травмы и ятрогенные повреждения:
В детском возрасте:
Патогенез
Сценарий развертывания событий при аспирации содержимого в трахеобронхиальное дерево может варьировать от полного отсутствия нарушений до развития респираторного дистресс-синдрома, дыхательной недостаточности и гибели пациента. Условиями, приводящими к развитию аспирационной пневмонии, служат нарушения факторов местной защиты в дыхательных путях и патологический характер аспирационных масс (количество, химические свойства и рН, степень инфицированности и пр.). Основными патогенетическими звеньями, приводящими к возникновению аспирационной пневмонии, выступают механическая обструкция дыхательных путей, острый химический пневмонит и бактериальная пневмония.
При вдыхании большого объема аспирата или крупных твердых частиц возникает механическая обструкция трахеобронхиального дерева. Возникающий при этом защитный кашлевой рефлекс способствует еще более глубокому проникновению аспирированного субстрата в бронхи и бронхиолы, что может привести к развитию отека легких. Механическая обструкция сопровождается развитием ателектазов легкого и застоем бронхиального секрета, на фоне которых увеличивается риск инфицирования легочной паренхимы.
В ответ на агрессивное воздействие аспирированного содержимого развивается острый химический пневмонит, характеризующийся выбросом биологически активных веществ, активацией системы комплемента, высвобождением факторов некроза опухолей, цитокинов и т. д. Дальнейшие патологические изменения в легочной паренхиме обусловлены ее повреждением биологически активными веществами, а не прямым действием аспирата. На фоне рефлекторного бронхоспазма, ателектаза части легкого, снижения легочной перфузии и прямого повреждения альвеол быстро развивается гипоксемия. С присоединением бактериального компонента нарастает дыхательная недостаточность, лихорадка, кашель, т. е. появляются все признаки бактериальной пневмонии. В этой стадии аспирационной пневмонии рентгенологически определяются очаги инфильтрации, нередко возникают легочные абсцессы и эмпиема плевры.
Симптомы аспирационной пневмонии
В клиническом течении аспирационная пневмония проходит этапы пневмонита, некротизирующей пневмонии, абсцедирования и эмпиемы плевры. В отличие от бактериальной легочной инфекции, клиника аспирационной пневмонии разворачивается постепенно и стерто. В течение нескольких дней после эпизода аспирации могут иметь место субфебрилитет, слабость, сухой мучительный кашель. В дальнейшем нарастают диспноэ, боли в грудной клетке, лихорадка, тахикардия, цианоз, выделение пенистой мокроты с примесью крови при кашле. Нередко, уже спустя 10-14 суток при аспирационной пневмонии возникает абсцедирование легочной ткани и эмпиема плевры. При этом появляется продуктивный кашель с выделением гнойной мокроты с гнилостным запахом, кровохарканье, ознобы.
Диагностика
Лечение аспирационной пневмонии
При наличии абсцессов в легких выполняется их дренирование, проводится вибрационный массаж, перкуторный массаж грудной клетки. При необходимости осуществляется повторная трахеальная аспирация секрета, санационные бронхоскопии и бронхоальвеолярный лаваж. К хирургическому вмешательству прибегают при организации абсцессов больших размеров (более 6 см), легочном кровотечении, образовании бронхоплевральной фистулы. При аспирационной пневмонии, осложненной эмпиемой плевры, выполняется дренирование плевральной полости, проводятся санационные промывания, введение в полость плевры антибиотиков и фибринолитиков. Возможно проведение открытого дренирования (торакостомии), плеврэктомии с декортикацией легкого.
Прогноз и профилактика
При небольших объемах аспирированного содержимого, стабильном общем фоне и своевременном грамотном лечении, прогноз при аспирационной пневмонии не вызывает опасений. В случае развития массивного пневмонита, легочных абсцессов, эмпиемы плевры, бронхоплевральных свищей, сепсиса – прогноз крайне серьезен. Летальность при осложненном течении аспирационных пневмоний составляет 22%.
Учитывая высокий риск аспирационной пневмонии среди лиц, страдающих заболеваниями нервной и пищеварительной систем, необходимо проводить лечение основного патологического состояния. Пациентам с дисфагией и склонностью к аспирации рекомендуется дробное питание и щадящая диета. Для профилактики рефлюкса у пациентов с дисфагией, тяжелобольных и послеоперационных пациентов необходимо приподнимать головной конец кровати под углом 30-45°. Особое внимание следует уделять пациентам, находящимся на ИВЛ, зондовом питании. Большую роль в предупреждении аспирационных пневмоний играет гигиена и своевременная санация полости рта, регулярное посещение стоматолога.
Аспирационный синдром
В.Е. Волков, проф., С.В. Волков, проф., Н.Н. Чеснокова
Чувашский государственный университет им. И.Н. Ульянова
Аспирационный синдром в большинстве случаев – внезапное попадание в дыхательные пути (аспирация) кислого желудочного содержимого, вызывающего ожог дыхательных путей и часто сопровождающегося развитием у больного критического состояния. Впервые это жизнеопасное осложнение описано С.Л. Мендельсоном в 1946 г. как неотложное состояние вследствие массивной аспирации желудочного содержимого у рожениц, при родах под общим обезболиванием. Хотя с тех пор прошло более 7 десятилетий, многие вопросы, касающиеся профилактики, неотложной диагностики и лечения синдрома остаются нерешенными, что подтверждается высокой летальностью – ≥40–50% [4].
Этиология и патогенез
В основе развития синдрома лежат аспирация желудочного содержимого, что приводит к химическому ожогу дыхательных путей и альвеол в результате воздействия хлористого водорода со свойствами сильной кислоты, а также обструкция дыхательных путей рвотными массами. Развивается обструктивная (асфиксическая) форма острой дыхательной недостаточности с возможностью летального исхода в течение нескольких минут, реже – часов и дней.
Считается, что для развития синдрома Мендельсона достаточно попадания в дыхательные пути 20–30 мл желудочного сока, имеющего низкий рН. Химический ожог слизистой оболочки дыхательных путей сопровождается повреждением эпителия трахеи, бронхов, бронхиол, стенок альвеол и эндотелия легочных капилляров. Степень повреждающего действия находится в прямой зависимости от кислотности и количества аспирированного желудочного сока. Вследствие кислотного ожога происходит экстравазация плазменной части крови в легочный интерстиций, а также в полость альвеол, что приводит к отеку легких и развитию острого респираторного дистресс-синдрома. Нарастание отека слизистой бронхов и бронхиол быстро вызывает бронхолегочную обструкцию, проявляющуюся распространенным бронхиолоспазмом и перенаполнением жидкостью альвеол, что ведет к развитию гипоксии вследствие острой дыхательной недостаточности.
Деструктивные изменения в легких, проявляющиеся повреждением эпителиального и эндотелиального слоев и отека, могут возникать под воздействием желудочного сока при рН 2,5–5,0, а также при попадании в дыхательные пути желчи, желудочных ферментов и других агрессивных компонентов [1]. При массивной аспирации желудочного или пищеводного содержимого у больного может быстро развиться асфиксический синдром, при котором первостепенное значение приобретает механический фактор; одновременно возникает обструкция трахеи, бронхов и бронхиол. Кроме обструкции, указанные легочные макроструктуры подвергаются химическому воздействию, что усугубляет тяжесть повреждения тканевых структур легких. Помимо этого, аспирация инфицированного содержимого из ротоглотки, а при кардиоспазме и кардиостенозе – из резко расширенного атоничного пищевода приводит к развитию пневмонита, при котором поражаются в основном нижние доли легких вплоть до развития абсцессов различной величины.
Аспирация желудочного содержимого или регургитация содержимого пищевода возможны при нарушении сознания (наркоз, опьянение, действие седативных средств, кома, горизонтальное положение больного). У всех больных перед экстренным оперативным вмешательством, при родах предполагается наличие содержимого в желудке, когда нарушена его эвакуация из желудка в кишечник. У больных кардиоспазмом и кардиостенозом, при которых обычно показана плановая операция под наркозом, почти всегда в пищеводе имеется жидкость. Аспирации способствует высокое внутрибрюшное и внутрижелудочное давление, например, при увеличении объема живота, обусловленном острым расширением желудка, различными видами острой кишечной непроходимости, острым панкреатитом, перитонитом и др.
К регургитации и аспирации нередко предрасполагают декомпенсированный стеноз привратника язвенной и раковой этиологии, а также атония кардиального сфинктера у больных, страдающих гастроэзофагеальной рефлюксной болезнью. Если не проведена своевременная декомпрессия желудка и пищевода, во время наркоза, чаще – в период интубации происходит массивная аспирация желудочного содержимого, что нередко сопровождается остановкой сердца.
Клиника и диагностика
Аспирационный синдром характеризуется острой дыхательной недостаточностью, обусловленной ларингоспазмом или бронхоспазмом, астматическим состоянием. Эти нарушения обычно возникают вслед за аспирацией или спустя 1–6 ч, реже – 12 ч, что проявляется возрастающим беспокойством больного, экспираторной одышкой, тахикардией и цианозом. В большинстве случаев аспирационный синдром сопровождается падением артериального давления (АД) и другими нарушениями деятельности сердечно-сосудистой системы вплоть до остановки сердца. Отмечается стойкость цианоза, который не устраняется даже при подаче кислорода 100% концентрации. При аускультации легких выслушиваются свистящие, а в нижних отделах – крепитирующие хрипы. При прогрессировании острой дыхательной недостаточности Ра02 снижается до 35–45 мм рт. ст., возрастает легочное сосудистое сопротивление.
При дальнейшем прогрессировании аспирационного синдрома его клинические проявления со стороны легких соответствуют клинике острого респираторного дистресс-синдрома. При рентгенологическом исследовании у больных с аспирационным синдромом удается выявить так называемое «шоковое легкое»: участки пониженной воздушности, диффузное затемнение легочной ткани.
При аспирации желудочного содержимого, имеющего умеренную кислую или нейтральную реакцию, синдром может протекать относительно благоприятно. При небольшой по объему аспирации она чаще ограничивается повреждением нижней доли правого легкого, проявляясь клинической картиной правосторонней нижнедолевой пневмонии.
Неотложная помощь
При развитии аспирационного синдрома следует быстро опустить головной конец кровати или операционного стола для оттока желудочного содержимого из ротоглотки, после чего очистить ее полость электроотсосом или тампоном, фиксированным с помощью корнцанга. Необходимо срочно произвести интубацию трахеи после предварительного осмотра голосовой щели с помощью ларингоскопа. Приподнимание головы и туловища в этот момент может предотвратить возможность повторной аспирации. После введения в трахею интубационной трубки следует надуть ее манжетку, что позволяет предотвратить повторное попадание в дыхательные пути желудочного содержимого.
Уже в первые минуты аспирации больной нуждается в сердечно-сосудистой реанимации. После интубации необходимо быстро удалить аспират из дыхательных путей с помощью катетера, введенного через интубационную трубку и соединенного с электроотсосом. Необходимо стремиться к полному удалению аспирата из трахеи и бронхов. Срочное отсасывание аспирата из трахеи и бронхов, а также откашливание его больным намного эффективнее восстанавливают проходимость дыхательных путей, чем бронхоскопия, произведенная через 30–60 мин после аспирации. После экстренных лечебных мероприятий необходимо приступить к выполнению бронхиального лаважа, для чего используют небольшое количество 0,9% раствора хлорида натрия (10–15 мл) с добавлением натрия бикарбоната (1 ампула – 44 ммоль). Общее количество раствора доводят до 30–50 мл. Использование большого объема жидкости для лаважа противопоказано, так как это может привести к оттеснению аспирата в более глубокие отделы дыхательных путей вплоть до альвеол [2].
В начальный период бронхолегочной аспирации обычно используют чистый кислород. При отсутствии эффективного спонтанного дыхания проводят искусственную вентиляцию легких, поддерживая насыщение артериальной крови кислородом на уровне 90–95%. С целью устранения шока и бронхоспазма внутривенно вводят гидрокортизон в дозе 150–200 мг или дексаметазон в дозе 4–8 мг, 10 мл 2,4% раствора эуфиллина. Показано также введение антигистаминных препаратов (30 мг димедрола или 20–40 мг супрастина), при низком АД – введение допамина в дозе 10–15 мкг/кг•мин. Выполняют инфузии изотонических электролитных и коллоидных растворов, свежезамороженной плазмы (200–400 мл), 20% раствора глюкозы (10–20 мл) и гепарина в дозе 5000– 10 000 ЕД [4].
При стабилизации состояния больного целесообразна санационная бронхоскопия с помощью фиброскопа, введенного через интубационную трубку. Бронхоскопия должна завершаться промыванием бронхов раствором глюкокортикоидов (гидрокортизон, дексаметазон) и введением антибиотиков (гентамицин и др.). Необходимо сохранение кашлевого толчка, при котором опорожнение бронхов более эффективно. Обязательно выполняют вибромассаж грудной клетки, мониторинг деятельности дыхательной и сердечно-сосудистой систем. После восстановления адекватного спонтанного дыхания осуществляют экстубацию.
Профилактика
Перед экстренной операцией медсестра и врач опорожняют желудок больного с помощью зонда. Больных не следует поить и кормить перед любым оперативным вмешательством, особенно когда требуется наркоз. Обязательно проводят премедикацию, предусматривающую введение атропина в дозе 0,1 мг на 10 кг массы тела.
При выполнении интубации необходимо соблюдение следующих мер: придание голове возвышенного положения, надавливание на перстневидный хрящ, что обеспечивает сдавление пищевода между трахеей и позвоночником (прием Селлика). Этот прием применяют сразу после преоксигенации кислородом 100% концентрации до введения мышечных релаксантов и заканчивают после интубации трахеи и раздувания манжетки. Если в момент интубации отмечается поступление желудочного содержимого в глотку, надо ввести интубационную трубку в пищевод и раздуть манжетку [4]. После санации ротоглотки необходимо выполнить интубацию трахеи запасной интубационной трубкой. Затем необходимо ввести в желудок зонд. Следует помнить, что аспирация небольшого количества желудочного содержимого может оказаться незамеченной, поэтому во время наркоза и после его окончания тщательно высушивают легкие. После экстубации с помощью ларингоскопа осматривают ротоглотку и при необходимости производят санацию. Экстубацию выполняют только при восстановлении мышечного тонуса и сознания.
К сожалению, во всех руководствах по анестезиологии и реанимации первостепенная роль при аспирационном синдроме отводится интубации трахеи. Однако клиническая практика показывает, что в данной критической ситуации выполнить интубацию трахеи в некоторых случаях по разным причинам не удается. Поэтому этот метод не может рассматриваться в качестве метода «последней надежды». К тому же аспирационный синдром может развиться у лиц, которым наркоз не требуется (состояние опьянения, затекание в ротоглотку содержимого пищевода при кардиоспазме, остром расширении желудка и др.). Такие больные при невозможности интубации трахеи или неудачной интубации нуждаются в выполнении крикотиреоидотомии (коникотомии).
Изложенное позволяет заключить, что:
Внебольничная пневмония
МКБ 10: J13-J18
Год утверждения клинических рекомендаций (частота пересмотра):
2018 (пересмотр каждые 3 года)
Российское респираторное общество
Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии
Научным советом Министерства Здравоохранения Российской Федерации
Ключевые слова:
Список сокращений
АБП — антибактериальный препарат
АМП — антимикробный препарат
АПС — активированный протеин С
БА — бронхиальная астма
БАЛ — бронхо-альвеолярный лаваж
БЛРС — бета-лактамазы расширенного спектра
ВП — внебольничная пневмония
ГКСФ — гранулоцит-колониестимулирующий фактор
ГМКСФ — гранулоцит-макрофаг-колониестимулирующий фактор
ИВЛ — искусственная вентиляция легких
ДН — дыхательная недостаточность
ИТФ — ингибитор тканевого фактора
КТ — компьютерная томография
ЛС — лекарственное средство
МПК — минимальная подавляющая концентрация
НВЛ — неинвазивная вентиляция легких
НЛР — нежелательная лекарственная реакция
ОРДСВ — острый респираторный дистресс-синдром взрослых
ОРИТ — отделение реанимации и интенсивной терапии
ПОН — полиорганная недостаточность
ПРП — пенициллинорезистентный S. pneumoniae
ПЧП — пенициллин-чувствительный S. pneumoniae
ПЦР — полимеразная цепная реакция
РКИ — рандомизированное клиническое исследование
ЛПУ — лечебно-профилактическое учреждение
СВР — системная воспалительная реакция
СД — сахарный диабет
СВР — системная воспалительная реакция
СШ — септический шок
ТЭЛА — тромбоэмболия легочной артерии
УЗИ — ультразвуковое исследование
ФНО — фактор некроза опухоли
ХОБЛ — хроническая обструктивная болезнь легких
ХСН — хроническая сердечная недостаточность
ЭКМО — экстракорпоральная мембранная оксигенация
B.cepacia — Burkholderia cepacia
B.pertussis — Bordetella pertussis
C.pneumoniae — Chlamydophila pneumoniae
С.burnetii — Coxiella burnetii
C.psittaci — Chlamydophila psittaci
Candida spp. — род Candida
CLSI — Институт клинических и лабораторных стандартов США
Enterobacterales — семейство Enterobacterales
Enterococcus spp. — род Enterococcus
H.influenzae — Haemophilus influenzae
K.pneumoniae — Klebsiella pneumoniae
L.pneumophila — Legionella pneumophila
Legionella spp. — род Legionella
M.pneumoniae — Mycoplasma pneumoniae
M.catarrhalis — Moraxella catarrhalis
MRSA — метициллинорезистентный Staphylococcus aureus
MSSA — метициллин-чувствительный Staphylococcus aureus
Neisseria spp. — род Neisseria
P.aeruginosa — Pseudomonas aeruginosa
PEEP — положительное давление на выдохе
S.aureus — Staphylococcus aureus
S.pneumoniae — Streptococcus pneumoniae
Staphylococcus spp. — род Staphylococcus
1.Краткая информация
1.1.Определение
Пневмонии – группа различных по этиологии, патогенезу, морфологической характеристике острых инфекционных (преимущественно бактериальных) заболеваний, характеризующихся очаговым поражением респираторных отделов легких с обязательным наличием внутриальвеолярной экссудации []. Пневмонии четко обособлены от других очаговых воспалительных заболеваний легких неинфекционного происхождения, вызываемых физическими (лучевой пневмонит) или химическими факторами, имеющих аллергическое (эозинофильная пневмония) или сосудистое (инфаркт легкого) происхождение.
Наиболее важный с клинической точки зрения принцип предусматривает подразделение пневмонии на внебольничную (ВП) и нозокомиальную (НП). Внебольничной считают пневмонию, развившуюся вне стационара, либо диагности- рованную в первые 48 ч с момента госпитализации [].
В некоторых странах в отдельную группу выделяют пневмонии, связанные с оказанием медицинской помощи. К данной группе относят случаи развития заболевания у обитателей домов престарелых и других учреждений длительного ухода, при наличии госпитализаций по любому поводу в течение ≥ 2 суток в предшествующие 90 дней, пациентов, получавших в/в инфузионную терапию (в том числе системными антибиотиками), подвергавшихся сеансам диализа или лечению ран в домашних условиях впредшествующие 30 дней []. Предположение о том, что такие пациенты отличаются высоким риском инфицирования полирезистеными бактериальными возбудителями (ПРВ) и, соответственно, должны лечиться как лица с НП, не нашло четкого подтверждения в современных исследованиях []. В связи с этим российские эксперты на данном этапе считают нецелесообразным внедрение отдельного термина “пневмония, связанная с оказанием медицинской помощи” в клиническую практику. Лечение данной группы пациентов осуществляется в соответствии с клиническими рекомендациями по ВП, а указанные выше факторы, наряду с другими, учитываются при выборе режима антибактериальной терапии (АБТ).
ВП у пациентов с выраженной иммуносупрессией, включая лиц с ВИЧ-инфекцией, врожденными иммунодефицитами, получающих химиотерапию и/или иммунодепрес- санты, реципиентов трансплантатов донорских органов и тканей отличаются от общей популяции по этиологии, характеру течения и прогнозу и не рассматриваются в рамках настоящих рекомендаций.
1.2.Этиология и патогенез
1.2.1.Этиология
S. aureus чаще ассоциируется с развитием ВП у лиц пожилого возраста, в/в наркоманов, на фоне или после перенесенного гриппа; P. aeruginosa – с муковисцидозом, бронхоэктазами, применением системных глюкокортикостероидов (ГКС) в фармакодинамических дозах, предшествующей длительной АБТ [].
Удельный вес L. pneumophila, очевидно, является невысоким в общей популяции в РФ, однако значимость данного возбудителя существенно увеличивается при тяжелой ВП и наличии определенных факторов риска – таблица 2.
Вероятность инфицирования анаэробами может возрастать у лиц с доказанной или предполагаемой аспирацией, обусловленной эпизодами нарушения сознания при судорогах, некоторых неврологических заболеваниях (например, инсульт), дисфагии, алкоголизме [].
ВП помимо бактериальных возбудителей могут вызывать респираторные вирусы, наиболее часто вирусы гриппа, коронавирусы, риносинцитиальный вирус (РС вирус), метапневмовирус человека, бокавирус человека []. Частота выявления респираторных вирусов у пациентов с ВП носит выраженный сезонный характер и возрастает в холодное время года. Различают первичную вирусную пневмонию (развивается в результате непосредственного вирусного поражения легких) и вторичную бактериальную пневмонию, которая может сочетаться с первичным вирусным поражением легких или быть самостоятельным поздним осложнением респираторной вирусной инфекции (в первую очередь гриппа).
Вбольшинстве случаев ВП, вызываемые респираторными вирусами, характеризуются нетяжелым течением, однако у лиц пожилого и старческого возраста, при наличии сопутствующих бронхолегочных, сердечно-сосудистых заболеваний или иммунодефицита они могут ассоциироваться с развитием тяжелых, угрожающих жизни осложнений [].
У 10-30% пациентов с ВП выявляется смешанная или ко-инфекция, которая может быть вызвана ассоциацией различных бактериальных возбудителей (например, S. pneumoniae с H. influenzae или M. pneumoniae), либо их сочетанием с респираторными вирусами. По данным ряда исследований, ВП, вызванная ассоциацией возбудителей, имеет тенденцию к более тяжелому течению и худшему прогнозу [].