Артрозилен или кетопрофен что лучше
Нестероидные противовоспалительные препараты: список и цены
Нестероидные противовоспалительные препараты используются достаточно широко для подавления воспалительных процессов в организме. НПВП доступны в различных формах выпуска: таблетки, капсулы, мази. Они обладают тремя основными свойствами: жаропонижающими, противовоспалительными и болеутоляющими.
Лучший нестероидный противовоспалительный препарат может подобрать только врач, отталкиваясь от индивидуальных особенностей пациента. Самолечение в данном случае может быть чревато развитие серьезных побочных реакций или же передозировки. Предлагаем ознакомиться со списком препаратов. Рейтинг разработан на основании соотношения цена-качество, отзывов пациентов и мнения специалистов.
Как работают НПВП?
Нестероиды ингибируют агрегацию тромбоцитов. Терапевтические свойства объясняются блокадой фермента циклооксигеназы (ЦОГ-2), а также снижением синтеза простагландина. По мнению специалистов они оказывают влияние на симптомы заболевания, но не устраняют причину его возникновения. Поэтому не следует забывать о средствах, с помощью которых должны быть устранены первичные механизмы развития патологии.
Если у пациента обнаружена непереносимость НПВП, тогда они заменяются лекарствами других категорий. Часто в таких случаях применяют комбинацию противовоспалительного и болеутоляющего средства.
Как показывает практика, нецелесообразно заменять одно лекарство другим той же группы, если при приеме обнаруживается недостаточный терапевтический эффект. Удвоение дозы может привести только к клинически незначительному увеличению воздействия.
Классификация НПВП
Нестероидные противовоспалительные средства классифицируются в зависимости от того, являются ли они селективными для ЦОГ-2 или нет. Таким образом, с одной стороны, есть неселективные НПВП, а с другой – селективные ЦОГ-2.
Нестероидные противовоспалительные препараты для наружного применения в лечении скелетно-мышечных болевых синдромов
Боль в спине, шее, суставах является ведущим симптомом при заболеваниях опорно-двигательного аппарата и относится к наиболее частой причине обращения к врачу. В лечении скелетно-мышечных болей наиболее часто применяются нестероидные противовоспалительные
Боль в спине, шее, суставах является ведущим симптомом при заболеваниях опорно-двигательного аппарата и относится к наиболее частой причине обращения к врачу. В лечении скелетно-мышечных болей наиболее часто применяются нестероидные противовоспалительные средства (НПВС). В практической деятельности врача, занимающегося лечением болевых синдромов, определяющим критерием выбора лекарственного средства является его анальгетическая эффективность, индивидуальная непереносимость, вероятность возникновения осложнений или побочных эффектов [1, 3].
Применение НПВС внутрь или парентерально часто сопровождается у пациентов развитием побочных эффектов и осложнений, в первую очередь со стороны желудочно-кишечного тракта, почек, центральной нервной системы. Возможность применять лекарственные средства местно (наружно) позволяет доставлять активное вещество максимально близко к источнику болевого ощущения, не вызывая системного воздействия, что значительно уменьшает риск развития побочных эффектов и осложнений.
В настоящее время арсенал препаратов для местного применения, содержащих НПВС, при заболеваниях опорно-двигательного аппарата достаточно широк, в том числе в связи с выпуском одних и тех же препаратов разными производителями под разными (патентованными) названиями.
Все НПВС для местного применения можно разделить на следующие группы по основному действующему лекарственному веществу, входящему в состав многокомпонентных или комбинированных препаратов [2].
1. Действующее вещество — диклофенак.
2. Действующее вещество — ибупрофен.
- — Нурофен гель.
— Долгит.
— Долгит крем.
3. Действующее вещество — индометацин.
4. Действующее вещество — кетопрофен.
- — Артрозилен.
— Быструмгель.
— Кетонал.
— Кетопрофен Врамед.
— Фастум.
— Феброфид.
— Флексен.
5. Действующее вещество — нимесулид.
6. Действующее вещество — пироксикам.
Основным механизмом действия препаратов монокомпонентного состава с действующим веществом диклофенаком является неселективное ингибирование активности циклооксигеназы (ЦОГ): ЦОГ-1 и ЦОГ-2, что приводит к нарушению метаболизма арахидоновой кислоты и подавлению синтеза простагландинов в очаге воспаления. При наружном применении данных препаратов возникают ослабление болей в месте их нанесения, уменьшение отечности и увеличение объема движений в пораженных суставах.
Показаниями для применения служат болевой синдром при воспалительных и дегенеративных заболеваниях суставов и позвоночника, ревматических поражениях мягких тканей, посттравматическом болевом синдроме, невралгии.
Побочные действия могут наблюдаться в виде местных кожных проявлений, при длительном применении препаратов возможны резорбтивное действие и развитие системных реакций (крапивница, бронхоспазм, ангионевротический отек).
Противопоказаниями для применения являются язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения, нарушение кроветворения, нарушение целостности кожных покровов, беременность, лактация, возраст до 6 лет, повышенная чувствительность к диклофенаку.
При сочетании диклофенака с ментолом в препарате Диклофенакол также дополнительно оказывается местное раздражающее и слабовыраженное анальгезирующее действие.
При сочетании диклофенака с метилсалицилатом, ментолом, льняным маслом в препарате Диклоран плюс противовоспалительное и анальгетическое действие диклофенака усиливается вторым препаратом из группы НПВС — метилсалицилатом, а также a-линоленовой кислотой, входящей в состав льняного масла; ментол оказывает местное раздражающее и слабовыраженное анальгезирующее действие.
Основным фармакологическим эффектом препаратов с действующим веществом ибупрофеном является местное анальгезирующее и противовоспалительное действие, механизм которого связан с торможением синтеза простагландинов за счет неселективного блокирования фермента ЦОГ.
Показаниями к применению являются миалгии, боли в спине, артриты, повреждения и растяжения связок, спортивные травмы, невралгии.
Побочные эффекты чаше всего отмечаются в виде небольшого покраснения кожи, жжения или покалывания. Системные реакции в виде аллергических реакций и бронхоспазма возникают чрезвычайно редко.
Противопоказанием к применению являются «аспириновая» астма, возраст до 12 лет, повышенная чувствительность к компонентам препарата. С осторожностью препарат применяют при сопутствующих заболеваниях печени и почек, желудочно-кишечного тракта, крапивнице, рините, беременности и лактации.
Основным фармакологическим эффектом препаратов монокомпонентного состава с действующим веществом индометацином является местное выраженное противовоспалительное и анальгетическое действие за счет неселективного блокирования фермента ЦОГ и подавления синтеза простагландинов. Показаниями к применению служат болевой синдром и местные воспалительные реакции при ревматоидных заболеваниях, острых скелетно-мышечных болях, подагре, невралгиях.
Побочные эффекты наблюдаются в виде местных кожных реакций (гиперемия, шелушение, крапивница и др.). Системные реакции в виде диспепсии, тошноты, головокружения, атаксии возможны при длительном, более 10 дней, применении либо при нанесении препарата на большой участок кожных покровов.
Препарат противопоказан при желудочно-кишечных заболеваниях, заболеваниях почек, центральной нервной системы, инфекционных заболеваниях, в период беременности и лактации, не назначается детям.
При сочетании индометацина с троксерутином в препарате Индовазин дополнительно оказывается местное противоотечное и ангиопротекторное действие.
Основным механизмом действия препаратов с действующим веществом кетопрофеном (производное пропионовой кислоты) является подавление активности ЦОГ-1 и ЦОГ-2, регулирующей синтез простагландинов. Противовоспалительная и анальгезирующая активность кетопрофена сходна с таковой индометацина и выше активности ибупрофена в 20 раз. Кетопрофен обладает антибрадикининовой активностью, стабилизирует лизосомальные мембраны, вызывает значительное торможение активности нейтрофилов у больных с ревматоидным артритом, подавляет агрегацию тромбоцитов.
Показаниями к применению являются острые и хронические воспалительные и дегенеративно-дистрофические заболевания опорно-двигательного аппарата, травмы.
Побочные действия наблюдаются в виде гиперемии кожи в месте нанесения препарата, фотосенсибилизации пурпуры. При длительном применении редко возможны системные реакции: боли в животе, рвота, астения, транзиторная дизурия.
Противопоказан к применению у пациентов с экземой, инфицированными ранами, у детей до 12 лет, при индивидуальной непереносимости препарата. С осторожностью возможно применение при беременности и в период лактации.
Основным механизмом действия препаратов с действующим веществом нимесулидом является селективное подавление активности ЦОГ-2, регулирующей синтез простагландинов. Нимесулид обратимо ингибирует синтез простагландина Е2 как в области воспаления, так и в восходящих путях ноцицептивой системы. Подавляет агрегацию тромбоцитов, высвобождение гистамина и фактора некроза опухоли a, обладает антиоксидантной активностью. Препарат хорошо переносится при длительной терапии. При местном применении вызывает уменьшение или исчезновение болей в месте нанесения геля, уменьшает отечность, утреннюю скованность суставов, способствует увеличению объема движений.
Показаниями к применению служат воспалительные заболевания с болевым синдромом умеренной интенсивности: заболевания опорно-двигательного аппарата, в том числе артриты, остеохондроз, остеоартроз, артралгии, миалгии, бурситы, травматические повреждения.
Побочные эффекты связаны с местными реакциями при нанесении геля — зуд, крапивница, шелушение, преходящее изменение цвета кожи — и не требуют отмены препарата.
Противопоказания: дерматозы, инфекции кожи в области применения геля, возраст до 2 лет, повышенная чувствительность к препарату, беременность и лактация.
Основным механизмом действия препаратов с действующим веществом пироксикамом является подавление синтеза простагландинов вследствие неселективного ингибирования ферментов ЦОГ-1 и ЦОГ-2. Применение препарата уменьшает отек, воспаление, мышечную и суставную боль, не вызывает сухости кожи.
Показаниями к применению является болевой синдром при спортивных травмах, анкилозирующем спондилоартрите, остеоартрозе, плечелопаточном периартрозе, тендините.
Побочные эффекты связаны с местными реакциями и проявляются в виде покраснения и шелушения, местного зуда, крапивницы.
Противопоказаниями для применения служат почечная недостаточность, возраст до 14 лет, беременность, индивидуальная непереносимость препарата.
Литература
Л. Е. Корнилова, кандидат медицинских наук
Е. Л. Соков, доктор медицинских наук, профессор
РУДН, Клиника лечения боли, ГКБ № 64, Москва
Лекарства для лечения артроза коленных суставов
Артроз – дегенеративно-дистрофическое заболевание суставов, при котором возникают изменения в суставном хряще. Позднее присоединяются и костные деформации. Основные проявления артроза – боль, ограничение движений в пораженных суставах.
О причинах, симптомах и диагностике артроза можно посмотреть здесь или здесь.
В терапии при артроза коленных суставов лекарственные препараты занимают ведущее место.
Исходя из тактических принципов, все лекарства, применяемые при артрозе коленных суставов можно разделить на несколько групп:
Лекарственные препараты, применяемые при обострении артроза
Обострение проявляет себя усилением болей в коленных суставах. Характерны «стартовые» боли (возникают в коленных суставах при первых шагах после длительного положения лежа или сидя), а также боли при ходьбе. При выраженном воспалении может развиться синовит.
НПВП (нестероидные противовоспалительные препараты)
Механизм их действия связан с угнетением циклоксигеназы (ЦОГ), которая является ферментом, отвечающим за выработку медиаторов воспаления. ЦОГ бывает двух типов ЦОГ-1 и ЦОГ-2. Подавление ЦОГ-1 вызывает большинство побочных эффектов НПВП – например, поражение слизистой желудка. Подавление ЦОГ-2 в большей степени влияет на воспаление.
НПВП первого поколения являются неселективными, т.е. подавляют как ЦОГ-1, так и ЦОГ-2. За счет этого у них несколько больше выражен противовоспалительный и обезболивающий эффекты, но и выше риск развития побочных эффектов, например, желудочно-кишечного кровотечения.
К наиболее распространенным неселективным ингибиторам ЦОГ относятся
Кетопрофен (кетонал, артрозилен)
НПВП второго поколения селективно подавляют ЦОГ-2, за счет чего вероятность развития побочных эффектов уменьшается, но и немного меньше выражено противовоспалительное и обезболивающее действие. К ним относят:
Нимесулид (нимесил, найз)
Мелксикам (мовалис, артрозан)
НПВП применяют как внутримышечно (при выраженных болях и воспалении), так и в таблетках и в виде мазей.
Глюкокортикостероиды
При недостаточной эффективности НПВП, а также при синовите, рекомендуют внутрисуставное введение кортикостероидных препаратов –
Их введение быстро снимает боли и воспалительные явления, но с учетом того, что данные лекарства являются гормонами, их применение ограничено. Считается, что допустимо не более 5 внутрисуставных инъекций с интервалом между ними не менее 5 дней, после чего необходимо воздержание от их введения несколько месяцев во избежание развития побочных гормональных эффектов и недостаточности коры надпочечников.
Лекарственные препараты, применяемые в период ремиссии
Хондропротекторы
Их действие в основном направлено на предотвращение дальнейшего разрушения суставного хряща (хондроитин), нормализацию свойств суставной жидкости (глюкозамин). Наиболее часто применяют
Протезы суставной жидкости
Сравнительно недавно начали применять т.н. протезы суставной жидкости – препараты гиалуроната натрия, которые вводят внутрисуставно. Эти лекарства обладают свойствами суставной жидкости и при введении в сустав уменьшают трение суставных поверхностей и оказывают благотворное влияние на суставной хрящ. Эти препараты хорошо зарекомендовали себя и набирают все большую популярность. Наиболее часто применяют:
Подробнее о протезах синовиальной жидкости в лечении артроза коленных суставов можно посмотреть здесь.
Другие препараты, применяемые для лечения артроза коленных суставов –
пиаскледин, траумель, артродарин широко не применяются в связи с малой или не доказанной эффективностью.
Лечение артроза коленных суставов должно быть комплексным, и включать в себя как прием лекарственных средств, так и другие методы – ортопедический режим, ЛФК, физиотерапия, массаж, коррекция веса и др.
Эффективность комбинации различных лекарственных форм кетопрофена лизиновой соли (Артрозилен) у пациентов с выраженной мышечно-скелетной болью в реальной клинической практике. Результаты исследования КУЛОН
Опубликовано в журнале «Клиническая фармакология и терапия», 2013.-N 4.-С.23-30
Каратеев А.Е., Журавлева М.В., Алексеев В.В., Денисов Л.Н., Цапина Т.Н.
Острая боль, возникающая на фоне патологии опорно-двигательного аппарата – одна из наиболее частых причин потери трудоспособности и обращения за медицинской помощью. Поэтому эффективное обезболивание традиционно считается одной из первоочередных задач, стоящих перед лечащим врачом. Значение анальгетической терапии определяется не только очевидной необходимостью наиболее полно и быстро устранить симптом, вызывающий основные страдания больного. В последние годы врачи пришли к четкому пониманию того факта, что купирование острой боли играет ключевую роль в предупреждении развития хронической боли. Это принципиально важно, ведь хроническая мышечно-скелетная боль рассматривается сегодня как самостоятельный клинический синдром, который не только выступает в числе главных причин инвалидизации, но и является фактором, существенно влияющим на продолжительность жизни пациентов 1.
Одним из главных инструментов контроля мышечно-скелетной боли являются нестероидные противовоспалительные препараты (НПВП). Эти лекарства сочетают в себе обезболивающий, противовоспалительный и жаропонижающий потенциал, что обеспечивает их преимущество в сравнении с другими анальгетиками – парацетамолом и опиоидами, в частности, трамадолом [4,5].
Хотя НПВП достаточно эффективны, тем не менее, существенное улучшение при их использовании отмечается далеко не у всех пациентов. Нюансы фармакокинетики конкретных препаратов, индивидуальные особенности клинической ситуации и пациента (включая такие «тонкие материи» как генетические особенности метаболизма ксенобиотиков и психологический настой в момент назначения терапии) могут существенно повлиять на достижение терапевтического успеха. Поэтому перед практикующим врачом часто оказывается проблема выбора препарата для дебюта анальгетической терапии, а также подбора альтернативного средства в том случае, если после первого назначения не удалось достичь существенного улучшения состояния.
Одним из представителей группы НПВП, который отлично подходит в качестве средства «первой линии» для купирования острой боли, а также для замены оказавшегося малоэффективным препарата, может считаться кетопрофен. Этот препарат используется в мире с 1971 г. и завоевал доверие врачей как эффективный и удобный анальгетик, обладающий хорошей переносимостью. Он прошел серьезную проверку в ходе большого числа клинических испытаний при самых разных заболеваниях, сопровождающихся выраженной болью – начиная от анестезиологической практики и заканчивая системными ревматическими заболеваниями [6,7].
Особый интерес представляет «улучшенный» кетопрофен – кетопрофен лизиновая соль (КЛС), которая обладает высокой биодоступностью и устойчивой фармакодинамикой. Эффективная концентрация препарата к плазме крови достигается уже через 15-20 мин. после перорального приема и 10-15 минут – после в/м введения. Малый размер и липофильность молекулы КЛС определяет хорошую абсорбцию при накожном нанесении – поэтому он является весьма удачной субстанцией для производства локальных форм НПВП.
Для оценки терапевтических возможностей Артрозилена ® было проведено исследование КУЛОН.
Цель исследования: оценить результаты комбинированного и/или последовательного применения различных лекарственных форм КЛС у больных с выраженной мышечно-скелетной болью в реальной клинической практике.
План исследования: Участниками исследования были врачи различных специальностей, проводящие поликлинический прием и занимающиеся в своей повседневной практике лечением пациентов, испытывающих мышечно-скелетные боли: терапевты, неврологи, травматологи, ревматологи. Всего приняло участие 115 врачей из городов: Москвы, Санкт-Петербурга, Воронежа, Липецка, Саратова, Тольятти, Белгорода, Курска, Новосибирска, Красноярска, Волгограда, Ростова, Краснодара, Н.Новгород.
Им предлагалось в течение календарного месяца проводить ретроспективный анализ результатов 2-х недельного применения КЛС у больных, обратившихся с жалобами на выраженные боли (не менее 40 мм по 100 мм визуальной аналоговой шкале – ВАШ), связанные с острой или хронической патологией опорно-двигательного аппарата. Необходимость назначения КЛС, а также лекарственная форма препарата (или их комбинация) определялись лечащим врачом по собственному усмотрению, в зависимости от клинической ситуации. Все данные вносились в специально разработанные анонимные исследовательские карты, которые затем были собраны организаторами исследования для проведения соответствующего анализа.
Патология, ставшая причиной обращения к врачам, представлена в таблице 1. Как видно, подавляющее большинство пациентов страдали от боли в различных отдела спины («дорсопатия») – всего 1601 пациент (47.8%). Учитывая неоправданное разнообразие диагнозов, используемых в нашей стране для обозначения этой патологии (основным из которых оставался архаичный «остеохондроз»), в таблице приведена лишь основная локализация боли – соответственно, в шейном, грудном или поясничном отделе. Детальное же рассмотрение формулировок, используемых российскими врачами для обозначения «дорсопатий» представляет большой интерес и будет представлено нами в отдельной работе.
Таблица 1.
Заболевания и патологические состояния, ставшие причиной обращения к врачу в поликлинике
| Группы | Число больных | Основные заболевания | Число больных |
|---|---|---|---|
| Воспалительные ревматологические заболевания | 203 | Ревматоидный артрит | 125 |
| Подагра | 46 | ||
| Серонегативные спондилоартриты, включая АС и ПсА | 22 | ||
| Реактивный артрит | 10 | ||
| Остеоартроз | 1008 | Полиартроз | 348 |
| Коксартроз | 140 | ||
| Гонартроз | 401 | ||
| Плечевые суставы | 18 | ||
| Кисти | 24 | ||
| Локти | 8 | ||
| Стопы | 24 | ||
| Не уточнен | 45 | ||
| Дорсопатия | 1601 | Боль в шейном отделе позвоночника | 381 |
| Боль в грудном отделе позвоночника | 66 | ||
| Боль в поясничном отделе позвоночника | 1254 | ||
| Не уточнен | 214 | ||
| Острые травмы | Переломы костей, ушибы, растяжения связок и мышц | 101 | |
| Воспаление околосуставных мягких тканей ревматической природы | 156 | Плечелопаточный периартрит | 73 |
| Тендиниты | 22 | ||
| Бурсит локтя | 5 | ||
| Субакромиальный бурсит | 5 | ||
| Эпикондилит | 23 | ||
| «Периартрит» | 22 | ||
| Пяточная шпора | 3 | ||
| Трохантерит | 3 | ||
| Неуточненный моно- олигоартрит | 53 | ||
| Редкие диагнозы | 13 | Метастазы рака (1), ОРЛ (1),СКВ (1), узловатая эритема (3), трофические язвы (4), карбункул шеи (1), «хроническая головная боль» (1), фибромиалгия (1) | |
На втором месте по частоте обращения находится остеоартроз – 1008 пациентов (30.1%), причем наибольшее число из них составили лица, страдающие поражением крупных суставов нижних конечностей – гонартрозом и коксартрозом, а также поражением суставов нескольких групп («полиартроз»).
Третью по численности группу пациентов представляли лица, страдающие воспалительными ревматическими заболеваниями (n=203), преимущественно ревматоидным артритом и подагрой.
Меньшее число составили пациенты с острым воспалением околосуставных мягких тканей ревматической природы (тендиниты, тендовагиниты, бурситы и др.), n=156, острыми травмами (переломы, ушибы мягких тканей, повреждение связок и др.), n=101 и моно/ олигоартритом неясной этиологии (n=53).
Более трети пациентов (n=1380, 41.2%) на момент назначения артрозилена уже получали другие НПВП, в основном нимесулид (n=412, 35.3%), диклофенак (n=304, 22.0%) и мелоксикам (n=248, 17.9%). Однако это практически не влияло на выраженность боли и ухудшения самочувствия. Так, при первом визите, у больных, принимавших НПВП, оценка этих параметров составила 67.5 + 17.6 и 59.1 + 21.8 мм ВАШ соответственно, у не принимавших – 65.6 + 16.2 и 57.4 + 20.9 мм ВАШ соответственно.
Кроме НПВП, 555 (16,6%) больных на момент начала исследования принимали различные миорелаксанты: 274 (49.4%) толперизон, 208 (37.5%) тизанидин и 73 (13.8%) баклофен. Другие лекарства, применяемые включенными в исследования больными, представлены в таблице 2.
Таблица 2.
Сопутствующая терапия, получаемая больными
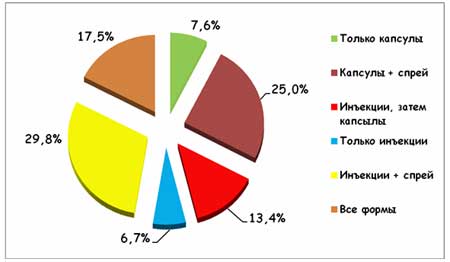
Все больные, включенные в исследование, получали КЛС в виде различных лекарственных форм и их комбинации (рисунок 1).
Рисунок 1. Различные лекарственные формы и их сочетания,
использованные в исследовании КУЛОН
В работе были использованы Артрозилен ® 320 мг (капсулы с контролируемым высвобождением КЛС), р-р для парентерального введения 80 мг/мл и 15% спрей КЛС. Как видно, большинство предпочитали назначать инъекционные препараты в сочетании с другими лекарственными формами или использовать последовательное назначение – в первые 3 дня в/м инъекции, а затем переходить на капсулы. Кроме этого, у небольшой части больных (в основном при острых травмах и остром воспалении мягких тканей ревматической природы) врачи посчитали возможным ограничиться лишь кратковременным курсом парентерального введения артрозилена.
Электронная база данных была создана с помощью программы Microsoft Office Excel 2007, статистический анализ проводился с помощью программы SPSS 10.0. Средние значения даны в формате M + m. Для оценки статистической значимости отличия количественных параметров был использован t-тест Стъюдента, качественные параметры сравнивались с помощью показателя χ 2 или точного теста Фишера.
Результаты:
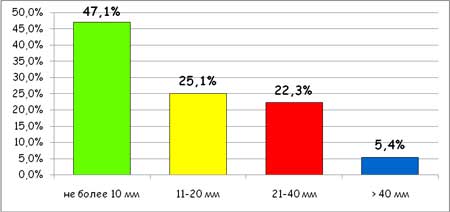
Большинство больных после проведенного курса лечения отметило существенное улучшение состояния. Так, средняя оценка боли в конце исследования составили 15.3 + 13.6 мм, а нарушения самочувствия 12.2 + 12.4, т.е. их значение уменьшилось на 76.9% и 79.0% по сравнению с исходным уровнем (р 40 мм). Как видно, почти у половины больных было достигнуто практически полное купирование боли. Лишь у 27.7% больных после использования артрозилена сохранялись выраженные болевые ощущения.
Рисунок 2. Выраженность боли в конце периода наблюдения
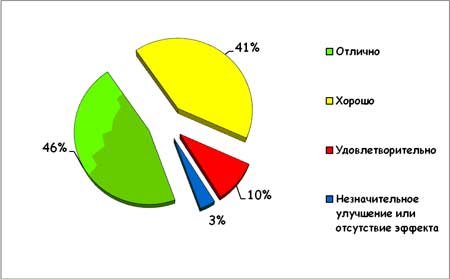
Эффективность КЛС подтверждается субъективной оценкой удовлетворенности проведенным лечением (рис.3). Подавляющее большинство больных (суммарно 87%) оценили результат применения артрозилена как «отличный» или «хороший».
Рисунок 3. Субъективная оценка эффективности лечения
Проведенный анализ показал, что эффективность артрозилена различалась при использовании разных форм препарата и их комбинаций (таблица 3). Так, наилучшим образом «работала» схема, при которой дебютом лечения было в/м введение препарата, а затем, после получения быстрого облегчения боли, прием препарата продолжался перорально. В этой подгруппе большинство больных оценили эффективность артрозилена как «отличную».
Таблица 3. Зависимость эффективности от формы препарата
| Форма препарата | Оценка эффекта терапии (% от общего числа больных) | |||
|---|---|---|---|---|
| «Отличный» | «Хороший» | «Умеренный» | «Низкий или отсутствует» | |
| Только капсулы | 39.2 | 40.5 | 16.8 | 3.5 |
| Капсулы и спрей | 39.1 | 47.5 | 11.0 | 2.4 |
| Инъекции и капсулы | 60.4* | 26.4 | 10.1 | 3.1 |
| Только инъекции | 45.1 | 40.4 | 11.2 | 3.3 |
| Инъекции и спрей | 48.1 | 41.7 | 4.1 | 6.1 |
| Все формы | 44.1 | 43.5 | 11.3 | 1.1 |
Следует отметить, что при парентеральном введении лекарства – как в качестве монотерапии, так и в комбинации с другими формами, достигалось большее облегчение боли, чем при его пероральном применении.
Отдельно был рассмотрен вопрос эффективности артрозилена при различных нозологических формах (таб. 4). Наилучшее действие препарата было отмечено у пациентов с острым подагрическим артритом: 67.4% посчитали его «отличным», и – что особенно важно, никто из этих больных не сообщил об отсутствии значимого облегчения боли.
Таблица 4.
Зависимость эффективности от нозологической формы
Артрозилен оказался весьма эффективным и у пациентов с дорсопатиями и воспалительным поражением мягких тканей воспалительной природы: отличный эффект был отмечен более чем у половины участников исследования (от 51.0% до 56.0%, в зависимости от локализации патологии). Существенно хуже результат терапии оказался у пациентов, страдающих ОА крупных суставов. Хотя при гонартрозе и коксартрозе большинство больных отметили значительное улучшение (суммарно 76.3% и 69.2%), тем не менее «отличную» оценку новому препарату дали лишь чуть более четверти больных, т.е. в 2 раза меньше, чем при дорсопатиях (р Безопасность:
Артрозилен хорошо переносился и достаточно редко вызывал серьезные побочные эффекты. В основном проблемы касались ЖКТ. Так, у 1 больной развилась язва желудка, а у двух пациентов, у которых появились гастралгии, при проведении эндоскопического исследования были выявлены множественные эрозии слизистой желудка. У 15 пациентов возникла выраженная диспепсия (гастралгии, тошнота, тяжесть в эпигастральной области), что потребовало прерывания лечения и назначения противоязвенных средств.
Кардиоваскулярные осложнения практикующие врачи не зафиксировали – лишь у одного пациента на фоне приема артрозилена отмечена стойкая артериальная гипертензия, потребовавшая коррекции антигипертензивной терапии, которую тот ранее получал.
У двух больных были отмечены постинъекционные осложнения (выраженная боль в месте введения препарата), а еще у двух возникла кожная аллергическая реакция.
Такими образом, серьезные побочные эффекты, которые привели к прерыванию лечения, могли представлять угрозу здоровью больных или потребовали назначения специальных средств для их коррекции, были зафиксированы у 23 больных (0.75%).
Анализ показал, что появление осложнений существенно влияло на субъективную оценку эффективности лечения. Так, при возникновении диспепсии существенно меньше больных определяли результат использования артрозилена как «отличный», в сравнении с теми, кто не испытывал каких-либо осложнений: 25.8% и 49.1% соответственно (р Обсуждение результатов
Подавляющее большинство больных – 87%, отметили значительное улучшение, дав препарату отличную или хорошую оценку. Важно отметить, что субъективный критерий оценки эффективности точно совпадал с более объективным критерием снижения боли (по ВАШ). Так, значительное уменьшение ее выраженности (Артрозилен оказался особенно эффективен у лиц, испытывающих острую боль – при подагрическом артрите, воспалительном поражении мягких тканей и дорсалгии. Хороший, однако не столь яркий результат был получен и у пациентов, испытывающих болевые ощущения в течение длительного времени: в частности, у больных ОА крупных суставов.
Следует отметить, что практика парентерального назначения НПВП в качестве дебюта анальгетической терапии при использовании артрозилена себя полностью оправдала: оценка эффективности была достоверно выше у пациентов, которым этот препарат вначале назначался в/м, а затем осуществлялся переход на пероральный прием и/или использование локальных форм.
Конечно, результаты открытых неконтролируемых исследований, к которым относится КУЛОН, всегда следует трактовать с определенной осторожностью. Очевидно, что надежды, связываемые с появлением нового препарата, в значительной степени влияют на оценку результатов его применения, как со стороны пациентов, так и лечащих врачей – особенно в том случае, когда предыдущие методы терапии не обеспечили существенного улучшения состояния. Именно поэтому эффективность лекарств, оцениваемых в ходе открытых клинических испытаний, всегда существенно выше, чем при проведении «правильных», с точки зрения доказательной медицины исследований – рандомизированных, слепых, плацебо-контролируемых (РКИ).
Продолжительность лечения определялась лечащими врачами, исходя из особенностей клинической ситуации, и в среднем составила 2 недели. В конце периода наблюдения, 85% пациентов определили терапевтическое действие ацеклофенака как «очень хорошее», а 32% сообщили о полном прекращении боли. При этом число пациентов, которые на момент включения в исследование оценивали боль как «тяжелую» сократилось с 41% до 2% [9].
Однако мы можем предположить, что высокая эффективность КЛС, показанная в нашем исследовании, определяется в большей степени не субъективными, а объективными факторами. Кетопрофен заслуженно считается одним из наиболее удачных по своим терапевтическим свойствам представителей группы НПВП [7,11]. Именно поэтому он так долго и успешно используется в мировой клинической практике; более того, в последние годы отмечается отчетливый рост его популярности в европейских странах. Например, по данным Venegoni M. и сотр., на фоне небольшого, но явного снижения общих продаж основных «рецептурных» НПВП в Италии, продажа кетопрофена за период с 2006 по 2009 гг. выросла на 93%, т.е. почти в 2 раза [12].
По мнению ряда экспертов, высокий анальгетический потенциал кетопрофена может быть связан с липофильностью и относительно небольшими размерами его молекулы [7,13]. Благодаря этим параметрам он может легко проникать в воспаленную ткань, что обеспечивает высокую концентрацию действующего вещества непосредственно в зоне поражения [7,13].
Большое значение придается также способности кетопрофена к диффузии через гематоэнцефалический барьер и воздействию на центральные структуры ноцицептивной системы [14,15]. Экспериментальные данные четко подтверждают равновесие между концентрацией несвязанной фракции кетопрофена в плазме крови, и его концентрацией в цереброспинальной жидкости [16].
Необходимо заметить, что центральное действие этого препарата может определяться не только характерным для всех НПВП механизмом (блокада ЦОГ-2). В частности, обсуждается стимулирующее воздействие S-стереоизомера кетопрофена на серотонинэргическую антиноцицептивную систему [17].
Важным подтверждением преимуществ кетопрофена стала работа итальянских ученых Atzeni F. и сотр., представленная на ежегодном конгрессе американской коллегии ревматологов (ACR), прошедшем в ноябре 2012 в г. Чикаго. Исследователи провели мета-анализ РКИ, в которых сравнивалось обезболивающее действие кетопрофена 50-200 мг/сутки с ибупрофеном 600-1800 мг/сутки или диклофенаком 75-100 мг/сутки. В мировой литературе им удалось найти 13 исследований такого рода: 8 сравнений с ибупрофеном и 5 с диклофенаком, суммарно 898 участников. Препараты назначались больным РА, ОА, АС, БНЧС и страдающим болью в плече.
Кетопрофен, согласно полученным результатам, в 9 из 13 РКИ оказался достоверно более эффективным, чем препараты сравнения. При этом вероятность достижения значительного улучшения при назначении кетопрофена в среднем была почти в 2 раза выше (p=0.000) [18].
В качестве примера эффективности кетопрофена можно привести работу Jokhio I. и сотр. Они сравнили лечебное действие этого препарата и диклофенака у 180 пациентов, испытывающих выраженные боли (среднее значение по ВАШ
70 мм) вследствие травмы или острой патологии мягких тканей ревматической природы. При этом – как и в нашем исследовании, была использована т.н. «ступенчатая» терапия: в первый день НПВП применяли в виде в/м инъекций, а затем они назначались перорально. Соответственно, половина пациентов получили две инъекции кетопрофена по 100 мг, а затем принимали этот препарат по 100 мг 2 раза в день. Другая половина получила две инъекции диклофенака по 75 м, а в дальнейшем 3 раза в день принимали его по 50 мг 3 раза в день внутрь. Курс лечения составил 2 недели. К концу периода наблюдения, в группе кетопрофена у 75% пациентов интенсивность боли уменьшилась до умеренной или слабой, а у 25% она полностью купировалась. В группе диклофенака результаты лечения был скромнее: сильная боль сохранялась у 3%, умеренная или слабая у 87%, а отсутствие боли было зафиксировано лишь у 10% пациентов. При этом 72% больных, получавших кетопрофен, оценили его переносимость как «хорошую или отличную»; такую оценку диклофенаку дали лишь 50% пациентов [19].
Необходимо отметить, что кетопрофен, помимо выраженного обезболивающего действия, обладает хорошим противовоспалительным потенциалом. Этот факт подтверждается успешным опытом применения кетопрофена при анкилозирующем спондилоартрит и подагре – заболеваниях, когда эффективное подавление воспаления имеет принципиальное значение для достижения клинического успеха [20,21].
Результаты Altman R. подтверждают наши данные, показавшие наилучшее действие Артрозилена у больных с подагрическим артритом: более высокую частоту достижения субъективно отличного эффекта, в сравнении с пациентами, страдающими другими нозологическими формами.
Следует учесть, что артрозилен представляет собой кетопрофен в виде лизиновой соли, т.е. препарат, обладающий, по мнению европейских экспертов, более высоким терапевтическим потенциалом, чем «обычный» кетопрофен [7]. При этом лекарственные формы артрозилена содержат максимальное количество активной субстанции. Так, в капсуле артрозилена находится 320 мг КЛС – высшая суточная доза этого препарата, которую обеспечивает однократный прием. Аналогично, в/м введение артрозилена (2 мл содержат 160 мг КЛС) 2 раза в день также обеспечивает поступление в организм пациента максимальной суточной дозы действующего вещества. Учитывая хорошую фармакодинамику КЛС, применение артрозилена с первого же дня формируют устойчиво высокую концентрацию активного вещества в плазме крови, что должно обеспечить наилучший клинический эффект.
Максимально высокую концентрацию субстанции имеют и локальные формы артрозилена, в особенности спрей (15%). Как было отмечено выше, кетопрофен очень удобно использовать в качестве действующей субстанции для препаратов, которые наносятся на кожу. Его липофильная, небольшая молекула достаточно легко проникает через кожные покровы, обеспечивая терапевтическую концентрацию действующего вещества в пораженных областях человеческого тела. По мнению экспертов, фармакологические особенности кетопрофена, используемого в качестве действующего начала местных обезболивающих препаратов, определяет его преимущество в сравнении с другими НПВП [7, 22-24].
Четким доказательством эффективности локальной формы кетопрофена стало масштабное британское рандомизированное исследование Patel R. и сотр. В ходе этой работы 1575 больных с острой травмой мягких тканей (вывихи, ушибы, перенапряжение мышц и др.) три раза в день на протяжении 5 дней получали гелевые формы кетопрофена (2.5%), диклофенака (1%) или пироксикама (0.5%). Согласно полученным результатам, кетопрофен достоверно превосходил препараты контроля: так, «значительное улучшение» отметили 38%, 30% и 26% больных соответственно. Аналогично, большая часть больных, получавших кетопрофен, отметила «охлаждающий» эффект геля, в сравнении с контрольными средствами: 71%, 60% и 49% соответственно.
Переносимость геля кетопрофена, по мнению авторов исследования, оказалась «превосходной» [25].
Другим примером успешного использования локальной формы кетопрофена является работа Esparza F. и отр. В ходе этого исследования 223 пациента, перенесших острую спортивную травму, в течение 7-ми дней локально (в области повреждения мягких тканей) наносили ТДС с кетопрофеном или гель диклофенака. Через неделю число пациентов, у которых боль отсутствовала, у получавших кетопрофен составило 64%, в то время как в контрольной группе – только 46% (р=0.001) [26]. Учитывая благоприятный опыт использования локальных форм «обычного» кетопрофена, следует думать, что включение в схему терапии острой мышечно-скелетной боли высокодозных локальных форм КЛС должно существенно повышать суммарную эффективность анальгезии.
Полученные нами данные показывали хорошую переносимость артрозилена. Хотя нежелательные явления отмечались более чем у 10% участников исследования, в подавляющем большинстве случаев это была слабая или умеренно выраженная диспепсия, не потребовавшая отмены терапии или назначения дополнительных лекарств. Серьезные осложнения возникали очень редко – менее чем у 1% больных.
В России также был проведен ряд клинических исследований кетопрофена, которые подтвердили хорошую репутацию этого препарата: он демонстрировал хороший терапевтический потенциал и низкую частоту нежелательных явлений 33.
Это исследование показало одно из наиболее ценных преимуществ кетопрофена, которому в последнее время придается столь больше значение – низкий риск осложнений со стороны сердечно-сосудистой системы (ССС).
Похожие данные были получены Solomon M. и сотр., которые сравнили использование различных НПВП у 4425 больных, у которых развился инфаркт миокарда, и 17700 лиц без данного осложнения, основываясь на данных медицинской системы штата Нью-Джерси, США. Согласно полученным данным, разницы по приему кетопрофена в этих группах не было: его получали 53 больных, развивших кардиоваскулярное осложнение (1.2%) и 190 лиц, составлявших контроль (1.1%). Таким образом, использование кетопрофена, по данным этого исследования не повышало риск
Разумеется, хорошая переносимость КЛС не отменяет необходимости учета факторов риска осложнений со стороны ЖКТ и сердечно-сосудистой системы перед его назначением, и проведения в случае необходимости всего комплекса соответствующих профилактических мероприятий.
Таким образом, мы можем заключить, что артрозилен является эффективным средством для купирования острой и контроля хронической боли. Разнообразные лекарственные формы этого препарата позволяют выбирать индивидуальную схему анальгетической терапии для конкретного пациента и конкретной клинической ситуации. Он показал хорошую переносимость, редко вызывая серьезные осложнения со стороны ЖКТ и сердечно-сосудистой системы. Такое сочетание клинических достоинств может позволить считать артрозилен препаратом выбора для существенной части больных, страдающих патологией опорно-двигательного аппарата.
Литература:
1. Боль (практическое руководство для врачей). Под ред. Яхно Н.Н., Кукушкина М.Л., Москва, Издательство РАМН, 2012, 512 c.
2. Lee Y. Effect and treatment of chronic pain in inflammatory arthritis. Curr Rheumatol Rep. 2013; 15(1): 300.
3. Яхно Н.Н., Кукушкин М.Л. Хроническая боль: медико-биологические и социально-экономические аспекты. Вестник Российской Академии медицинских наук, 2012, N 9, 54-58
4. van de Laar M. Pergolizzi J., Mellinghoff H., et al. Pain Treatment in Arthritis-Related Pain: Beyond NSAIDs. The Open Rheumatology Journal, 2012, 6, 320-330
5. Каратеев А.Е., Яхно Н.Н., Лазебник Л.Б. и сотр. Применение нестероидных противовоспалительных препаратов. Клинические рекомендации. Москва, «ИМА-ПРЕСС», 2009, 167 с.
6. Veys E. 20 years’ experience with ketoprofen. Scand J Rheumatol Suppl. 1991; 90: Suppl 1-44.
7. Sarzi-Puttini P., Atzeni F., Lanata L., et al. Pain and ketoprofen: what is its role in clinical practice? Reumatismo. 2010, 62(3): 172-188.
8. Zeidler H., Kaltwasser J., Leonard J., et al. Prescription and tolerability of meloxicam in day-to-day practice. Postmarketing observational cohort study of 13.307 patients in Germany. J. Clin. Rheumatol., 2002, 8, 305-315
9. Lemmel E., Leeb B., De Bast J., Aslanidis S. Patient and physician satisfaction with aceclofenac: results of the European Observational Cohort Study (experience with aceclofenac for inflammatory pain in daily practice). Curr Med Res Opin. 2002, 18(3), 146-153.
10. Le Loet X. Safety of ketoprofen in the elderly: a prospective study on 20,000 patients. Scand J Rheumatol Suppl. 1989; 83: 21-27.
11. Barden J., Derry S., McQuay H., Moore R. Single dose oral ketoprofen and dexketoprofen for acute postoperative pain in adults. Cochrane Database Syst Rev. 2009 Oct 7;(4):CD007355.
12. Venegoni M., Da Cas R., Menniti-Ippolito F., Traversa G. Effects of the European restrictive actions concerning nimesulide prescription: a simulation study on hepatopathies and gastrointestinal bleedings in Italy. Ann Ist Super Sanita. 2010;46(2):153-157.
13. Kokki H. Ketoprofen pharmacokinetics, efficacy, and tolerability in pediatric patients. Paediatr Drugs. 2010; 12(5):313-329.
14. Netter P., Lapicque F., Bannwarth B., et al. Diffusion of intramuscular ketoprofen into the cerebrospinal fluid. Eur J Clin Pharmacol. 1985; 29(3): 319-321.
15. Mannila A., Kokki H., Heikkinen M., et al. Cerebrospinal fluid distribution of ketoprofen after intravenous administration in young children. Clin Pharmacokinet. 2006; 45(7): 737-743.
16. Mannila A., Kokki H., Heikkinen M., et al. Cerebrospinal fluid distribution of ketoprofen after intravenous administration in young children. Clin Pharmacokinet. 2006; 45(7): 737-743.
17. Díaz-Reval M., Ventura-Martínez R., Déciga-Campos M., et al. Evidence for a central mechanism of action of S-(+)-ketoprofen. Eur J Pharmacol. 2004; 483(2-3): 241-248.
18. Atzeni F., Sarzi-Puttini P., Lanata L., Bagnasco M. Efficacy of Ketoprofen Vs Ibuprofen and Diclofenac: A Systematic Review of the Literature and Meta-Analysis. Arthritis Rheum., 2012, 64 (10), 114-115
19. Jokhio I., Siddiqui K., Waraich T., et al. Study of efficacy and tolerance of ketoprofen and diclofenac sodium in the treatment of acute rheumatic and traumatic conditions. J Pak Med Assoc 1998; 48: 373-376.
20. Dougados M., Béhier J., Jolchine I., et al. Efficacy of celecoxib, a cyclooxygenase 2-specific inhibitor, in the treatment of ankylosing spondylitis: a six-week controlled study with comparison against placebo and against a conventional nonsteroidal antiinflammatory drug. Arthritis Rheum. 2001, 44(1):180-185.
21. Altman R., Honig S., Levin J., Lightfoot R. Ketoprofen versus indomethacin in patients with acute gouty arthritis: a multicenter, double blind comparative study. J Rheumatol. 1988, 15(9):1422-1426.
22. Kawai S., Uchida E., Kondo M., et al. Efficacy and safety of ketoprofen patch in patients with rheumatoid arthritis: a randomized, double-blind, placebo-controlled study. J Clin Pharmacol. 2010, 50(10):1171-1179.
23. Coaccioli S. Ketoprofen 2.5% gel: a clinical overview. Eur Rev Med Pharmacol Sci. 2011; 15(8): 943-949.
24. Komatsu T., Sakurada T. Comparison of the efficacy and skin permeability of topical NSAID preparations used in Europe. Eur J Pharm Sci. 2012; 47(5): 890-895.
25. Patel R., Leswell P. Comparison of ketoprofen, piroxicam, and diclofenac gels in the treatment of acute soft-tissue injury in general practice. General Practice Study Group. Clin Ther. 1996; 18(3): 497-507.
26. Esparza F., Cobián C., Jiménez J., et al. Topical ketoprofen TDS patch versus diclofenac gel: efficacy and tolerability in benign sport related soft-tissue injuries. Br J Sports Med. 2007, 41(3): 134-139.
27. Castellsague J., Riera-Guardia N., Calingaert B., et al. Individual NSAIDs and upper gastrointestinal complications: a systematic review and meta-analysis of observational studies (the SOS project).Drug Saf. 2012; 35(12): 1127-1146.
28. Helin-Salmivaara A., Saarelainen S., Gronroos J., et al. Risk of upper gastrointestinal events with the use of various NSAIDs: A case-control study in a general population. Scan J Gastroenterol, 2007; 42: 923-932
29. Schattenkirchner M. Long-term safety of ketoprofen in an elderly population of arthritic patients. Scand J Rheumatol Suppl. 1991; 91: 27-36.
30. Чичасова Н.В., Иммаметдинова Г.Р., Каратеев А.Е., и соавт. Эффективность и безопасность кетопрофена (кетонал) при ревматоидном артрите (клинико-эндоскопическое исследование). Научно-практическая ревматология 2001; 1; 47-52
31. Осипова Н.А., Петрова В.В., Ермолаев П.М., Береснев В.А. Нестероидные противовоспалительные препараты в лечении послеоперационной боли у онкологических больных. Фарматека, 2006, №6 (121)
32. Шмидт Е.И., Коган К.М., Белозерова И.В. Оценка эффективности кетонала ретард у больных остеоартрозом. Научно-практическая ревматология 2000; 2:77-79.
33. Новиков Г.А., Вайсман М.А., Прохоров Б.М. и др. Кетонал в лечении болевого синдрома у пациентов с распространенными формами злокачественных новообразований. Паллиативная медицина и реабилитация, №3, 2002, 48–51.
34. Лазебник Л.Б., Дроздов В.Н., Коломиец Е.В. Сравнительная эффективность и безопасность применения кетопрофена, лорноксикама, нимесулида и целекоксиба у больных остеоартрозом. РМЖ, 2004, 12 (14), 844-847.
35. Singh G., Mithal A., Triadafilopoulos G. Both selective COX-2 inhibitors and non-selective NSAIDs increase the risk of acute myocardial infarction in patients with arthritis; selectivity is with patients, not the drug. Ann Rheum Dis 2005, 64 (suppl 3), 85
36. Solomon D., Glynn R., Levin R., Avorn J. Nonsteroidal Anti-inflammatory Drug Use and Acute Myocardial Infarction. Arch Intern Med. 2002; 162: 1099-1104
37. Helin-Salmivaara A., Virtanen A., Vesalainen R., et al. NSAID use and the risk of hospatalisation for first myocardial infarction in the general population: a national case-control study from Finland. Eur Heart J 2006; 27: 1657-1663