Арава или метотрексат что токсичнее
Клинико-фармакологическая экспертиза лефлуномида при ревматоидном артрите
Полный текст:
Аннотация
Ключевые слова
##article.ConflictsofInterestDisclosure##:
##article.articleInfo##:
Депонировано (дата): 28.06.2018
##article.reviewInfo##:
##article.editorialComment##:
Для цитирования:
Хохлов А.Л., Лилеева Е.Г., Жилина А.Н. Клинико-фармакологическая экспертиза лефлуномида при ревматоидном артрите. Качественная Клиническая Практика. 2008;(3):75-84.
Несмотря на существенные успехи в разработке стратегии лечения ревматоидного артрита (РА), фармакотерапия этого заболевания продолжает оставаться одним из наиболее сложных разделов медицины [1, 2]. В силу большой распространенности, высокой частоты поражения лиц трудоспособного возраста, значительного процента инвалидизации больных РА представляет серьезную медико-социальную проблему. Исследования патогенеза воспалительного процесса при РА за последние 20 лет позволяют считать, что Т–клетки играют ключевую роль, как в развитии, так и в дальнейшем прогрессировании заболевания [1]. Именно с активацией Т–клеток связывают включение в воспалительный процесс некоторых других типов клеток (В–клеток, дендритных клеток, фибробластоподобных синовиоцитов), необходимых для поддержания воспаления и прогрессирования деструкции суставов, стимуляцию плазмоцитов, макрофагов, фибробластов к продукции провоспалительных цитокинов (ФНО, ИЛ–1) [2].
Данный взгляд на патогенез РА предполагает, что основные усилия фармакотерапии должны быть направлены на применение регуляторов пролиферации активированных Т–клеток. Базисным средством, эффективно влияющим на эти клетки и подавляющим воспаление, является лефлуномид (Арава) (Sanofi-Aventis, Франция), в отличие от других препаратов специально разрабатывавшийся для лечения РА, который (в том числе тяжелые его формы) является основным показанием для лефлуномида. Лефлуномид снижает синтез пиримидиновых нуклеотидов тормозит пролиферацию активированных Т–клеток, [3] изменяет Т–клеточный аутоиммунный ответ, подавляет синтез провоспалительных цитокинов, уменьшает Т–зависимый синтез антител В–клетками [4]. Под влиянием лефлуномида происходит угнетение фактора транскрипции NF–k. [5] (фактор, необходимый для активации генов, кодирующих синтез провоспалительных медиаторов). Высокая клиническая эффективность и базисные свойства лефлуномида в отношении РА подтверждены рядом мультицентровых рандомизированных контролируемых испытаний, сравнивавших лефлуномид с плацебо, метотрексатом и сульфасалазином [6].
По химической структуре лефлуномид – низкомолекулярное (270 Д) производное изоксазола. В желудочно-кишечном тракте и в плазме лефлуномид быстро превращается в активный метаболит малононитриламид, на 99,3% связывающийся с белками плазмы. Период полувыведения препарата составляет около двух недель. Выводится лефлуномид через почки и желудочно-кишечный тракт практически в равных соотношениях [7]. Сравнительная характеристика препаратов представлена в табл. 1.
Таблица 1. Сравнительная характеристика базисных антиревматических препаратов
Параметры
Лефлуномид
Метотрексат
Сульфасалазин
Циклоспорин
Инфликсимаб
Мах концентрация в плазме
Абсорбция при приеме внутрь (%)
Почки и ЖКТ в равных соотношениях
30% с мочой и 50% выделяется с каловыми массами
Преимущественно с желчью и 6% выводится с мочой
100 мг 1 раз в сутки на 3 дня; затем 20 мг в день
3 мг/кг в/в, повторно через 2 и 6 нед, далее каждые 8 нед.
Быстрота развития эффекта
Лефлуномид назначается сначала в дозе 100 мг 1 раз в сутки на 3 дня; затем переходят на поддерживающую терапию в дозе 20 мг в день. Лишь при достижении стойкой ремиссии или развитии побочных эффектов возможно уменьшение поддерживающей дозы до 10 мг. Многочисленные международные исследования свидетельствуют о высокой эффективности лефлуномида, стойком снижении выраженности деструкции костной ткани при РА, подтвержденном рентгенологически в течение 1-го и 2-го года, достоверно более выраженном по сравнению с метотрексатом [7]. Кроме того, лефлуномид может с успехом использоваться в комбинации с метотрексатом у пациентов, у которых монотерапия метотрексатом недостаточно эффективна.
Фармакоэкономическая экспертиза Аравы проводилась нами с использованием общепринятых методов экономического анализа. Применялись анализы «затраты-эффективность» и «затраты-полезность (утилитарность)», экономическое моделирование («марковские модели»).
Экономическая оценка эффективности определенной медицинской программы или метода лечения в целом представляет собой соотношение затрат на их проведение и их эффективности, включая в себя прямые и непрямые «затраты». Прямые медицинские затраты включают стоимость лекарственных средств, стационарного лечения, визитов к врачам, затраты на коррекцию побочных эффектов и лечение сопутствующих заболеваний [8]. Более сложным представляется учет непрямых затрат, таких как потеря дохода для семьи, снижение производительности для общества, ухудшение качества жизни (КЖ) и др. Было выполнено математическое моделирование лечения больных с РА с учетом применения различных методов лечения (рис. 1).
Рис. 1. Древо решений: прямые медицинские затраты на 1200 человек
Проводилось сравнение следующих схем терапии:
Арава 100 мг 1-3 раза в день, далее 20 мг 1 раз в день в сравнении с:
При проведении фармакоэкономического анализа был использован критерий «затраты-эффективность» (СЕА – cost effectiveness analysis) по формуле СЕА=С/Еf, где «СЕА» показывает стоимость лекарственных средств на единицу эффективности, «С» – средняя стоимость лечения (стоимость медикаментов). «Ef» – эффективность лечения (вероятность достижения положительного результата по выбранному критерию эффективности). Учитывались цены на лекарственные препараты (март 2008 г.). Базовые затраты на единицу эффективности представлены в табл. 2.
Таблица 2. Оценка базисной терапии ревматоидного артрита в течение 1 года по параметру «затраты-эффективность» с учетом количества ремиссий и обострений (на 1200 чел.)
Название препарата
Сред.
стоимость,
руб. («Протек»)
Стоимость терапии в год
Обострение
Ремиссия
Эффект на
200 человек
(n, ремиссия)
Арава (лефлуномид) 20 мг №30+100 мг №3
Метотрексат 10 мг №501
Ремикейд 100 мг – 1фл
Сульфасалазин 500 мг №502
Сандиммун неорал 100 мг – №50
Примечание.
* – исследования US301, MN301, MN302 (Practical Management of Rheumatoid Arthritis Patients Treated with Leflunomide)
** – исследования US301, MN302
*** – исследования MN301, COBRA
1 – для больных, чувствительных к метотрексату (резистентность 40%)
2 – для больных, чувствительных к сульфасалазину (резистентность 36%)
Таблица 3. Сравнительная оценка побочных эффектов при проведении базисной терапии ревматоидного артрита в течение 1 года
Название препарата
Средняя стоимость, руб.
Стоимость
в год, руб.
Побочные эффекты
Без побочных эффектов
Арава (лефлуномид) 20 мг №30 +100 мг №3
Метотрексат 10 мг №501
Ремикейд 100 мг – 1фл
Сульфасалазин 500 мг №502
Сандиммун неорал 100 мг – №50
Примечание.
* – без отмены препарата.
** – с отменой препарата и переходом на другие препараты
1 – для больных, чувствительных к метотрексату (резистентность 40%)
2 – для больных, чувствительных к сульфасалазину (резистентность 36%)
Более низкие, в сравнении с лефлуномидом, показатели затрат на монотерапию сульфасалазином действительны только для 64% больных, поскольку первичная резистентность к этому препарату встречается в 36% случаев [9]. Следовательно, на каждую сотню больных будет не менее 36 человек, исходно не чувствительных к препарату. Для выявления клинической резистентности требуется, как минимум, три месяца терапии сульфасалазином с последующим переходом на комбинированную терапию, что заметно увеличивает расходы и свидетельствует в пользу экономичности стартовой терапии лефлуномидом. Также низкие показатели исходной чувствительности демонстрирует метотрексат, уровень индуцированной резистентности к которому составляет не менее 40% [10]. Лефлуномид имеет только один достоверно установленный механизм резистентности – изменение целевых энзимов (повышение активности или экспрессия дигидро-оротат-дегидрогеназы). Сульфасалазин обладает, как минимум, уже двумя механизмами – увеличением эффлюкса и повышение метаболизма до 5-аминосалициловой кислоты и сульфапиридина, неактивных при РА.
Больше всех механизмов резистентности имеет метотрексат. Среди главных:
С учетом вышеприведенных данных, модификация расчетов, отражающая реальную фармакоэкономическую составляющую применения лефлуномида, метотрексата и сульфасалазина, выглядит следующим образом. Допуски моделирования ситуации:
Сценарий 1: лечение лефлуномидом или метотрексатом с последующим переходом в последнем случае на комбинацию с инфликсимабом (рис. 2).
Сценарий 2: лечение лефлуномидом или метотрексатом с последующим переходом в последнем случае на комбинацию с циклоспорином (рис. 3).
Сценарий 3: лечение лефлуномидом или сульфасалазином с последующим переходом в последнем случае на комбинацию с инфликсимабом (рис. 4).
Сценарий 4: лечение лефлуномидом или сульфасалазином с последующим переходом в последнем случае на комбинацию с циклоспорином (рис. 5).
Исходя из полученных данных, устанавливается так называемый дисольвированный (dissolve – растворять) коэффициент CER, усредняющий расходы на проведение разных вариантов комбинированной терапии с применением метотрексата или сульфасалазина, соответственно. Проведенные расчеты показывают, что лефлуномид имеет экономические преимущества перед проведением монотерапии метотрексатом или сульфасалазином главным образом из-за более высокой эффективности (рис. 6).
Рассчитан коэффициент «затраты-полезность (утилитарность)»: CUR=DC/Ef, где CUR – соотношение «затраты-полезность (утилитарность)», DC – прямые затраты, Ef – эффективность лечения для больных, чувствительных к метотрексату. Следует отметить, что для таких пациентов (приемлемым коэффициентом считается 0,55) метотрексат принимается эффективным, если он помогает не менее чем 55% пациентам. За единицу «полезности» («утилитарности») было принято изменение (в %) оценки пациентами по шкале SF-36 своего КЖ. Опросник SF-36 является общепринятым для оценки качества жизни при РА по показателям физического и психологического здоровья. Оцениваются следующие критерии: физическое здоровье (ФЗ), ролевое функционирование (РФ), боль (Б), общее здоровье (ОЗ), жизненная сила (ЖС), социальная активность (СА), ролевое эмоциональное функционирование (РЭ) и психологическое здоровье (ПЗ).
В случае ответа на метотрексат показатель добавленных качественных лет жизни (QALY) составляет 9,1 лет. Вместе с тем, в случае метотрексат-резистентности он снижается в среднем в 15,11 раз (!) – до 0,6 [11]
Полученные результаты по утилитарной стоимости определенным образом связаны с QALY. Поскольку непосредственные данные отсутствуют, применено допущение, что данные расходы покрывают 1 QALY в случае метотрексат-чувствительности. В случае метотрексат-резистентности показатели существенным образом изменяются. Следует подчеркнуть, что для этих больных (с метотрексат-резистетностью) Арава, как правило, сохраняет свою эффективность, а, следовательно, ее фармакоэкономические характеристики не изменяются. В то же время при метотрексат резистентности затраты вырастают пропорционально уменьшению QALY, т.е. в 15,11 раз, что отражено в табл. 4.
Таблица 4. Сравнительная CUR (руб.) для разных режимов базисной терапии ревматоидного артрита в течение 1 года (на 1200 чел.) с помощью шкалы SF-36 [56]
ВЫ можете нам позвонить:
8 (8452) 98-84-68
и
+7-967-500-8468
или
Базисная терапия системных заболеваний соединительной ткани
Главным средством в лечении аутоимунных заболеваний являются, так называемые базисные препараты. Их название произошло от того, что они воздействуют на основание болезни, ее «базис». Эти препараты вызывают ремиссию и предотвращают или замедляют разрушение суставов, но не являются противовоспалительными препаратами. В настоящее время в качестве базисной терапии используют чаще всего: цитостатики, антималярийные препараты, сульфаниламиды, пеницилламин.
1. Цитостатики.
Цитостатические препараты: метотрексат, арава, азатиоприн (имуран), циклофосфан (эндоксан), циклоспорин (сандимун, экворал), проспидин и др.
Не стоит пугаться от названия «цитостатики», зная спектр их побочных эффектов: дозы этих препаратов при лечении артритов примерно в 5-20 раз меньше используемых при лечении опухолей! Использование цитостатиков помогает, как минимум, 70-80% больных, побочные явления возможны у 15-20% пациентов и редко бывают тяжелыми. Подбор доз под контролем ревматолога сводит возможность побочных эффектов к минимуму
В течение всего периода терапии цитостатиками необходимо, с помощью лабораторных методов исследования, контролировать показатели общего анализа крови,биохимических анализов и мочи у пациента. Если же пациент легко переносит цитостатическую терапию, можно ждать улучшения самочувствия уже через 2-4 недели после начала лечения.
Арава (элафра, лефлайд, лефлюнамид) рекомендуется больным, у которых артрит протекает очень активно, и тем, кто плохо переносит метотрексат. Терапевтический эффект обычно проявляется через 4-6 недель от начала приема аравы и может нарастать в течение 4-6 месяцев.
Ремикейд действует быстрее многих других базисных препаратов.
Однако применять ремикейд надо с очень большой осторожностью. До начала лечения ремикейдом необходимо выявить и пролечить все имеющиеся у пациента инфекции. Если этого не сделать, применение ремикейда может спровоцировать сильнейшее обострение недолеченных инфекционных процессов вплоть до развития сепсиса.
Также, во время лечения ремикейдом рекомендуется применять антиаллергические препараты, чтобы предотвратить возможные аллергические реакции. Стоимость препарата высокая. Лечение проводится только в стационарных условиях
Биологические препараты это одна из новейших групп препаратов для лечения артритов. Они инактивируют специальный белок (фактор некроза опухоли (ФНО)), который играет важную роль в воспалительной процессе. Эти препараты действуют быстро и эффективно уменьшают воспаление. К ним относится ингибитор ФНО этанерцепт (энбрел), анакинра (кинерет), хумира (адалимубаб), актемра (тоцилизумаб), ритуксимаб (ритуксан, мабтера), оренция (абатацепт).
Все эти препараты были разработаны в течение последнего десятилетия, а на мировом фармацевтическом рынке начали появляться не более пяти лет назад. В связи с этим они ещё весьма дороги. Ещё одним их недостатком является то, что они могут вводиться только в инъекционной форме (подкожно или внутривенно), причем в стационарных условиях, так как процедура проводится от получаса до нескольких часов под контролем специалиста. Поэтому данные препараты пока еще не получили широкого применения. Обычно их применяют в комбинации с метотрексатом или с другим базовым препаратом.
Также необходимо знать, что биологические препараты обычно не комбинируют друг с другом из-за высокой вероятности развития побочных эффектов!
Тофацитиниб – первый пероральный ингибитор янус-киназ в лечении ревматоидного артрита. Высокоэффективный и достаточно безопасный препарат. Однако высокая стоимость препарата не дает возможности говорить о его доступности для широкого круга больных.
Другие цитостатические препараты, такие как азатиоприн (имуран), циклофосфан (эндоксан) и циклоспорин (имуспорин, консупрен, сандимун, экворал) применяются только при неэффективности остальных базисных препаратов.
2. Антималярийные препараты
Антималярийные препараты делагил и плаквенил (иммард)
3. Сульфаниламиды.
4. Пеницилламин.
Пеницилламин (купренил ) при артритах обычно назначается в тех случаях, когда терапия цитостатиками не приносит больному облегчения. При системной скеродермии явяется препаратом выбора. Применение купренила при ССД основано в первую очередь на связывании препаратом альдегидных групп коллагена, что приводит к нарушению его биосинтеза и поперечного связывания отдельных молекул
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
ММА имени И.М. Сеченова
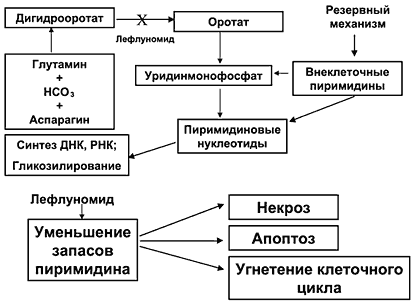
Данный взгляд на патогенез РА направил усилия ученых на создание лекарств, способных регулировать пролиферацию активированных Т–клеток. Таким новым средством базисной терапии является лефлуномид (Арава) (производства фармацевтической компании Aventis, Германия), созданный специально для лечения РА. Лефлуномид угнетает синтез пиримидина de novo, ингибируя фермент дегидрооротатдегидрогеназу, необходимую для синтеза уридинмонофосфата (рис. 1). Снижение синтеза пиримидиновых нуклеотидов приводит к торможению пролиферации активированных Т–клеток в фазе G1 клеточного цикла [3] и к изменению Т–клеточного аутоиммунного ответа; подавляется синтез провоспалительных цитокинов (интерферона g и ФНО- a ), уменьшается Т–зависимый синтез антител В–клетками [4]. Под влиянием лефлуномида происходит угнетение фактора транскрипции NF–k b [5] (фактор, необходимый для активации генов, кодирующих синтез провоспалительных медиаторов), угнетение ЦОГ–2 [6], синтеза молекул адгезии [7], повышение продукции цитокина TGF b [8], блокирующего пролиферацию Т– и В–лимфоцитов. Таким образом, угнетая образование Т–лимфоцитов, лефлуномид влияет и на продукцию антител и ряда цитокинов, и на процессы клеточной адгезии.
Рис. 1. Влияние на синтез пиримидина de novo
Клиническая эффективность и базисные свойства лефлуномида в отношении РА подтверждены рядом мультицентровых рандомизированных контролируемых испытаний, сравнивавших лефлуномид с плацебо, метотрексатом и сульфасалазином [9].
По химической структуре лефлуномид – низкомолекулярное (270 Д) производное изоксазола. В желудочно–кишечном тракте и в плазме лефлуномид быстро превращается в активный метаболит малононитриламид (А77 1726), который на 99,38% связывается с белками плазмы. Период полувыведения препарата составляет от 14 до 18 дней. Выводится лефлуномид через почки и желудочно–кишечный тракт в равных соотношениях [10,11]. Побочные эффекты при лечении лефлуномидом наблюдаются у і 5% пациентов и носят преимущественно легкий или умеренный характер [10,12]. По современным данным, использование лефлуномида не сочетается с повышенным риском возникновения злокачественных новообразований [13]. В сентябре 1998 г. лефлуномид был одобрен Министерством пищевой и лекарственной промышленности США для использования при РА; с этого времени в мире насчитывается более 200000 пациентов, принимающих препарат для лечения РА [14].
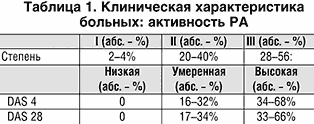
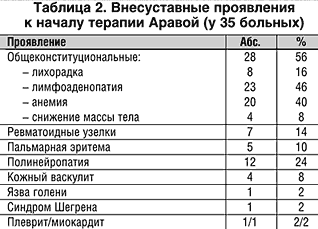
В нашей стране Арава зарегистрирована недавно и большинство врачей не имеют собственного опыта лечения больных РА. В данном сообщении мы представляем результаты лечения Аравой 50 больных РА с достоверным диагнозом по критериям ACR (1987 г.). Эта группа больных была представлена преимущественно женщинами (46 больных); преобладали пациенты серопозитивные по ревматоидному фактору (РФ) – (42 пациента); средний возраст составил 54,5±12,4 года; у 30% больных длительность РА к моменту назначения Аравы была менее 3–х лет, у 46% – 4–10 лет и у 24% – более 10 лет. У 70% больных регистрировалась III–IV рентгенологические стадии. За исключением 2 больных активность РА была II–III степени (табл. 1), а по критериям Европейской антиревматической лиги с использованием индекса активности болезни (Disease activity score – DAS) все больные были с умеренной и высокой активностью РА. Внесуставные проявления к началу терапии были у 35 больных (70%) и представлены в таблице 2.
Препарат назначался по стандартной схеме: первые 3 дня по 100 мг/сутки, далее по 20 мг/сутки. Доза временно уменьшалась у некоторых больных до 10 мг/сутки при появлении реакций непереносимости. Эффективность Аравы оценивалась по влиянию на показатели активности и прогрессирования РА. Оценивались выраженность суставного синдрома (количество болезненных и воспаленных суставов, интенсивность боли и общее состояние здоровья по визуальной аналоговой шкале, индекс Ritchie), продолжительность утренней скованности, функциональное состояние больных (тест Lee, опросник состояния здоровья – HAQ), рентгенологическое прогрессирование оценивалось по модифицированному нами методу Шарпа [20] с подсчетом количества эрозий в кистях и стопах и степени сужения суставной щели; для оценки темпа прогрессирования деструкции и сужения суставных щелей использовали коэффициент прогрессирования (Кпр.). Наличие и динамику внесуставных проявлений оценивали клинически и с использованием рентгенологических и ультразвуковых методов. Лабораторно оценивали СОЭ, СРБ, а также биохимические, клинические показатели крови и анализы мочи.
Клинико–лабораторный эффект Аравы развился у 47 из 50 больных (94%). Как видно из диаграммы, представленной на рисунке 2, все оцениваемые параметры суставного синдрома с высокой степенью достоверноcти уменьшались через 6 и еще в большей степени – через 12 месяцев лечения (p Рис. 2. Динамика средних показателей суставного синдрома
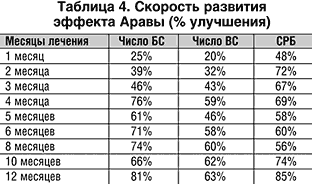
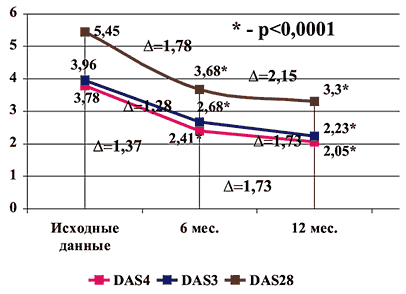
Оценивая динамику индекса активности болезни (DAS) в различной его модификации [16,17,18,19] – DAS 3, DAS 4, DAS 28 (рис. 3), можно увидеть, что Арава и через 6, и через 12 месяцев достоверно снижала активность заболевания, причем выраженность уменьшения DAS соответствовала хорошему эффекту терапии (по критериям EULAR уменьшение индекса активности на 1,2 балла и более соответствует хорошему эффекту терапии). Так что через 6 месяцев лечения Аравой клинико–лабораторная ремиссия развилась у 15% больных, а через 12 месяцев лечения – более чем у 1/4 больных (табл. 5).
Рис. 3. Динамика индекса активности через 6 и 12 месяцев лечения Аравой (DAS4, DAS3, DAS28)
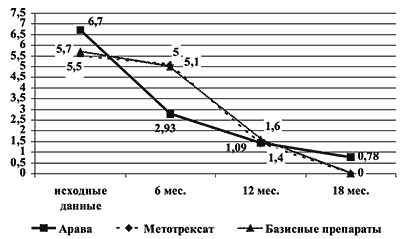
Кроме противовоспалительного эффекта, Арава обладает и влиянием на уровень РФ, уменьшает выраженность внесуставных проявлений РА и замедляет темпы прогрессирования деструктивных процессов в мелких суставах. До назначения Аравы титры РФі1:320 отмечались у 21 больного, через месяц терапии – у 13 больных, через 4 месяца – у 6 больных, а при длительности лечения 6 и более месяцев в нашей группе пациентов регистрировались только низкие титры РФ (8 больных) либо его отсутствие в сыворотке крови. Средний показатель логарифма титра сывороточного РФ снизился с 5,12 до 4,1–4,2 через 6 и 12 месяцев лечения (p Рис. 4. Увеличение числа эрозий и Кпр. за последовательные 6 мес.
Рис. 5. Изменение числа эрозий на фоне лечения Аравой, метотрексатом и др. базисными препаратами
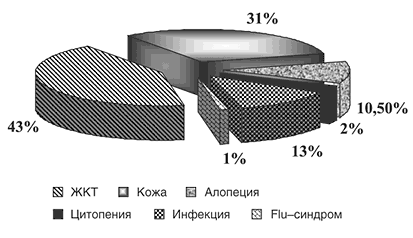
При индивидуальном анализе эффективности Аравы у больных РА мы получили ряд интересных данных. Наиболее медленно эффект Аравы появлялся у больных с давностью РА более 10 лет: за первые 6 месяцев степень уменьшения у многих больных большинства параметров активности варьировала от 20 до 30%, в отличие от больных с давностью болезни до 3–х лет, у которых степень улучшения этих же параметров составляла 60–75%. При продолжении лечения и у больных с большой длительностью РА эффективность Аравы нарастала (60–80%), но была все же несколько хуже, чем у больных с меньшей давностью болезни. Соответственно Арава была несколько менее эффективна у больных с IIIб–IV стадиями болезни (то есть при наличии остеолизов и анкилозов в мелких суставах кистей и стоп). Наиболее выраженный эффект в первое полугодие отмечался у больных с умеренной степенью активности (более 70% улучшения), а при высокой активности выраженность улучшения составляла 53%–64% от исходного уровня. К году терапии Аравой наибольший эффект отмечался при высокой степени активности РА. Арава была примерно в равной степени эффективна у больных с наличием или отсутствием РФ.
Рис. 6. Побочные эффекты Аравы
1. Арава эффективна у 94% больных.
1. Арава эффективна у 94% больных.
2. Отмечается быстрое развитие эффекта Аравы с достоверным снижением показателей суставного синдрома и лабораторных параметров активности воспаления через 1 месяц лечения, далее эффект лечения нарастает в течение 4–5 месяцев.
3. Наиболее быстро эффект Аравы развивается у больных с умеренной степенью активности, небольшой давностью РА (до 3–х лет), при отсутствии остеолизов и анкилозов в суставах.
4. Арава демонстрирует базисную активность, достоверно уменьшая титр РФ, внесуставные проявления РА (в том числе и проявления васкулита), достоверно замедляя темп рентгенологического прогрессирования, а у большинства больных с хорошим и отличным эффектом – останавливая деструктивный процесс.
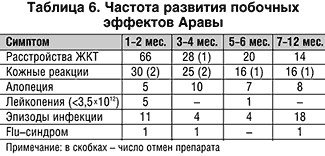
5. Арава хорошо переносится больными, отмена препарата из–за симптомов непереносимости произведена в течение 1,5 лет у 10% больных.
6. На этапах лечения при развитии нежелательных реакций возможны временное снижение дозы препарата, перерывы в лечении, что не отражается на общей эффективности терапии.
1. David E.Yocum. «T–cells and therapeutic targets in rheumatoid arthritis (RA)». Sem. in Arthritis and Rheum., 1999;1:27–35.
2. F C Brredveld, J–M Dayer «Leflunomide: mode of action in the treatment of RA». Ann. Rheum. Dis., 2000;59:841–849.
3. Chervinski HM, Coln Rg, Cheung P, et al. «The immunosupressant Leflunomide inhibits lymphocyte proliferation by inhibiting pyrimidine biosynthesis». J Pharmacol. Exp. Ther. 1995;275:1043–9.
4. Siemasko KF, Chong ASF, Williams JW et.al. «Regulation of B cell function by the immunosuppressive agent leflunomide». Transplantation 1996;61:635–42.
5. Manna SK, Aggarwal BB. «Immunosuppressive leflunomide metabolite (A77 1726) blocks TNF–dependent nuclear factor–kb activation and dene expression». J. Immunol., 1999,162,2095–2102.
6. Hamilton L., Voinovic I., Bakhle Y., et al. The anti–inflammatory drug leflunomide inhibits in vitro and in vivo the activity of COX–2 more potently than the induction of COX–1 or iNOS». Br.J.Rheumatol., 1997,120,49
7. Kraan M.C., Reece R.G., Barg F.C., et al. «Expression of ICAM–1 and MMP–12 in rheumatoid synovial tissue after treatment with leflunomide or methotrexate». Ann.Scient. Meet. Amer. Coll. Rheumatol., 1999,Boston.
8. Cao W, Kao P, Aoki Y., et al. A novel mechanism of action of the immunomodulatory drug, leflunomide: augmentation of the immunosuppressive cytokine, TGF–bl, and suppression of the immunostimulatory cytokine, IL–2». Transplant. Proc., 1996, 28, 3079–3080.
9. M. Osiri, B. Shea, V. Robinson et.al.. «Leflunomide for the treatment of RA: a systematic review and methanalysis». J. of Rheum.,2003:30:6.
10. A. Prakash and B. Jarvis. «Leflunomide – a review of its use in active RA». Drugs 1999; 58:1137–1164.
12. Cohen S, Weaver A, Schiff M, Strand V. «Two–year treatment of active RA with leflunomide compared with placebo or methotrexate». Arthr. rheum. 1999; 42: Abstract.
13. Sciff MN, Strand V, Oed C, Loew–Fridirrich I. «Leflunomide: efficacy and safety in clinical trials for the treatment of RA». Drugs today. 2000;36:383–394.
14. American College of rheumatology, E. Matteson, J. J. Cush. «Reports of leflunomide hepatotoxicity in patients with RA». 2001.
15. Felson DT, Anderson JJ, Boers M, et al. «The American College of rheumatology preliminary core set of disease activity measures for RA clinical trials». Arthritis Rheum 1993; 36:729–40.
16. Van der Heijde D.M.F.M, van`t Hof M.A, van Riel P.L.C.M, et.al. «Validity of single variables and composite indices for measuring disease activity in RA». Ann Rheum Dis. 1992;51:177–181.
17. Smolen J.S, Breedveld F.C, Eberl G,et.al. «Validity and reliability of the twenty–eight–joint count for the assessment of RA activity». Arthr. Rheum. 1995;38:38–43.
18. Prevoo M.L.L, van`t Hof M.A, Kuper H.H et.al. «Modified disease activity scores that include twenty–eight–joint counts». Arthr. Rheum. 1995;38:44–48.
19. Van Gestel AM, Prevoo MLL, van’t Hof MA et.al. «Development and validation of the European League Against Rheumatism response criteria for RA». Arthr. Rheum. 1996; 39:34–40.
20. Крель А.А., Болотин Е.В., Каневская М.З., Ращупкина З.П., Чичасова Н.В. «Объективизация проявлений РА, характеризующих его эволюцию. I. Метод количественной оценки выраженности ревматоидного артрита и темпов его прогрессирования в суставах кистей и стоп». Вопр. ревматизма 1981;3:11–15.
21. Насонов Е.Л., Чичасова Н.В., Баранов А.А. и соавт. «Клиническое значение С–реактивного белка при РА (обзор литературы и собственные данные)». Клин.Мед.1997;6:34–36.
22. Van Leeuwen MA, van Rijswijk MH, Sluter WJ et al. «Individual relationship between progression of radiological damage and the acute phase response in early RA». J Rheumatol. 1997;24:20–7.