Аэртал крем или диклофенак что лучше
Разумный выбор НПВП при сочетанной патологии: заболеваниях суставов и гипертонической болезни
Нестероидные противовоспалительные препараты (НПВП) являются одной из основных групп лекарственных средств, применяемых при лечении ревматоидного артрита (РА). Противовоспалительный и анальгетический эффект данной группы препаратов связан с подавлением а
Нестероидные противовоспалительные препараты (НПВП) являются одной из основных групп лекарственных средств, применяемых при лечении ревматоидного артрита (РА). Противовоспалительный и анальгетический эффект данной группы препаратов связан с подавлением активности циклооксигеназы-2 (ЦОГ-2) в очаге воспаления — ключевого фермента синтеза простагландинов провоспалительной активности, а подавление изоформы ЦОГ-1 приводит к нарушению физиологических реакций: в частности, к нарушению синтеза простагландинов класса Е в слизистой оболочке желудка и развитию НПВП-гастропатии.
Большинство «стандартных» НПВП способно подавлять активность обеих изоформ ЦОГ, поэтому их применение часто ограничено из-за развития побочных эффектов, в первую очередь — со стороны желудочно-кишечного тракта (ЖКТ). Субъективные симптомы со стороны ЖКТ встречаются примерно у трети больных, а в 5% случаев представляют серьезную угрозу жизни пациентов. Именно поэтому в последние годы особо пристальное внимание привлекает проблема безопасного применения НПВП. Полагают, что препараты более селективные в отношении ЦОГ-2 реже вызывают развитие НПВП-гастропатии. Изучение механизмов действия НПВП послужило толчком к созданию новых препаратов, обладающих всеми положительными свойствами стандартных НПВП, но менее токсичных, — это специфические ингибиторы ЦОГ-2 [3, 4, 13].
В последние годы особую актуальность приобрела проблема взаимодействия НПВП и гипотензивных препаратов, а также связи между применением НПВП и развитием гипертонической болезни (ГБ). Неселективные НПВП могут привести к повышению АД (преимущественно диастолического) не только у больных артериальной гипертензией (АГ), но и у лиц с нормальным АД за счет ингибиции системного и локального, внутрипочечного синтеза простагландинов. Известно, что постоянный прием НПВП вызывает у пациентов увеличение АД в среднем на 5,0 мм рт. ст. Характерным свойством НПВП является также взаимодействие с гипотензивными препаратами, в основе гипотензивного действия которых лежат преимущественно простагландин-зависимые механизмы. Назначение НПВП пациентам, получающим по поводу АГ β-адреноблокаторы, ингибиторы АПФ и диуретики, приводит к снижению гипотензивного эффекта [8, 9].
Нимесулид был разработан еще в 1985 г. и является одним из первых НПВП, при изучении которого продемонстрирована более высокая селективность в отношении ЦОГ-2 и накоплен большой клинический опыт. В многочисленных исследованиях in vitro и in vivo было показано, что нимесулид примерно в 5–20 раз более селективно ингибирует ЦОГ-2, чем ЦОГ-1. Большой интерес представляет и тот факт, что нимесулид обладает широким спектром ЦОГ-независимых эффектов, которые могут определять его противовоспалительную, анальгетическую и хондропротективную активность [1, 2, 5, 7, 11, 12].
Нимесулид хорошо переносится больными и редко вызывает развитие серьезных побочных эффектов, требующих отмены препарата. По результатам ряда исследований, частота побочных эффектов, развивающихся на фоне приема нимесулида, достоверно не отличается от плацебо или ниже, чем при приеме других НПВП. Например, по данным мета-анализа, у больных, получавших нимесулид, общая частота побочных реакций со стороны ЖКТ была значительно ниже (8,7%), чем при назначении других НПВП (16,8%). Низкую частоту поражения ЖКТ на фоне лечения нимесулидом связывают не только с ЦОГ-2-селективностью препарата, но и с антигистаминным действием, приводящим к снижению секреции соляной кислоты в желудке [6, 10, 13].
Таким образом, нимесулид относится к селективным ингибиторам ЦОГ-2, сравним по эффективности с «классическими» НПВП, но отличается более благоприятным профилем токсичности. Фармакоэкономический анализ свидетельствует о преимуществах нимесулида по сравнению с диклофенаком, в первую очередь в связи с более низкой частотой поражения ЖКТ.
Целью нашего исследования явилось изучение эффективности и переносимости найза (нимесулида) у больных РА в сравнении с ортофеном (диклофенаком).
Материалы и методы
Оба НПВП назначались случайным способом 40 больным с момента первого установления диагноза РА, согласно критериям Американской коллегии ревматологов. Найз применялся в виде таблеток по 100 мг дважды в день, ортофен — в виде таблеток по 25 мг в суточной дозе 150 мг. Одновременно всем больным проводилась базисная терапия, преимущественно метотрексатом или сульфасалазином. Эффективность и переносимость НПВП оценивались через 3 нед. от начала лечения, т. е. в те сроки, когда эффект базисных препаратов еще не имел клинической значимости.
В I группе из 20 пациентов, получавших найз, было 14 женщин и 6 мужчин, средний возраст пациентов составил 55,1 года, длительность суставного синдрома к моменту установления диагноза — от 3 до 14 мес., в среднем — 7,25 мес. Во II группе из 20 больных, получавших ортофен, было 18 женщин и 2 мужчин, средний возраст больных — 42,75 года, длительность суставного синдрома — от 2 до 14 мес., в среднем — 5,65 мес. Клиническая характеристика обеих групп представлена в таблице 1.
Результаты лечения оценивались по динамике показателей суставного синдрома (суставной индекс Ричи (СИ), счет болезненных суставов (СБС), счет припухших суставов (СПС), продолжительность утренней скованности (мин), выраженность боли по визуально-аналоговой шкале (ВАШ)) и на основании общей оценки эффективности лечения, по мнению врача и больного. Кроме того, у всех больных оценивалась динамика АД на фоне лечения НПВП.
Результаты
В I группе на фоне лечения найзом в суточной дозе 200 мг за 3 нед. лечения достигнута достоверная динамика показателей суставного синдрома. При этом эффективность терапии оценена 17 пациентами (85%) как хорошая и 3 (15%) — как удовлетворительная. По мнению врача, в 16 случаях (80%) наблюдалась хорошая эффективность препарата, в 4 случаях (20%) — удовлетворительная (рис. 1). Переносимость найза у 85% была хорошей, только у 2 больных (10%) отмечались изжога и гастралгии, у 1 больного (5%) — чувство тяжести в эпигастральной области. Однако при фиброгастроскопии у этих пациентов не выявлено эрозивного повреждения слизистой оболочки желудка. В группе больных, принимавших найз, не потребовалось отмены препарата ни у одного больного.
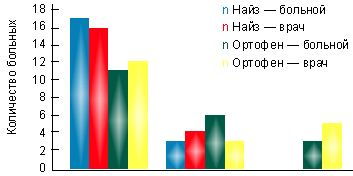 |
| Рисунок. Оценка эффективности препаратов на основании мнения больного и врача |
Во II группе на фоне терапии ортофеном в суточной дозе 150 мг через 3 нед. также отмечена существенная динамика показателей суставного синдрома. Однако оценка эффективности терапии показала, что только 11 пациентов (55%) оценили эффективность препарата как хорошую, 6 (30%) — как удовлетворительную и трое больных (15%) признали ее неудовлетворительной. По мнению лечащего врача, достаточная эффективность ортофена, соответствующая градации «хорошая», отмечалась в 12 случаях (60%), удовлетворительная — в 3 (15%) и неудовлетворительная — в 5 (25%) случаях (рис.).
Переносимость препарата ортофен была хуже, чем у найза: у 9 пациентов (45%) отмечались симптоматические побочные эффекты, причем у 3 больных (15%) потребовалась отмена препарата через 2 нед. от начала лечения в связи с выявленным при ФГДС эрозивным поражением слизистой оболочки антрального отдела желудка. В целом из побочных эффектов чаще отмечались изжога — у 7 (35%) пациентов, гастралгии — у 8 (40%), тошнота — у 4 (20%) и диарея — у 2 (10%) больных.
Особый интерес представляет влияние исследуемых НПВП на уровень АД, так как из 40 больных у 15 имелась сопутствующая ГБ, по поводу которой проводилась гипотензивная терапия. Динамика уровня АД в обеих группах на фоне лечения найзом и ортофеном представлена в таблице 2. Следует отметить, что терапия найзом не требовала усиления проводимой гипотензивной терапии (β-блокаторами, ингибиторами АПФ, диуретиками) и не вызывала повышения АД у ранее нормотензивных пациентов. В то же время лечение ортофеном потребовало коррекции доз гипотензивных препаратов у 4 (66,7%) из 6 больных ГБ и вызвало повышение АД у 5 (25%) женщин в постменопаузе с исходно высоконормальным АД. Данный эффект неселективного НПВП — ортофена — следует считать предсказуемым, особенно с учетом характера проводимой гипотензивной терапии. Все больные ГБ получали в разных комбинациях β-адреноблокаторы, ингибиторы АПФ и диуретики; при этом ни одному пациенту не был назначен дигидропиридиновый антагонист Са — амлодипин, который является препаратом выбора для лечения АГ в условиях терапии НПВП.
Таким образом, результаты открытого клинического исследования показали, что препарат найз у больных РА проявляет выраженную противовоспалительную активность, превосходящую диклофенак. При этом найз характеризуется хорошей переносимостью, малым числом симптоматических побочных эффектов и превосходит с этой точки зрения наиболее широко применяемый в клинической практике ортофен. Дополнительным преимуществом препарата найз можно считать менее выраженное влияние на уровень АД. При назначении найза не требовалось увеличения дозы гипотензивных препаратов. С учетом высокой распространенности эссенциальной гипертензии в популяции, взаимодействие НПВП с наиболее часто используемыми гипотензивными средствами представляется актуальной проблемой. Ревматические заболевания, требующие постоянной терапии НПВП, часто сочетаются с АГ. При этом у большинства больных ГБ коррекция АД может достигаться только благодаря комбинированной антигипертензивной терапии, а монотерапия дигидропиридиновыми антагонистами Са признается недостаточно эффективной. Следовательно, в большинстве случаев при лечении воспалительных ревматических заболеваний у лиц, страдающих ГБ, невозможно полностью нивелировать отрицательное взаимодействие «стандартных» НПВП с основными кардиологическими препаратами — β-адреноблокаторами, ингибиторами АПФ и диуретиками. В такой ситуации представляется рациональным выбор для проведения противовоспалительной терапии специфических ингибиторов ЦОГ-2, представителем которых является найз.
Литература
И. М. Марусенко, кандидат медицинских наук
Н. Н. Везикова, кандидат медицинских наук, доцент
В. К. Игнатьев, доктор медицинских наук, профессор
Петрозаводский университет, кафедра госпитальной терапии
Нестероидные противовоспалительные препараты
Поделиться:
Нестероидные противовоспалительные препараты, или НПВП, — анальгетики, проявляющие сразу три эффекта: обезболивающий, жаропонижающий и противовоспалительный. При этом дурная слава о плохом влиянии этих лекарств на желудок буквально преследует их.
Разбираться в особенностях принципа действия, показаниях и, конечно же, безопасности НПВП мы будем во второй статье из цикла о препаратах анальгетиках.
Ацетилсалициловая кислота: анальгетик с опытом
Мало кто знает, что самый первый НПВП, ацетилсалициловая кислота, имеет растительное происхождение — ее предшественник был получен из лабазника, или таволги вязолистной. Препарат создали фармацевты Байера в конце XIX века и назвали его в честь латинского наименования лабазника Spiraea ulmariа аспирином.
Принцип действия аспирина, как и всех других НПВП, состоит в блокировании фермента циклооксигеназы (ЦОГ). В организме существуют два типа ЦОГ. Первый, ЦОГ-1, — это нужный, «добрый» фермент: он выполняет множество важных функций, в том числе и защищает слизистую желудка. Второй, ЦОГ-2, отвечает за выработку простагландинов, запуская механизм боли и воспаления.
Ацетилсалициловая кислота блокирует оба вида ЦОГ, причем первый тип фермента в большей степени, чем второй. Поэтому список ее побочных эффектов немал, и лидером в нем является повреждение слизистой желудка, чреватое развитием гастрита и даже язвенной болезни. Аспирин категорически противопоказан детям младше 15 лет из-за опасности развития синдрома Рейе — тяжелого поражения мозга и печени.
Взрослые могут принимать препарат как жаропонижающее и легкое обезболивающее. Однако в последние годы ацетилсалициловая кислота на этом поприще уступила место более безопасным НПВП и перешла в разряд кардиологических препаратов благодаря свойству препятствовать агрегации тромбоцитов и «разжижать» таким образом кровь.
Сомнительный анальгин?
Метамизол натрия, или анальгин, — достаточно активный обезболивающий и очень слабый противовоспалительный препарат. К желудку он относится лояльно, направляя все свое негативное влияние на кровь. Серьезный побочный эффект анальгина — способность изменять картину крови и приводить к развитию апластической анемии, агранулоцитоза и других гематологических неприятностей.
Во многих странах мира, в том числе США, анальгин запрещен к продаже. А вот в Германии, к примеру, он широко применяется и даже считается препаратом выбора для лечения послеоперационной боли. В России анальгин знают, любят и пьют, и, признаться, в этом нет ничего страшного — главное не потреблять его регулярно (т. е. изо дня в день) и не превышать рекомендуемые дозы.
Диклофенак сотоварищи
Группа производных кислот поражает выбором даже специалистов, но каждый препарат, входящий в нее, все-таки имеет свое «лицо». Производные органических кислот отличаются выраженными противовоспалительными свойствами, нередко затмевающими обезболивающий и жаропонижающий эффект. Исключение составляет ибупрофен, который все-таки чаще всего применяется для борьбы с болью и лихорадкой, а не воспалением.
Одними из самых мощных противовоспалительных препаратов этой подгруппы считаются индометацин и диклофенак. Первый оказывает неблагоприятное действие на желудок и кровь, и применяется сегодня редко. Диклофенак гораздо более безопасен, что вкупе с высокой активностью и экономичностью обеспечивает крайне высокую популярность при ревматических заболеваниях.
Однако по анальгетическому эффекту диклофенак значительно уступает многим препаратам, в частности напроксену, который успешно применяют для борьбы с различными видами интенсивной боли, в том числе зубной, головной, периодической и т. д. Напроксен продается без рецепта врача и пользуется спросом как довольно безопасный, доступный и при этом мощный анальгетик.
Еще один НПВП, который используют для обезболивания, — кеторолак, известный под торговым названием Кетанов. Он отличается быстротой, силой и длительностью анальгетического действия в комплексе с традиционными для НПВП желудочно-кишечными побочными эффектами. Поэтому кеторолак применяют только по рецепту врача для купирования послеоперационной боли, боли при онкологических заболеваниях и в других непростых случаях.
Мефенаминовая кислота гораздо «невинней» кеторолака, однако и не столь результативна. Ее слава эффективного жаропонижающего средства несколько преувеличена: препарат чуть более активен, чем ацетилсалициловая кислота.
И еще один представитель НПВС, который нельзя обойти вниманием, — мелоксикам, совмещающий довольно щадящее действие на желудок с мощным противовоспалительным эффектом, благодаря чему он часто применяется в ревматологии.
Коксибы: последнее слово фармакологии
Коксибы — самая молодая группа НПВП, первый представитель которой, целекоксиб, появился в продаже в конце 1990-х годов. Коксибы почти не влияют на ЦОГ-1, а, значит, практически не оказывают традиционных для этой группы желудочно-кишечных побочных эффектов. Они достойно борются с болью и воспалением при артритах и других ревматоидных заболеваниях, однако первоначальных ожиданий, которыми были полны специалисты при появлении первого коксиба, не оправдали.
Препараты этой группы все-таки не лишены побочных эффектов (в частности, специалисты до сих пор обсуждают возможное влияние коксибов на повышение риска инфаркта и инсульта) и к тому же отличаются немаленькой ценой, способной вышибать почву из-под и без того нездоровых ног. Решение об их назначении должен принимать только врач, и самолечением коксибами, как, впрочем, и большинством других НПВП, заниматься не стоит.
Читателям, которых все-таки терзают муки выбора, хотелось бы сказать: не терзайтесь. Избавьтесь от этого камня на своей душе, водрузив его на плечи лечащего врача. Доверьте ему вашу боль и воспаление и не испытывайте желудок на прочность в попытках попасть пальцем в небо и отыскать из десятков лекарств самый «лучший» НПВП.
Товары по теме: [product](ацетилсалициловая кислота), [product](анальгин), [product](ибупрофен), [product](напроксен), [product](кетопрофен), [product](индометацин), [product](кеторолак), [product](ацеклофенак), [product](диклофенак), [product](пироксикам), [product](мелоксикам), [product](аркоксиа), [product](целекоксиб), [product](эторикоксиб), [product](акьюлар), [product](кетанов), [product](кеторол), [product](кетокам), [product](кетофрил), [product](долак), [product](аленталь), [product](аэртал), [product](наклофен), [product](мовалис), [product](либерум), [product](артрозан), [product](мирлокс), [product](амелотекс), [product](брутан), [product](ибуклин), [product](некст), [product](нурофен), [product](налгезин), [product](кетонал), [product](метиндол ретард), [product](коплавикс), [product](агренокс), [product](экседрин), [product](кардиомагнил), [product](кардиаск), [product](аспирин), [product](цитрамон), [product](тромбо АСС), [product](ацекардол), [product](аскофен-П), [product](аспикор), [product](тромбопол)
Ацеклофенак в терапии остеоартроза
Проведена оценка эффективности, переносимости, безопасности терапии ацеклофенаком по сравнению с диклофенаком больных гонартрозм. Показано, что оба препарата одинаково эффективны по влиянию на боль и функциональное состояние суставов, но лечение ацеклофен
Is carried out the estimation of effectiveness, transference, safety of aceclofenac therapy in comparison to diclofenac treatment of gonartrosis patients. It is shown that both preparations are equally effective on the influence on the pain and functional state of joints, but aceclofenac treatment is safer.
Остеоартроз (ОА) — заболевание, которое развивается в результате взаимодействия различных механических и биологических факторов, нарушающих существующее в норме равновесие между процессами деградации и синтеза всех компонентов матрикса и прежде всего суставного хряща [1]. В настоящее время ОА рассматривают как органное заболевание, поскольку в патологический процесс вовлекается не только хрящ, но и субхондральная кость, синовиальная оболочка, мениски, связки и периартикулярные мышцы.
Распространенность этого заболевания в популяции коррелирует с возрастом, достигая максимальных значений в возрасте старше 65 лет. Женщины болеют почти в 2 раза чаще мужчин. Развитие заболевания приводит к ухудшению качества жизни пациентов, ограничивает их физические возможности, а зачастую и социальные функции, является причиной инвалидности. По последним данным эпидемиологического исследования в России ОА с преимущественным поражением коленных и/или тазобедренных суставов страдает 13,0% населения [2].
Ведущим клиническим симптомом при ОА является боль, которая служит непосредственной причиной обращения больного к врачу. Ревматические заболевания (РЗ) отличаются по патогенезу и клинической картине, но имеют одно общее проявление — болевой синдром. С учетом патофизиологических механизмов предложено различать три основные группы болей: ноцицептивные, нейропатические и психогенные. Для ОА наиболее характерна ноцицептивная боль, которая возникает при раздражении периферических болевых рецепторов — «ноцицепторов», локализованных практически во всех органах и системах. Нейропатическая боль возникает вследствие повреждения различных отделов (периферической и центральной) соматосенсорной нервной системы и также может наблюдаться при ОА. Ноцицептивные болевые синдромы чаще всего являются острыми (ожог, порез, ушиб, ссадина, перелом, растяжение), однако при ОА они носят хронический характер. Ноцицепторами обильно снабжены ткани суставов: синовиальная мембрана, капсула сустава, связочный аппарат, периартикулярные мышцы, субхондральная кость, которые становятся источниками хронической боли при ОА. Одной из особенностей хронических болевых синдромов является рефлекторное вовлечение мышц, сначала на сегментарном поражению уровне, затем более диффузно, формирующем мышечно-тонический синдром, возникающий вследствие ноцицептивной импульсации, идущей от пораженных тканей. При длительной ноцицептивной импульсации тонически напряженная мышца сама становится источником боли и потенциально готова к формированию миофасциального болевого синдрома. Помимо возбуждения афферентными стимулами, мышечные ноцицепторы активируются эндогенными веществами, формирующимися при ее длительном напряжении и вызывающими ощущение боли, типа брадикинина, серотонина и высоких концентраций ионов калия. Брадикинин и серотонин тоже оказывают влияние на кровеносные сосуды и вызывают изменение локального состояния васкуляризации. Длительное напряжение мышц через механизмы нейрогенного воспаления способствует появлению локусов болезненных мышечных уплотнений, что еще более усиливает афферентный поток ноцицептивных импульсов в структуры ЦНС и как следствие этого, сенситизируется большее количество центральных ноцицептивных нейронов. Этот порочный круг играет важную роль в хронизации боли [29]. Интенсивность ее при ОА может зависеть от многих факторов, и, как показали последние исследования, одним из них является нарастание минеральной плотности субхондральной большеберцовой кости [3, 4].
Ведущее место в лечении ОА занимают нестероидные противовоспалительные препараты (НПВП), относящиеся к классу симптом-модифицирующих препаратов. В ревматологии НПВП рассматриваются как необходимый компонент комплексного лечения, что патогенетически обосновано, так как постоянно присутствующий воспалительный процесс является причиной болевого синдрома и прогрессирования заболевания. Обладая противовоспалительными, анальгетическими и жаропонижающими свойствами, они широко используются для уменьшения боли, воспаления, скованности и улучшения функции суставов, не влияя на исход заболевания, но значительно улучшая качество жизни больных. Как показали данные большого числа клинических исследований, при ревматических заболеваниях (РЗ) НПВП значительно эффективнее, чем высокие дозы парацетамола (4 г/сут), и не уступают опиоидным анальгетикам (таким как трамадол) [5, 6]. Однако даже кратковременный прием НПВП у определенной группы больных может приводить к развитию серьезных нежелательных явлений.
Разнонаправленность биологического действия НПВП объясняет не только их противовоспалительное действие, но и определенный спектр класс-специфических осложнений, возникающих на фоне их приема. Наиболее частые побочные эффекты НПВП — поражение желудочно-кишечного тракта (ЖКТ), негативное влияние на систему кровообращения, снижение агрегации тромбоцитов. Потенциально важными осложнениями являются также нефро- и гепатотоксичность.
Развитие НПВП-индуцированных гастропатий определяется в первую очередь системным воздействием НПВП, связанным с подавлением активности циклооксигеназы-1 (ЦОГ-1), определяющей синтез «цитопротективных» простагландинов (ПГ), что приводит к существенному снижению ее защитного потенциала и способствует повреждению слизистой. Снижение агрегации тромбоцитов, ухудшение капиллярного кровотока в слизистой, блокада NO-синтетазы и ферментных систем митохондрий эпителиоцитов, усиление клеточного апоптоза, влияние на желудочную секрецию и нарушение процессов репарации связаны с блокадой ЦОГ-2 и являются дополнительными факторами, связанными с системным воздействием НПВП [8]. НПВП-гастропатии возникают в хронологической связи с приемом НПВП и проявляются эрозиями и язвами верхних отделов ЖКТ, на фоне которых возможны такие осложнения, как желудочно-кишечное кровотечение и перфорация. Негативное влияние этих препаратов может отмечаться во всех отделах ЖКТ, от полости рта до прямой кишки. Поражения печени, ассоциированные с регулярным приемом НПВП, проявляются бессимптомным повышением трансаминаз у 1–5% больных. Клинически выраженные гепатотоксические реакции встречаются существенно реже — около 1 случая на 10 000 больных. Больным, регулярно принимающим НПВП и имеющим возможные факторы риска поражения печени, требуется регулярный контроль биохимического анализа крови.
Кардиоваскулярные побочные эффекты НПВП особенно выражены у лиц пожилого возраста и у больных, страдающих сопутствующими заболеваниями (ишемическая болезнь сердца, сахарный диабет), а также ревматическими воспалительными заболеваниями (в первую очередь ревматоидный артрит (РА)). НПВП являются независимым фактором риска развития артериальной гипертензии (АГ). Результаты рандомизированных клинических исследований и метаанализов свидетельствуют, что прием неселективных (нНПВП) и селективных НПВП (сНПВП) приводит к повышению АД и имеет существенное значение у больных, исходно имеющих АГ [9]. Особое внимание привлечено к потенциальным кардиоваскулярным осложнениям на фоне приема сНПВП, что связано с возможностью этих препаратов снижать ЦОГ-2-зависимый синтез простациклина (РGl2) клетками сосудистого эндотелия и отсутствием влияния на ЦОГ-1-зависимый синтез тромбоксана (ТхА2) тромбоцитами, что потенциально может приводить к нарушению баланса РGl2/ТхА2 и, следовательно, к активации агрегации и адгезии тромбоцитов и увеличению риска тромбообразования. Необходимо отметить, что НПВП, как класс, способны повышать риск развития кардиоваскулярных осложнений, однако этот фактор существенно уступает по значению другим, таким как курение, дислипидемия, ожирение [8, 27].
Тем не менее, при грамотном назначении НПВП можно снизить риск развития нежелательных явлений. При индивидуальном подборе НПВП необходимо учитывать анальгетический эффект препарата, индивидуальный риск развития нежелательных явлений со стороны ЖКТ и сердечно-сосудистой системы. Опасность ЖКТ-осложнений снижается при назначении ингибиторов протонной помпы (ИПП), а кардиоваскулярный риск — при использовании низких доз ацетилсалициловой кислоты [10]. Необходимо помнить, что основными факторами риска являются пожилой возраст (старше 65 лет), наличие в анамнезе язвенной болезни, длительный прием высоких доз НПВП и одновременное применение двух и более различных НПВП, а также сочетанный прием НПВП и гормональных препаратов. В последних международных рекомендациях по лечению больных ОА говорится о том, что терапию НПВП необходимо проводить в минимальных эффективных дозах и, по возможности, не назначать их длительно [7].
В России имеется широкий спектр НПВП и закономерно возникает вопрос о рациональном выборе препарата. Несомненно, он должен основываться на объективном сравнении достоинств и недостатков различных представителей этой группы препаратов. Доказано, что в эквивалентных дозах и при достаточном времени наблюдения все НПВП (селективные и неселективные) демонстрируют одинаковую эффективность [28].
Основной принцип действия НПВП заключается в подавлении ЦОГ — фермента метаболизма арахидоновой кислоты в простагландины. Особое место среди НПВП занимает ацеклофенак (Аэртал), который обладает многокомпонентным действием на воспаление. Ацеклофенак ингибирует и ЦОГ-1 (синтез физиологических ПГ), и ЦОГ-2 (синтез провоспалительных ПГ), приближаясь к селективным НПВП, и поэтому является более безопасным в отношении ЖКТ. Препарат ингибирует синтез провоспалительного цитокина интерлейкина IL-1-бета, который подавляет пролиферацию хондроцитов и активизирует деградацию хряща. Важной способностью ацеклофенака является подавление синтеза фактора некроза опухоли альфа (ФНО-альфа), оксида азота. Кроме этого, препарат угнетает экспрессию молекул клеточной адгезии (L-селектин), подавляет адгезию нейтрофилов к эндотелию, что обеспечивает выраженный противовоспалительный эффект [14, 15]. В настоящее время особое внимание уделяется влиянию НПВП на метаболизм хрящевой ткани. Условно НПВП можно разделить на три группы: хондронегативные, нейтральные по отношению к хрящевой ткани и хондропротективные. Вопрос о негативном влиянии некоторых препаратов из этой группы на прогрессирование ОА широко обсуждается [11–13]. Так, в исследованиях in vitro было показано, что индометацин и салицилаты ингибируют синтез компонентов матрикса хряща, способствуя прогрессированию заболевания, а индометацин оказывает прямое негативное действие, снижая содержание протеогликанов в гиалиновом хряще и повышая потерю вновь образованных протеогликанов. В то же время некоторые НПВП повышают синтез компонентов матрикса и тормозят апоптоз хондроцитов. Ацеклофенак в эксперименте продемонстрировал способность повышать синтез протеогликанов и гиалуроновой кислоты в культуре клеток хряща больных ОА, а также снижать продукцию металлопротеиназ, вызывающих деструкцию костной и хрящевой ткани [14, 15]. Blot L. и соавт., изучая изменения в метаболизме протеогликанов и гиалуронана под влиянием ацеклофенака, диклофенака и мелоксикама в эксплантах хряща, полученных от больных среднетяжелым и тяжелым гонартрозом, показали, что при лечении диклофенаком метаболический баланс между содержанием протеогликанов и гиалуроновой кислоты в экстрацеллюлярном матриксе гиалинового хряща оставался без изменений. Ацеклофенак и мелоксикам, напротив, обладали дозозависимым эффектом и повышали синтез протеогликанов и гиалуроновой кислоты при среднетяжелом ОА [15].
Клиническая эффективность ацеклофенака доказана в 132 опубликованных клинических исследованиях. Переносимость и эффективность этого препарата изучалась в сравнительных исследованиях с различными анальгетиками и НПВП. Так, Battle-Gualda E. и соавт. в двойном слепом рандомизированном 6-недельном исследовании у 168 больных с ОА коленных суставов показали, что ацеклофенак в дозе 200 мг/сут был эффективнее в отношении купирования болевого синдрома при лучшей переносимости по сравнению с парацетамолом 3 г/сут [16]. В более длительном исследовании (период наблюдения составил 12 недель) у больных с гонартрозом, ацеклофенак 200 мг/сут сравнивали с напроксеном 1 г/сут. Оба препарата обладали равным анальгетическим эффектом, однако у ацеклофенака было отмечено значительно меньшее количество нежелательных явлений со стороны ЖКТ [17]. Результаты метаанализа 13 рандомизированных двойных слепых исследований у пациентов с РЗ показали, что при приеме ацеклофенака в течение длительного времени (3–6 месяцев) побочные реакции развивались в 1,38 раза реже, чем при приеме других НПВП [18]. Эффективность ацеклофенака оценивалась в рандомизированных исследованиях и при других РЗ: при РА ацеклофенак в дозе 200 мг/сут был сопоставим с диклофенаком в дозе 150 мг/сут, кетопрофеном в дозе 150 мг/сут, пироксикамом в дозе 20 мг/сут. Также было отмечено, что положительная динамика быстрее развивалась у больных, получавших ацеклофенак. У больных с анкилозирующим спондилоартритом (АС) в сравнительных исследованиях ацеклофенака 200 мг/сут, теноксикама 20 мг/сут, напроксена 1 г/сут и индометацина 100 мг/сут были получены сходные результаты [19].
Больные РЗ, как правило, вынуждены принимать НПВП длительное время, поэтому очень важна хорошая переносимость препарата. Результаты проспективного, открытого, многоцентрового 12-месячного исследования SAMM (Safety Assessment of Marketed Medicines), в котором оценивалась безопасность ацеклофенака и диклофенака у 10 142 больных, страдающих РА, ОА, АС, подтвердили хорошую переносимость ацеклофенака [20]. Ацеклофенак в дозе 200 мг/сут получали 7890 человек и диклофенак 150 мг/сут — 2252 пациента. Исследователями была проанализирована частота побочных реакций: нежелательные явления возникли у 22,4% больных, получавших ацеклофенак, и у 27,1% — принимавших диклофенак. Наиболее частыми из них были реакции со стороны ЖКТ (диспепсия, боли, диарея, тошнота) — в 10,6% и 15,2% (р 40 мм по ВАШ. По демографическим и клиническим параметрам группы были сопоставимы (табл. 1). Первая группа принимала ацеклофенак (Аэртал) 200 мг/сут, вторая — диклофенак 100 мг/сут. Длительность исследования составила 3 месяца. Оценивались: индекс WOMAC, тест «встань и иди», опросник EQ-5D, общий и биохимический анализы крови.
Результаты исследования и обсуждение
Достоверное уменьшение интенсивности боли и улучшение функции суставов, уменьшение суммарного индекса WOMAC отмечалось через месяц терапии в обеих группах больных и сохранялось весь период наблюдения (табл. 2). Более быстрое снижение скованности отмечалось у больных, принимавших ацеклофенак, когда уже на втором визите были получены статистически значимые показатели, к концу лечения отмечалось достоверное снижение скованности в обеих группах больных. Достоверное улучшение показателей общего состояния здоровья и EQ-5 D, а также уменьшение затрачиваемого времени при выполнении теста «встань и иди» наблюдалось в обеих группах со второго визита.
Через месяц «значительное улучшение» и «улучшение» чаще наблюдалось на фоне приема ацеклофенака (86,3%), чем на диклофенаке (66%), через 3 месяца терапии — у 95,8% и у 76,2% соответственно (р
Е. П. Шарапова*, кандидат медицинских наук
Е. А. Таскина*
Т. А. Раскина**, доктор медицинских наук
И. Б. Виноградова***, кандидат медицинских наук, доцент
О. Н. Иванова****, кандидат медицинских наук
Л. В. Меньшикова*****, доктор медицинских наук, профессор
Л. И. Алексеева*, доктор медицинских наук, профессор
*ФГБУ НИИ ревматологии РАМН, Москва
**ГБОУ ВПО КемГМА Минздравсоцразвития России, Кемерово
***ГУЗ ОКБ, Ульяновск
****ГУЗ ОКБ № 1, Воронеж
*****ГБОУ ДПО ИГМАПО Минздравсоцразвития России, Иркутск


.gif)