Аутокость в позвоночнике что это при операции
Cистемы стабилизации позвоночника
Содержание:
За последние десятилетия хирургия позвоночника совершила огромный прорыв в своем развитии, благодаря развитию и внедрению различных доступов — вентральных, дорзальных, переднебоковых, комбинированных; анестезиологии и реанимации, которые позволяют пациентам выдерживать многочасовые, травматичные операции со значительной кровопотерей и конечно же постоянному совершенствованию стабилизирующих систем.
В данном небольшом обзоре собственного опыта лечения заболеваний позвоночника хотелось бы уделить особенное внимание именно современным конструкциям для стабилизации позвоночника, отметить слабые и сильные стороны, продемонстрировать различные сочетания имплантов между собой в той или иной клинической ситуации. Медицинский рынок имплантов в нашей стране стремительно развивается, на арену выходят все новые конструкции, представляемые различными производителями, что обусловлено технологическим прогрессом, конкуренцией и огромной коммерческой составляющей.
Традиционно лидируют западноевропейские и американские производители, но все чаще в нашу ежедневную практику приходят азиатские импланты, произведенные в Китае, Южной Корее и т.д.
Самым первым телозамещающим протезом позвонка была собственная кость (аутокость из гребня подвздошной кости, участок ребра или малая берцовая кость), которая устанавливалась между телами позвонков в специальные пазы вместо удаленного. Дополнительная фиксация не проводилась, в связи с чем сохранялась опасность миграции аутокости, а пациент был вынужден соблюдать длительный постельный режим до образования надежного костного сращения. Это значительно снижало качество жизни пациента, было сопряжено с гиподинамическими осложнениями. Со временем появились устройства, которые способствовали неподвижному положению костного трансплантата, в результате чего пациент мог быть активизирован в раннем послеоперационном периоде. До сих пор собственная кость считается «золотым» стандартом в создании корпородеза.
Клинический пример
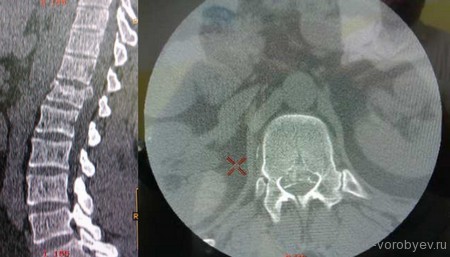
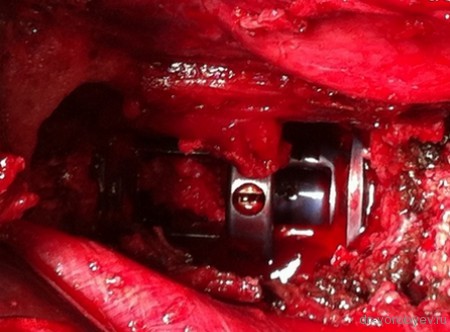
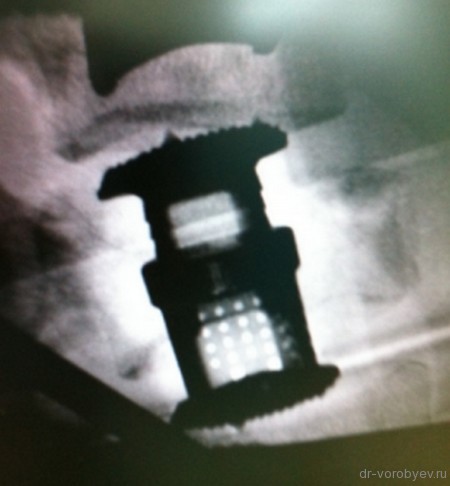
Представлены КТ пациента до и после оперативного лечения по поводу осложненного перелома пятого шейного позвонка. Выполнена корпорэктомия пятого шейного позвонка с комбинированным корпородезом аутокостью из подвздошного гребня и пластиной китайского производства.
Все большее количество клиник овладевает техникой «передних вмешательств на грудном и поясничном отделах позвоночника», где так же используется аутокость для межтелового корпородеза.
Клинический пример
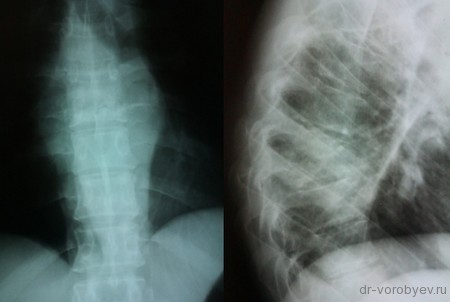
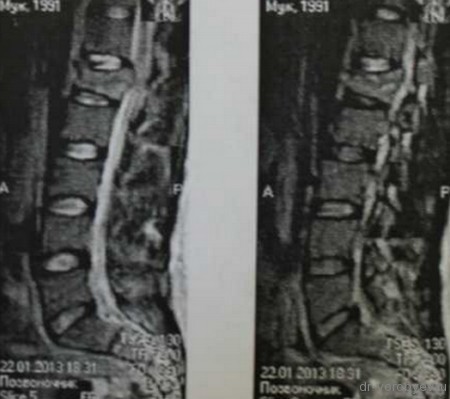
На данных томограммах представлен нестабильный перелом тела Тн12 позвонка
Первым этапом выполнена ламинэктомия с транспедикулярной фиксацией китайской системой, а затем проведена корпорэктомия, корпородез аутокостью и тораколюмбальной пластиной китайского производства.
Клинический пример
Пациент с неспецифическим спондилодисцитом в грудном отделе позвоночника
Выполнена операция торакотомия, трансплевральная корпорэктомия, комбинированный корпородез аутокостью и пластиной Centaur фирмы Stryker
Как уже упоминалось, собственная кость считается идеальным материалом и «золотым» стандартом для протезирования тела позвонка и создания прочного корпородеза, но данная методика не идеальна и имеет ряд недостатков:
1. Взятие аутокости является самостоятельной дополнительной операцией, которая удлинняет время основного оперативного вмешательства.
2. Она является дополнительным ослабляющим фактором у ослабленных, пожилых пациентов (в том числе с опухолевым поражением позвоночника), является дополнительным источником кровотечения из костной раны.
3. Не всегда возможна и удобна операция взятия аутотрансплантата из гребня подвздошной кости у пациентов с переломом костей таза.
4. Возможна резорбция костного аутотрансплантата с развитием нестабильности оперированного сегмента. Все эти доводы подталкивают на создание искусственных металлических, керамических и др. заменителей тела позвонка.
Титановый сетчатый МЭШ является распространенным заменителем тела позвонка и используется для всех отделов позвоночника. Он представляет из себя участок трубки различного диаметра и длины (в зависимости от того, в какой отдел позвоночника будет имплантирован) с ромбовидными отверстиями. С учетом высоты межпозвонкового промежутка после выполненной корпорэктомии МЭШ моделируется (обрезается по необходимой длине), заполняется собственной костью или остеоиндуктивным материалом и устанавливается между телами позвонков. Самостоятельно МЭШ не может обеспечить ротационную стабильность в оперированном сегменте позвоночника, в связи с чем требует дополнительной фиксации передней или передне-боковой пластиной, установки транспедикулярной системы.
Клинический пример
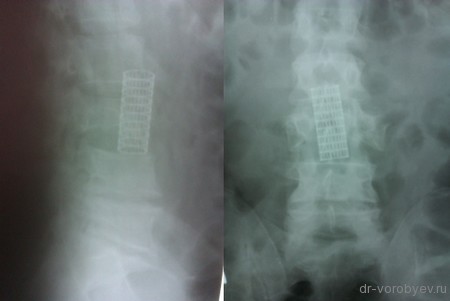
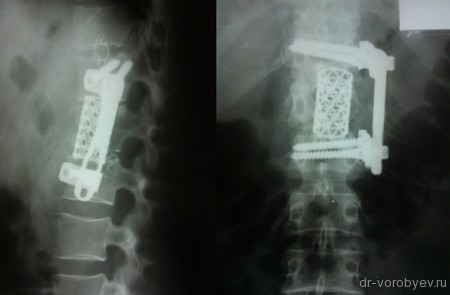
Первым этапом проведена корпорэктомия третьего поясничного позвонка и корпородез МЭШем, заполненным аутокостью
Вторым этапом, с целью создания ротационной стабильности, компрессии позвонков проведена транспедикулярная фиксация.
Клинический пример
Пациентка с метастазом в рака молочной железы в первый поясничный позвонок
Выполнена корпорэктомия первого поясничного позвонка и комбинированный корпородез МЭШем и боковой пластиной Centaur фирма Stryker. Наряду с преимуществами, главным из которых является относительная дешевизна данного импланта, МЭШ так же не является идеальной конструкцией для переднего корпородеза и имеет на наш взгляд ряд недостатков:
1. Большинство отечественных МЭШей не имеют установочного инструментария для обрезания и моделирования по длине, что требует со стороны хирурга больших физических затрат с использованием подручного неприспособленного инструментария (различного вида кусачки и проволочные пилы).
2. При имплантации в свое ложе МЭШ может легко деформироваться и погнуться (не терпит подбивания импакторами).
3. МЭШи, лишенные торцевых площадок (чаще всего отечественные), имеют острые края, благодаря которым возможно продавливание замыкательных пластин опорных позвонков с нарушением стабильности в оперированном сегменте.
4. Требуют использования дополнительных фиксаторов.
Различные импланты из неорганических соединений – корундовая керамика, никелид титана, гидроксиапатиты.
Преимуществами данных телозамещающих изделий является хорошая биосовместимость с костной тканью и способность к ее прорастанию в имплант благодаря высокой порозности, относительная дешевизна, легкость при моделировании необходимой формы и размера. Данные импланты по своим характеристикам и своиствам схожи с аутокостью, но лишены такого ее недостатка, как возможное рассасывание, но к сожалению некоторые импланты данного вида достаточно хрупки и при имплантации могут крошиться и трескаться, кроме того, как и в ситуации с аутокостью требуют использования дополнительных устройств для фиксации – пластин, транспедикулярных фиксаторов и т.д.
Клинический пример
В данной конкретной ситуации выполнена дискэктомия С5-С6 и межтеловой корпородез имплантом из гидроксиапатита производство Франции и пластиной.
Телескопические протезы тела позвонка
Традиционно в условиях российского рынка лидируют западноевропейские и американские производители телескопических протезов тел позвонков.
Сами по себе данные устройства имеют огромное количество преимуществ перед своими конструктивными предшественниками:
1. Существует большое количество типов и размеров имплантов, прилагается высоко технологичный инструментарий для качественной установки.
2. Благодаря концевым площадкам с различными кифотическими и лордозными углами моделируют естественные изгибы позвоночника.
3. С помощью раздвижного телескопического устройства плотно фиксируются в своем ложе.
4. При необходимости легко демонтируются.
5. Имеют возможность малоинвазивной эндоскопической установки (протез тела позвонка Obelisk, Ulrich, Германия в комбинации с боковой пластиной Golden Gate) и т д и т п Но, к сожалению высокая стоимость часто лимитирует использование данных устройств в российской практической медицине. Кроме того, телескопические протезы тела позвонка так же требуют дополнительной фиксации с помощью пластин или транспедикулярных устройств для придания ротационной стабильности.
Клинический пример
Перелом тела первого поясничного позвонка
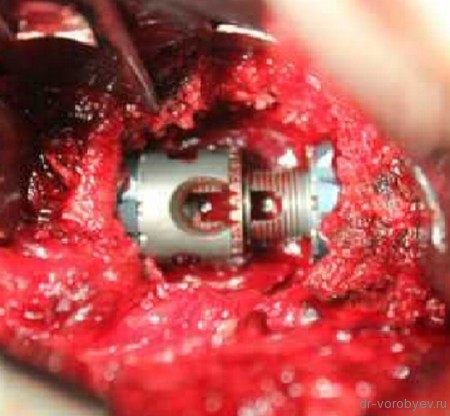
Вид операционной раны. На место удаленного тела позвонка, после декомпрессии установлен протез тела позвонка Obelisk, Ulrich, Германия
Протез дополнительно фиксирован тораколюмбальной пластиной.
Рентгенологический контроль после операции.
Клинический пример
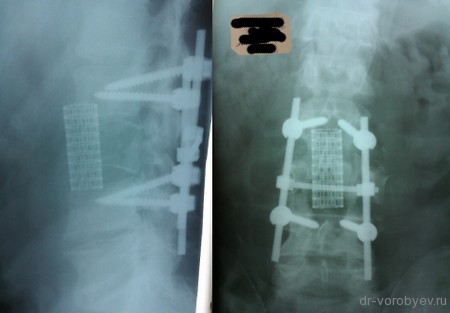
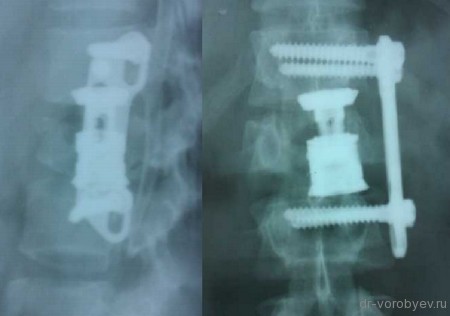
Передний корпородез с использованием телескопического протеза тела позвонка Synex, фирма Synthes, США.
Внешний вид импланта
Протез помещен между телами смежных позвонков.
Интраоперационный рентгенологический контроль.
Вопросы о необходимости операции с использованием импланта можно задать по телефону +7-903-526-78-77
Спондилодез – операция по стабилизации позвоночника
Спондилодез – метод оперативного лечения позвоночника, целью которого является жесткая стабилизация (закрепление, сращивание) соседних позвонков при помощи специальных костных трансплантатов. В качестве трансплантатов обычно применяют часть подвздошной та
ДОСТУПНЫЕ ЦЕНЫ НА КУРС ЛЕЧЕНИЯ
Мягко, приятно, нас не боятся дети
ДОСТУПНЫЕ ЦЕНЫ НА КУРС ЛЕЧЕНИЯ
Мягко, приятно, нас не боятся дети
Операции по стабилизации позвоночника выполняются в медицинской практике на протяжении многих десятилетий, но в последнее время произошла настоящая революция в технологиях внедрения и материалах изготовления имплантатов. Современные цифровые микроскопы и эндокринные методы оперирования позволяют уменьшить размеры трепанационного окна, а, следовательно, сократить количество осложнений, улучшить результаты вмешательства и ускорить выздоровление больного. На сегодняшний день спондилодез стал обычной повседневной операцией в нейрохирургии.
Анатомия
Позвоночник человека состоит из костных сегментов (позвонков), скрепленных между собой хрящевыми образованиями (межпозвоночными дисками). Именно такое строение позвоночного столба обеспечивает его стабильность, жесткость, способность выдерживать значительные нагрузки и вместе с тем гибкость и подвижность.
Межпозвоночные диски имеют более мягкую и рыхлую структуру, чем кости позвонков и изнашиваются гораздо быстрее. Современный образ жизни, слабые физические нагрузки и другие неблагоприятные факторы провоцируют нарушения анатомических форм хрящей, изменение их состава и развитие ряда заболеваний позвоночника, лечение которых нежелательно откладывать в долгий ящик.
Заметное снижение двигательных возможностей, ограничение гибкости и возникновение болевого синдрома – основные признаки развивающихся недугов. Первоначально пациенту назначается консервативное лечение позвоночника, если заметного улучшения достичь не удалось или состояние больного ухудшилось, принимается решение о хирургическом вмешательстве.
Показания к проведению операции
Спондилодез достаточно широко используется для лечения травматических повреждений и хронических заболеваний позвоночника:
Все вышеперечисленные заболевания требуют обеспечения неподвижности позвонков на какой-то определенный период или постоянно. Это значительно снижает двигательные возможности и гибкость позвоночного столба, но позволяет быстро избавиться от болевого синдрома и приостановить развитие болезней, разрушающих позвоночник.
В любом случае для улучшения состояния здоровья пациента, повышения уровня качества жизни и скорейшего возврата к трудоспособности необходима консультация врача вертебролога, остеопата или ортопеда, прохождение необходимых исследований и диагностики. Затем предлагаются консервативные методы лечения, а при их несостоятельности рассматривается вопрос о хирургическом вмешательстве.
Ход операции
Спондилодез проводится под общим наркозом. На кожном покрове спины непосредственно над патологическим участком проводится надрез для доступа к позвоночнику (задний спондилодез). В некоторых случаях требуется доступ к передней части позвоночного столба, тогда надрезы делаются в боку или спереди (брюшной полости).
Затем специальным инструментом раздвигаются мышечные ткани, предоставляя место для манипуляций. Далее удаляется поврежденный позвонок или межпозвоночный диск, ставится трансплантат, закрепляемый системой пластин и шурупов. После срастания костных структур металлические стабилизирующие конструкции, как правило, не извлекаются, так как это требует дополнительного хирургического вмешательства и существует риск для здоровья пациента.
В завершении операции сшиваются послойно все структуры, и накладывается повязка, пациент перевозится в реанимационную палату. В среднем процедура длится от одного часа до трех, в зависимости от сложности конкретного случая, количества фиксируемых сегментов и диагноза больного.
Предварительные исследования и операционные риски
Перед проведением операции обязательно необходимо будет сделать рентгенограмму для уточнения деталей МРТ или КТ исследования. Далее проводится ЭКГ и снимок грудной клетки. Проводятся заборы крови и мочи для общего анализа, а также для определения химического состава крови, ее свертываемости, печеночно-почечной функциональности и др. Выявляются аллергические реакции на наркоз и другие, применяемые во время оперирования средства.
Непосредственно в день проведения хирургического вмешательства не разрешается ни есть, ни пить, рекомендуется отказаться от курения и не принимать никаких лекарств, снять вставные зубные протезы.
Как и другие хирургические вмешательства, операция по стабилизации позвоночника имеет свои риски и осложнения, которые необходимо учитывать до принятия решения. Во время оперирования существует риск повреждения близлежащих тканей и структур, самые опасные это – нервные корешки и спинной мозг. В результате чего может наступить временный или полный паралич конечностей, возникнуть проблемы с деятельностью внутренних органов (мочевой, половой, желудочно-кишечной систем).
После вмешательства может открыться кровотечение, возникнуть воспалительные процессы в месте оперирования или заражение крови. Кроме того иногда наблюдается поломка или нарушение крепежных конструкций, хроническое несрастание позвонков или неприживаемость трансплантатов, а также невозможность решить спондилодезом изначальных проблем пациента.
Послеоперационный период и реабилитация
На следующий день после операции пациент переводится в общую хирургическую палату, а через два-три дня ему можно будет вставать, и пробовать ходить. В некоторых случаях назначается ношение жесткого поддерживающего корсета. Из стационара больного выписывают примерно через неделю, тогда же снимают и швы.
Вернуться к привычному образу жизни можно будет через 3-4 недели. На время всего периода лечения назначается режим щадящих физических нагрузок, исключающий резкие наклоны, повороты или сгибания-разгибания спины, поднятия тяжестей. Трудоспособность, связанная с физически тяжелым трудом или виды спорта с серьезными нагрузками будут доступны только через год.
В реабилитационный период пациенту будет назначен индивидуальный курс ЛФК, физиопроцедур, лечение методами мануальной терапии, плавание. Для скорейшего выздоровления рекомендуется прохождение ежегодного санаторно-курортного лечения. Постоянное наблюдение лечащего врача с регулярным рентгенографическим контролем в первый послеоперационный год проводится раз в три месяца, далее реже. При отсутствии беспокоящих симптомов посещение клиники лечения спины можно свести к одному разу в два года
Аутокость в позвоночнике что это при операции
Заменители костного трансплантата широко используются в области ортопедии и нейрохирургии, в том числе для спондилодеза. Поскольку в настоящее время операция спондилодеза считается одной из наиболее частых в хирургии позвоночника, выбор костных материалов для достижения оптимального результата вызывает повышенный интерес.
Для стимуляции сращения позвонков чаще всего применяют аллотрансплантаты и аутотрансплантаты — нынешний «золотой стандарт» для спондилодеза.
Эти подходы ставят некоторые ограничения и представляют осложнения для пациента.
В последние годы на рынке появились многочисленные альтернативные заменители костного трансплантата, которые отличаются повышенными остеогенными свойствами и устраняют все риски и осложнения, сопряженные с использованием трупной кости или аутокости.
Дополнительные усилия исследования сосредоточены на расширении возможностей традиционных костных материалов за счет добавления остеоиндуктивных белков.
Биоинженерные гидрогели, синтетические полимерные композиты и генная терапия также потенциально могут использоваться для операций спондилодеза в будущем, хотя и требуют дальнейшего изучения для использования в клинической практике.
Аутогенный и аллогенный костный материал для спондилодеза
Каждый год в мире выполняются миллионы хирургических операций, предполагающих костную пластику. Спондилодез является одним из самых частых вмешательств, которые требуют использования природных или синтетических костных материалов.
В настоящее время аутотрансплантаты и аллотрансплантаты являются основными вариантами лечения пациентов, требующий спондилодеза.
Аутогенный костный материал получают из подвздошной кости самого пациента. Он обладает остеогенными, остеоиндуктивными и остеокондуктивными свойствами, а также исключает риск иммунных реакций или передачи инфекций от донора.
Однако получение аутокости сопряжено с дополнительной хирургической операцией, удлинением времени восстановления и повышением риска осложнений и увеличением расходов. Эти недостатки обуславливают поиск альтернативных материалов.
Аллогенный костный материал традиционно использовался в ситуациях, когда получить аутокость было невозможно по тем или иным причинам. Аллотрансплантаты производят из трупной ткани, подвергая ее специальной многостадийной обработке.
Несмотря на относительную простоту получения, трупная кость означает риск передачи инфекционных заболеваний, снижение механической прочности, недостаточные остеогенные свойства. Кроме того, у некоторых людей есть религиозные и этические мотивы, не допускающие имплантации кости от умершего человека.
По сравнению с аутокостью интеграция аллотрансплантатов с нативной костью происходит медленней. В этих случаях не достигается полная васкуляризация, и наблюдается снижение остеоиндукции и остеокондукции.
Чтобы обойти недостатки аутокости и трупного аллотрансплантата, были разработаны альтернативные костные материалы для спондилодеза.
Все существующие заменители костного трансплантата не обладают высокой степенью остеоиндукции, остеокондукции и остеогенности. Тем не менее, многие демонстрируют большой потенциал в фундаментальных научных и клинических исследованиях.
Современные исследования в области молекулярной биологии, тканевой инженерии и регенеративной медицины сфокусированы на инновационных стратегиях.
Прогресс в сфере остеоиндуктивных белков, матриц остеокондуктивных носителей, генной терапии и тканевых каркасов способствует быстрому развитию практики спондилодеза.
В этой публикации мы рассмотрим биологию сращения позвонков и современные достижения в области биомедицинских материалов и биологические стратегии для применения в хирургии позвоночника.
Биологические основы сращения позвонков
Текущий прогресс в практике спондилодеза зависит от достижений в минимально инвазивной хирургии и полного понимания биологического процесса сращения позвонков.
Спондилодез являет собой сложный процесс с влиянием многочисленных факторов, который чрезвычайно трудно оценить в клинических условиях из-за отсутствия точных методов.
Таким образом, животная модель представляется ценной альтернативой, которая широко используется для оценки каждого отдельного фактора успешности лечения.
Boden и соавторы описали сложную биологию спондилодеза у новозеландских белых кроликов. Авторы разделили включение аутогенного трансплантата на пять стадий:
Воспаление: стадия воспаления длится 7-14 дней. Первоначальное повреждение местных сосудов и декортикация приводит к образованию гематомы вокруг костного материала, который окружается воспалительными клетками. Фибробластоподобные клетки в воспалительной ткани превращаются в фиброваскулярную строму. Снижение успешности сращения, наблюдаемое при использовании противовоспалительных препаратов в периоперационном периоде, показывает важность воспаления.
Васкуляризация: в фиброваскулярной строме появляются сосудистые зачатки, напоминающие формирование рубцовой ткани. Первичные мембранозные кости образуются вблизи декортицированной кости с последующим минимальным хрящевым и эндохондральным окостенением.
Остеоиндукция: на 4-5 неделе наблюдается фаза восстановления, которая проявляется усиленной васкуляризацией, резорбцией некротизированных тканей, дифференцировкой остеобластов и хондробластов. Отличительной чертой стадии остеоиндукции является дифференцировка стволовых клеток в остеобласты, расширение новой кости и продолжающаяся резорбция графта.
Остеокондукция: остеокондукция характеризуется врастанием в кость хозяина и ползучей заменой. Происходит одновременное создание новой кости остеобластами и резорбция графта остеокластами. Центральная зона эндохондрального интерфейса объединяет нижний и верхний позвонки. Плюрипотентные клетки в этой центральной зоне дифференцируются хрящевую ткань с меньшей васкуляризацией.
Ремоделирование: в течение 6-10 недель вокруг области сращения позвонков образуется периферический кортикальный ободок, повышается активность костного мозга с образованием вторичной спонгиозы. Кортикальный ободок утолщается, трабекулярный отросток распространяется до центра.
Следует отметить, что процесс ремоделирования обычно завершается к первому году.
Деминерализованный костный матрикс для спондилодеза
В 1965 году Urist выделил костные морфогенетические белки (КМБ) из экстрактов деминерализованной кости. Это привлекло внимание к материалу.
Деминерализованный костный матрикс (ДКМ) представляет собой костный материал животного или человеческого происхождения, лишенный минеральной фазы, но содержащий позади органическую фазу из остеокондуктивного коллагенового композитного матрикса и неколлагеновых белков.
ДКМ получают путем кислотно-экстракционной обработкой костной ткани человека либо животных. Такая обработка приводит к потере большей части минеральных составляющих. Оставшийся продукт содержит коллаген-I, неколлагеновые белки и факторы роста.
ДКМ обладают остеокондуктивностью и остеоиндуктивностью, но не имеют структурной целостности. При этом костные морфогенетические белки составляют остеоиндуктивную способность деминерализованного костного матрикса.
В животных моделях спондилодеза позвоночника у крыс испытывались различные продукты на основе ДКМ, потенциал которых в регенерации костной ткани сильно отличался. Сегодня ДКМ доступен в разных формах, включая гель, листы и смеси с кортикальной крошкой.
Peterson и соавторы констатировали, что скорость сращения позвонков в значительной мере зависит от используемого костного материала. С помощью иммуноферментного анализа Bae и коллеги доказали чрезвычайно высокую вариабельность содержания костных морфогенетических белков, даже в разных партиях одного производителя.
Деминерализованный костный матрикс изучался на кроликах и приматах, а недавние клинические исследования подтверждают целесообразность использования ДКМ при постеролатеральном спондилодезе.
Girardi и соавторы сравнили эффективность гелевых композитов на основе ДКМ и аутотрансплантатов гребня подвздошной кости, получив многообещающие результаты.
Аналогичное исследование Vaccaro показало, что паста ДКМ, а также композит с аспиратом костного мозга существенно повышают эффективность постеролатерального спондилодеза, что позволяет ставить их в один ряд с аутотрансплантатом подвздошного гребня.
Альтернативные костные материалы являются очень перспективными при операциях на позвоночнике по поводу сколиоза, где необходим значительный объем материала.
Price и его коллеги определили, что композит ДКМ и костного мозга в этой ситуации работает аналогично аутотрансплантату подвздошного гребня.
Деминерализованный костный матрикс при вентральном спондилодезе ограниченно изучен, и в настоящее время не рекомендуется в клинической практике. Хотя исследования показали эффективность ДКМ при использовании стабилизирующих титановых имплантатов, результаты свидетельствуют о более высокой частоте коллапса костного трансплантата и возникновения псевдоартроза по сравнению а аутогенной костью.
Керамические материалы для спондилодеза
В исследованиях 1990-х годов было обнаружено, что морские беспозвоночные кораллы имеют поразительно похожую микроскопическую пористую структуру с костью.
Chiroff и соавторы предложили использовать эти кораллы в качестве заменителя костного трансплантата, в том числе при операциях на позвоночнике.
Такие керамические материалы состоят из сульфата кальция, гидроксиапатита (ГАП) и трикальцийфосфата, бычьего коллагена, натурального коралла, карбоната кальция или их комбинации. Керамические каркасы являются остеокондуктивными, биоразлагаемыми и практически нивелируют риск передачи инфекционного заболевания.
Кроме того, керамика нетоксична и неиммуногена, она легко стерилизуется и может быть изготовлена практически любых размеров и форм. Недостатки керамики заключаются в том, что они обладают ограниченной прочностью на сдвиг и прочность на сжатие.
Керамический материал не является ни остеогенным, ни остеоиндуктивным. Размер пор (100-500 мм) имеет решающее значение для миграции клеток, поступления нутриентов и выведения продуктов метаболизма из формирующейся костной ткани.
Поры обеспечивают фиброваскулярное врастание остеоидного матрикса. Минерализация остеоида идет путем внутримембранной оссификации, а ремоделирование осуществляется при помощи гигантских многоядерных клеток.
Гидроксиапатит, трикальцийфосфат или комбинация этих материалов — наиболее часто используемые керамические каркасы. Но в последнее десятилетие исследования композитов из синтетических материалов в качестве заменителей кости расширились благодаря возможности манипулировать свойствами композитов.
Было проведено несколько исследований на животных, чтобы подтвердить остеокондуктивность керамики, но клинических исследований недостаточно.
Керамические каркасы сейчас применяют клинически в качестве расширителя костного трансплантата для постеролатерального спондилодеза. Несколько крупных исследований подтвердили эффективность и безопасность данного материала.
Однако в проспективном рандомизированном исследовании, проведенном Korovessis и соавторами, аутотрансплантат подвздошной кости превзошел коралловый гидроксиапатит с аутокостью и костным мозгом при постеролатеральном спондилодезе.
Керамические каркасы также показали свою эффективность при хирургическом лечении сколиоза. Ransford, Muschik и другие авторы провели свои исследования, в ходе которых пористые керамические каркасы успешно использовались с данной целью.
Thalgott и коллеги предложили использовать коралловый гидроксиапатитовый керамический каркас для вентрального спондилодеза, однако керамика не могла противостоять естественным силам без дополнительного усиления титаном.
Другие синтетические формы керамики представлены инъекционными продуктами (используются в вертебропластике) и неинъекционным трикальцийфосфатом.
Неинъекционный трикальцийфосфат демонстрирует хорошие рентгенографические результаты при одно- или двухуровневом поясничном спондилодезе в комбинации с ламинарными аутотрансплантатами.
ДКМ и керамические каркасы уместны для применения в постеролатеральном спондилодезе. Тем не менее, использование других остеоиндуктивных, остеокондуктивных или остеогенных агентов может предоставить дополнительные возможности.
Костные морфогенетические белки
КМБ являются членами семейства трансформирующих факторов роста бета (TGF-β).
Связывание КМБ с его рецепторами, расположенными на поверхности остеогенных клеток-предшественников, приводит к внутриклеточному каскаду, запускающему эндохондральную оссификацию.
Костные морфогенетические белки доступны только после того, как костный матрикс подвергся деминерализации. Для извлечения даже небольшого количества КМБ нужно огромное количество кости, что делает их необычайно дорогими.
Достижения в таких технологиях, как молекулярное секвенирование и клонирование, позволили производить большие количества рекомбинантных белков, включая КМБ.
Рекомбинантный КМБ-2 с рекомбинантным КМБ-7 применяются в клинической практике и продолжают изучаться. rhКМБ растворим, быстро диффундирует из области сращения костей и инактивируется при использовании без посторонней помощи.
Перечисленные выше свойства диктуют важную особенность использования rhКМБ: белок должен быть включен в несущую матрицу, которая периодически высвобождает вещество.
Несколько исследований на животных показали эффективность rhКМБ-2 и КМБ-7 при вентральном и постеролатеральном спондилодезе. Результаты последних исследований демонстрируют быстрое, хорошо контролируемое заживление.
Исследование, проведенное Boden и соавторами, показало высокую скорость сращения позвонков для керамических композитов с rhКМБ-2, сопоставимую или даже лучшую по сравнению с традиционными аутотрансплантатами.
В другом исследовании Dimar и соавторы сопоставляли бычий коллаген или трикальций / гидроксиапатитовый композит с rhКМБ-2 с аутотрансплантатами гребня подвздошной кости для одноуровневого постеролатерального сращения позвоночника.
Композит бычьего коллагена и трикальций / гидроксиапатит с rhКМБ-2 продемонстрировал более высокую скорость сращения, чем у аутотрансплантата гребня подвздошной кости.
Существует достаточно доказательств, что коллагеновые композиты с костными морфогенетическими белками существенно превосходят аутокость. Таким образом, КМБ открывает дорогу к новым, более эффективным костным материалам для спондилодеза.
Однако McClellan, Pradhan и другие авторы приводят неблагоприятные результаты, свидетельствующие о повышенной скорости резорбции и других факторах.
При вентральном спондилодезе шейного отдела позвоночника, несмотря на высокую скорость сращения, коллагеновые композиты с rhКМБ-2 продемонстрировали более высокий риск ограничения движений и радикулопатии по сравнению с использованием аутотрансплантата.
Аутологичный концентрат тромбоцитов
Дегрануляция тромбоцитов и высвобождение факторов роста инициируют заживление переломов и сращение кости. Тромбоцитарный фактор роста и TGF-β стимулируют этот процесс, способствуя пролиферации мезенхимальных стволовых клеток и остеобластов.
Концентрат аутологичного фактора роста получают из ультраконцентрированных тромбоцитов. Сообщалось, что AGF усиливает образование костной ткани при поясничном спондилодезе и других операциях на позвоночнике
Weiner и соавторы провели ретроспективное исследование, в ходе которого сравнивали чистый аутотрансплантат с композитом аутотрансплантат + AGF при постеролатеральном спондилодезе. Последний, как выяснилось, не влияет на эффективность лечения.
Кроме того, проспективное исследование Hee и соавторов, показало, что концентрат аутологичного фактора роста при трансфораминальном межтеловом спондилодезе не увеличивает скорость сращения позвонков.
Carreon продемонстрировал, что аутологичный тромбоцитарный гель при добавлении к аутотрансплантату не повышает скорость сращения при постеролатеральном спондилодезе, не превосходя таковую в контрольной группе аутотрансплантата.
Потенциал самообновления и мультипотентность мезенхимальных стволовых клеток вызвали большой интерес в клинической сфере.
Полученные из костного мозга мезенхимальные стволовые клетки (МСК) обладают определенной эффективностью при спондилодезе. Исследование Caplan, который оценивал МСК для постеролатерального поясничного спондилодеза на модели кролика, показало, что результаты МСК сопоставимы с результатами аутотрансплантата.
Другое исследование, проведенное Wang и соавторами, включало посев аутологичных на керамический композит с фосфатом кальция в модели макаки-резуса. Последний улучшает результаты процедуры переднего поясничного межтелового спондилодеза.
Достижения тканевой инженерии в хирургии позвоночника
В настоящее время тканевая инженерия является интересной областью, показывающей большие перспективы и применимость.
Создаваемые учеными каркасы из биоматериала и соответствующего типа клеток являются биосовместимыми и обладают физико-химическими свойствами, сопоставимыми с нативной тканью. Тканевые каркасы для спондилодеза пока не разработаны, но предварительные результаты исследований являются многообещающими.
Синтетические полимеры — наиболее актуальные биоматериалы благодаря высокой пористости, биосовместимому профилю и высокой посевной способности клеток.
Многие синтетические полимеры уже нашли место в других областях тканевой инженерии, и те материалы, которые демонстрируют привлекательные остеогенные свойства, должны быть изучены в контексте нейрохирургии и ортопедической хирургии.
В исследовании Yong поликапролактоновый каркас с рекомбинантным hКМБ-2 показывает более высокую скорость сращения на модели овец, чем аутотрансплантаты. Эти результаты представляют интерес для хирургов, однако до оптимизации синтеза инновационного продукта и выхода на рынок потребуется время.
Гидрогели также имеют огромные перспективы в области тканевой инженерии.
Гидрогели состоят из сильно гидратированных полимеров с различными механическими и разлагающими свойствами. Гидрогели выделяют нутриенты в межклеточное пространство или механически укрепляют участок сращения костной ткани.
Исследование, проведенное Okamoto и соавторами, показало, что в модели постеролатерального спондилодеза у крыс с аутотрансплантатом и гидрогелем желатина, дополненным трикальцийфосфатом и факторами роста, значительных остеогенных изменений не наблюдалось.
Хотя эта область только начинает развиваться, контролируемое высвобождение факторов роста при сращения позвонков делает гидрогели очень привлекательным вариантом.
Генная терапия для спондилодеза
Ранее генная терапия использовалась при лечении наследственных заболеваний.
Но последние исследования были сосредоточены на доставке генов и замедленном высвобождении биологически активных белков-мишеней.
При спондилодезе можно использовать гены, кодирующие остеоиндуктивные или остеогенные факторы костной ткани. Клетки высвобождают целевой белок в межклеточную среду, чтобы максимизировать остеоиндуктивные и остеогенные свойства этих факторов.
Генная терапия имеет множество потенциальных клинических преимуществ: она относительно рентабельна, не требует культивирования собственных клеток пациента, а техника трансдукции относительно проста. Основным недостатком, связанным с генной терапией, является сложность оценки трансдукции in vivo.
Генная терапия оказалась успешной in vivo на животной модели спондилодеза.
Alden и коллеги вводили ген КМБ-2 в параспинальную область голых крыс и наблюдали образование эндохондральной кости через 12 недель после инъекции.
В аналогичном исследовании Helm и соавторы успешно вводили ген КМБ-9 в параспинальные мышцы голых крыс. Образование костей наблюдалось в месте инъекции через 16 недель после инъекции. Эти и другие исследования демонстрируют, что генная терапия может использоваться в практике хирургии позвоночника.
Для реализации этого подхода используются различные техники ex vivo.
Это требует наличия аутогенных клеток-мишеней, которые получают из донорского участка. Собранные клетки размножают в культуре, трансдуцируют и затем имплантируют пациенту.
Преимущества техники ex vivo состоят в том, что врач может выбирать тип клеток, а количество культивируемым клеток практически не ограничено.
Основными недостатками этого метода является то, что требуется дополнительная стадия забора биоматериала, а культивирование в лаборатории увеличивает время и стоимость.
Благодаря выраженным остеогенным и остеоиндуктивным свойствам мезенхимальные стволовые клетки можно использовать в качестве носителя для генной терапии.
Для латерального межтелового спондилодеза Boden и соавторы усиливали мезенхимальные стволовые клетки белком минерализации LMP-1, используя методику ex vivo, и сообщили об успешном сращении позвонков в кратчайшие сроки.
В аналогичном исследовании Viggeswarapu сообщалось об успешном постеролатеральном спондилодезе на модели кролика с использованием МСК + LMP-1 (Ad-LMP-1).
Wang и соавторы также сообщили об успешной генной терапии ex vivo для постеролатерального спондилодеза на модели крыс Льюиса с использованием мезенхимальных стволовых клеток с Ad-КМБ-2.
Dumont вводил человеческие МСК с Ad-КМБ-9 в параспинальные мышцы голых крыс и продемонстрировал формирование кости в месте инъекции через 8 недель после введения. Эти исследования указывают на значительный потенциал генной терапии.
В США, Китае и ряде стран Европы были проведены исследования, направленные на повышение эффективности генной терапии. В частности, Zhu и соавторы оценили свойства комбинированного Ad-КМБ-2 и Ad-КМБ-7 при постеролатеральном спондилодезе in vitro.
Авторы пришли к выводу, что остеогенная активность клеток была выше для комбинированных Ad-КМБ-2 и Ad-КМБ-7, чем для каждого КМБ отдельно.
Аденовирусы являются наиболее распространенным средством доставки вирусов для заживления кости благодаря своей высокой способности к трансфекции и способности индуцировать выработку большого количества цитокинов.
Однако существуют ограничения, связанные с использованием аденовирусных векторов.
Продукция белка в значительной степени ограничена из-за неспособности векторов интегрироваться в геном хозяина. Это, скорее всего, связано с эписомальной природой аденовирусной ДНК, которая делает ее более восприимчивой к дегенерации нуклеазы.
Аденовирусные векторы могут стимулировать иммунный ответ хозяина, непосредственно продуцируя белки. Иммунная система хозяина может затем разрушить трансдуцированную клетку, делая клетку клинически бесполезной.
Другие вирусные векторы, включая аденоассоциированный и лентивирусный вектор, изучаются с целью компенсации проблем, связанных с аденовирусными векторами.
Несмотря на то, что генная терапия на основе вирусов является многообещающей, по-прежнему существуют серьезные риски в плане безопасности вирусных векторов.
Требуются дополнительные исследования профиля побочных эффектов и отсроченных последствий, прежде чем вирусные векторы появятся в хирургии позвоночника.
На сегодняшний день аутокость считается наиболее эффективным костным материалом для спондилодеза. Тем не менее, альтернативные материалы активно изучаются и внедряются в клиническую практику, в том числе деминерализованный костный матрикс.
Новые материалы устраняют риски, связанные с получением аутокости, и способствуют повышению эффективности лечения за счет добавления биологических молекул — факторов роста костной ткани. Существуют убедительные доказательства, что рекомбинантные КМБ могут использоваться для ускорения сращения позвонков при спондилодезе.
Инновационные технологии, такие как МСК, генная терапия и тканевая инженерия, показывают большие перспективы в моделях на животных. Будущие исследования должны дополнительно оценить клиническую значимость и применимость этих новых технологий.